L’incidenza delle malattie da clamidia e gonococco in Svizzera è in aumento. Allo stesso tempo, i gonococchi multi-resistenti e il M. genitalium rendono più difficile la terapia antibiotica. Sono necessarie nuove strategie per prevenire la diffusione di questi agenti patogeni.
L’uretrite è la malattia a trasmissione sessuale più comune negli uomini. Rappresenta un’infiammazione dell’uretra con un aumento dei leucociti nell’essudato uretrale. Sebbene possano essere presenti cause infettive e non infettive (Tab. 1), la maggior parte è causata da agenti patogeni trasmessi sessualmente. A causa dell’alta incidenza e delle possibili complicanze dell’infezione da patogeni uretrici nei pazienti e nei partner sessuali, la gestione della malattia ha un’alta priorità nell’assistenza sanitaria pubblica. Oltre a trattare i sintomi, gli obiettivi del trattamento sono evitare le complicazioni e ridurre la trasmissione delle co-infezioni (come l’HIV). L’identificazione e il trattamento delle persone di contatto, così come le misure educative con la motivazione a un comportamento adattato, hanno in definitiva un’ulteriore importanza epidemiologica.

Classificazione e sintomi
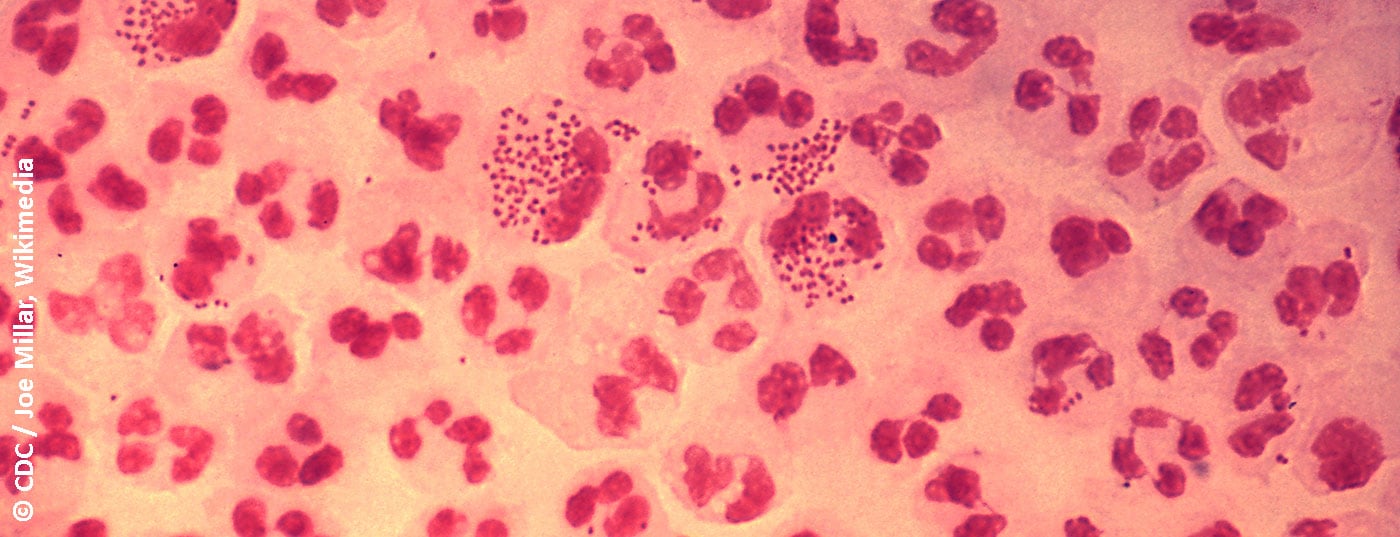
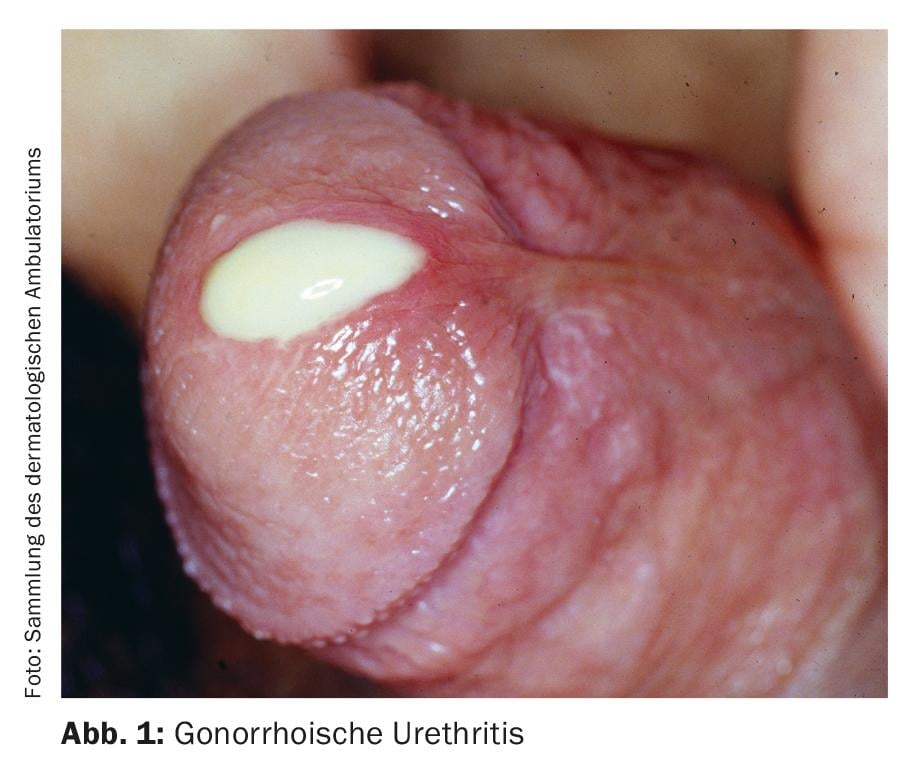
La classificazione dell’uretrite in forme gonorroiche e non gonorroiche si basa sulla tradizionale colorazione di Gram dello scarico uretrale per i diplococchi gram-negativi. I sintomi tipici sono le perdite, tipicamente purulente nell’uretrite gonorroica (Fig. 1), mucoidi nell’uretrite non gonorroica. Altri sintomi possibili sono la disuria, il bruciore o il prurito uretrale e l’irritazione del meato uretrale, a volte con balanite accompagnata. Tuttavia, l’uretrite è spesso asintomatica [4]. L’uretrite deve essere distinta da un’infezione del tratto urinario o da una prostatite, che devono essere considerate come diagnosi differenziale.
Spettro patogeno
I patogeni più comuni sono la Neisseria gonorrhoeae, la Chlamydia trachomatis e i micoplasmi, soprattutto il Mycoplasma genitalium (M. genitalium). L’incidenza delle infezioni da clamidia e della gonorrea è aumentata notevolmente in Svizzera negli ultimi anni. Tra i micoplasmi, l’importanza patogena di M. genitalium è meglio stabilita. Va notato che la difficoltà di eradicazione completa e un crescente problema di resistenza complicano la terapia dei micoplasmi. Attualmente, gli autori delle linee guida britanniche per la gestione delle infezioni da M. genitalium si sono espressi contro lo screening di individui asintomatici, in quanto è più probabile che questo provochi danni a livello di popolazione [5]. Finora è stata prestata poca attenzione all’importanza degli agenti patogeni della vaginosi batterica come causa dell’uretrite. Dopo un rapporto orale, i germi respiratori come l’Haemophilus spp. e i patogeni virali come l’herpes simplex e gli adenovirus (spesso con congiuntivite annessa) sono più frequenti. Nei viaggiatori di ritorno da aree endemiche, può essere utile anche la ricerca del Trichomonas vaginalis.
Diagnostica
Il work-up dei sintomi uretrali comprende l’anamnesi, l’esame clinico, la preparazione di un campione diretto integrato da esami di laboratorio per la ricerca di agenti patogeni uretrali. Inoltre, di solito è opportuno uno screening esteso per le malattie a trasmissione sessuale, come l’HIV e la sifilide. L’anamnesi sessuale (nella lingua del paziente) deve esplorare le pratiche sessuali, le misure di protezione, il numero di partner e l’orientamento sessuale, al fine di effettuare una valutazione del rischio differenziata e di poter consigliare il paziente in modo mirato. Clinicamente, oltre alla valutazione del fluoro, si cerca una linfoadenopatia inguinale, nonché eventuali ulcerazioni. La diagnosi prevede, quando possibile, una preparazione diretta, nell’uomo mediante uno striscio dall’uretra, nella donna dal canale cervicale [6].
La morfologia dello striscio aiuta a distinguere l’uretrite gonorroica da quella non gonorroica sulla base dei tipici diplococchi intracellulari e di una genesi virale con predominanza di cellule mononucleate. La sensibilità e la specificità di altri metodi diagnostici sono inferiori allo striscio uretrale. Se la microscopia non è disponibile, l’uretrite può essere diagnosticata dalla presenza di perdite mucopurulente, da un test positivo dell’esterasi leucocitaria nell’esame delle urine del primo getto o dalla presenza di striature nelle urine del primo getto (possibile anche fisiologicamente) [6].
Il tampone uretrale o l’urina del primo flusso vengono analizzati anche per Neisseria gonorrhoeae, Chlamydia trachomatis e, nei pazienti sintomatici, anche per M. genitalium mediante amplificazione genica. Si dovrebbe sempre tentare un esame batteriologico dello striscio mediante coltura, in quanto la coltura viene utilizzata per esaminare il profilo di resistenza dei gonococchi e per cercare altri patogeni batterici. Se disponibile, si dovrebbe anche ricercare la resistenza ai macrolidi quando viene identificato M. genitalium, utilizzando la reazione a catena della polimerasi per analizzare i geni di resistenza noti. Nelle pazienti di sesso femminile, l’esame del tampone vaginale per l’amplificazione genica è superiore all’urina iniziale per la diagnosi di gonorrea o infezione clamidia.
Terapia
Nei pazienti con uretrite confermata, si raccomanda il trattamento concomitante sia dei gonococchi che della clamidia, a meno che non siano già disponibili i risultati del test di amplificazione genetica per limitare la terapia al patogeno specifico. Le raccomandazioni terapeutiche per l’uretrite gonorroica e non gonorroica senza complicazioni, adattate in base alle attuali linee guida, sono riassunte nella tabella 2. Per la gonorrea, lo standard è la doppia terapia antimicrobica di combinazione. L’approccio terapeutico combinato ha lo scopo di fornire una migliore garanzia di eradicazione, in modo da prevenire la diffusione di gonococchi resistenti. Nell’uretrite non gonorroica, la terapia con doxiciclina è mirata all’infezione clamidica; in questo caso non è noto un problema di resistenza. Se è presente un’infezione da M. genitalium, tuttavia, solo il 30% viene trattato con la doxiciclina e la terapia non porta allo sviluppo di resistenza [7].

La terapia con azitromicina 1 g (dose singola) deve essere evitata, se possibile, a causa del rischio di indurre resistenza ai macrolidi in M. genitalium. L’azitromicina non è una terapia affidabile, soprattutto per la comune coinfezione rettale asintomatica da clamidia. Se viene rilevato il M. genitalium, l’azitromicina deve essere somministrata per diversi giorni, ad esempio 500 mg il giorno 1 seguito da 250 mg al giorno per altri 4 giorni. In questo modo si ottiene una migliore eradicazione rispetto alla dose singola [7], in modo da ridurre lo sviluppo della resistenza [8]. Quando si utilizza la moxifloxacina, si deve tenere conto della possibile epatotossicità.
L’identificazione e la terapia dei partner sessuali è ovviamente di grande importanza per il partner affetto, per il paziente per prevenire la reinfezione e dal punto di vista epidemiologico, soprattutto in considerazione del crescente problema della resistenza. Come linea guida, i partner sessuali degli ultimi 60 giorni devono essere chiariti e trattati. La raccomandazione di astinenza sessuale vale per almeno una settimana o fino al completamento dell’esame [1].
Nel caso dei gonococchi, il successo della terapia viene verificato non prima di due settimane [9], e nel caso del micoplasma non prima di tre settimane, o meglio dopo cinque settimane [7]. Il controllo della terapia per la clamidia è consigliato solo durante la gravidanza o dopo la terapia di seconda linea, quattro settimane dopo la terapia [10]. Tuttavia, la reinfezione da clamidia deve essere ricercata dopo tre mesi.
Misure per contenere lo sviluppo della resistenza nei gonococchi e in M. genitalium
Nei gonococchi e nel M. genitalium sono stati rilevati in tutto il mondo casi di resistenza estesa agli antibiotici comunemente usati, di cui si teme la diffusione. Negli ultimi anni, in Svizzera è stata osservata una riduzione della suscettibilità dei gonococchi al ceftriaxone [13]. Nel 2018, sono stati identificati in Inghilterra e in Australia un totale di tre casi di infezioni gonococciche resistenti sia al ceftriaxone che all’azitromicina [14]. Per il M. genitalium, la resistenza ai macrolidi è comune nei Paesi in cui viene utilizzata la terapia di prima linea con azitromicina. La resistenza alla moxifloxacina è presente in <10% in Europa ed è molto più comune in Asia. A causa della situazione di resistenza, si teme che presto le infezioni da M. genitalium non saranno più curabili.
Le misure per combattere la resistenza nei gonococchi includono il prelievo costante di una coltura e, nel caso di M. genitalium, la ricerca dei geni di resistenza mediante amplificazione genica, se possibile, al fine di utilizzare una terapia adatta alla determinazione della resistenza. A seconda dell’agente patogeno, si devono prendere in considerazione anche le infezioni faringee e anali concomitanti, spesso asintomatiche, che devono essere sempre più ricercate e trattate. L’uso dell’azitromicina 1 g in dose singola deve essere evitato, se possibile, e anche il suo impiego nella terapia combinata della gonorrea è controverso. L’attuazione di una terapia di controllo, la terapia di coppia e le misure preventive relative al comportamento sessuale sono ulteriori misure per prevenire la diffusione di patogeni resistenti.
Messaggi da portare a casa
- L’incidenza delle malattie da clamidia e gonococco in Svizzera è in aumento.
- Allo stesso tempo, in tutto il mondo, anche nella regione europea, nel
- Negli ultimi anni, sono stati trovati gonococchi e M. genitalium multi-resistenti che non possono più essere trattati con gli antibiotici comunemente usati.
- Sono indicate nuove strategie per prevenire la diffusione di questi agenti patogeni.
Letteratura:
- Lautenschlager S: Uretrite non gonorroica: spettro patogeno e gestione. Journal of Urology and Urogynecology 2014; 21 (1) (edizione per la Svizzera): 17-20.
- Moi H, Blee K, Horner PJ: Gestione dell’uretrite non gonococcica. BMC Infect Dis 2015;15: 294.
- Bachmann LH, et al.: Progressi nella comprensione e nel trattamento dell’uretrite maschile. Clin Infect Dis 2015; 61(Suppl 8): 763-769.
- Kälin U, Lauper U, Lautenschlager S: Uretrite. Spettro patogeno, chiarimenti e terapia – Parte 2. Schweiz Med Forum 2009; 9: 121-124.
- Soni S, et al: 2018 BASHH UK national guideline for the management of infection with Mycoplasma genitalium, bozza, download da www.bashhguidelines.org/media/1182/bashh-mgen-guideline-2018_draft-for-consultation.pdf, ultimo accesso 16.11.2018.
- Horner P, et al: Linea guida europea 2016 sulla gestione dell’uretrite non gonococcica. International Journal of STD & AIDS 2016; 27: 928-937.
- Jensen JS, Cusini M, Gomberg M, Moi H: Linea guida europea 2016 sulle infezioni da Mycoplasma genitalium. J Eur Acad Dermatol Venereol 2016; 30: 1650-1656.
- Lau A, et al: L’efficacia dell’azitromicina per il trattamento del Mycoplasma genitalium: una revisione sistematica e una meta-analisi. Clin Infect Dis 2015; 61: 1389-1399.
- Bignell C, Unemo M: Linea guida europea 2012 sulla diagnosi e il trattamento della gonorrea negli adulti. Int J STD AIDS 2013; 24: 85-92.
- Lanjouw E, et al: Linea guida europea 2015 sulla gestione delle infezioni da Chlamydia trachomatis. Int J STD AIDS 2016; 27: 333-348.
- Toutos Trellu L, et al: Gonorrea: nuove raccomandazioni su diagnosi e trattamento. Schweiz Med Forum 2014; 14(20): 407-409.
- Horner P, et al.: Linea guida europea 2016 sulla gestione dell’uretrite non gonococcica. International Journal of STD & AIDS 2016; 27(11): 928-937.
- Kovari H, et al.: Diminuzione della sensibilità degli isolati di Neisseria gonorrhoeae in Svizzera a cefixime e ceftriaxone: dati di sensibilità antimicrobica dal 1990 e dal 2000 al 2012. BMC Infectious Diseases 2013; 13: 603.
- Centro Europeo per la Prevenzione e il Controllo delle Malattie: Rapid Risk Assessment: Extensively drug-resistant (XDR) Neisseria gonorrhoeae in Regno Unito e Australia, Data di pubblicazione 7 maggio 2018, www.ecdc.europa.eu, ultimo accesso 07.11.2018.
PRATICA DERMATOLOGICA 2018; 28(6): 4-7