L’uso dei test multigene è attualmente limitato alla situazione adiuvante nel carcinoma mammario luminale HER2-negativo e consente previsioni riproducibili del rischio di recidiva. I test porteranno a un minor numero di chemioterapie nel prossimo futuro. Tuttavia, le chemioterapie adiuvanti non necessarie possono già essere evitate con l’applicazione coerente degli attuali criteri di San Gallo o delle linee guida ESMO. Gli studi prospettici che coinvolgono OncotypeDX e MammaPrint saranno disponibili nei prossimi anni, ma non testano questi metodi rispetto agli strumenti precedenti come desiderato. I metodi di prova molecolari devono essere utilizzati per l’approvazione o la l’assunzione dei costi sia sottoposta agli stessi criteri e alle stesse richieste dei farmaci. La copertura dei costi da parte delle assicurazioni sanitarie obbliga ad un’applicazione critica senza estrapolazioni a situazioni non testate: Nelle donne a basso rischio o con evidenti controindicazioni alla chemioterapia, se ne dovrebbe fare a meno.
Una meta-analisi basata sui dati di 6200 pazienti con carcinoma mammario non ha potuto mostrare alcun beneficio in termini di sopravvivenza dalla chemioterapia adiuvante ad alte dosi con trapianto autologo di cellule staminali [1]. All’Inselspital, undici pazienti sono stati trattati in questo modo dal 1997 al 1999, nell’ambito dello studio IBCSG-15-95. Nell’editoriale della meta-analisi, si fa riferimento alle attuali scoperte sulla biologia che porterebbero a trattamenti efficaci e meno rischiosi. La frase finale “Ricordiamo con gratitudine le donne che si sono arruolate volontariamente negli studi clinici che ci hanno permesso di ottenere questi risultati” dimostra che l’efficacia della chemioterapia è stata sopravvalutata e che da allora è avvenuto un cambiamento di atteggiamento. Nella meta-analisi, l’anno di pubblicazione è sorprendente: 2011. Questo perché i dati relativi a circa 100.000 donne con tumore al seno mostrano che la chemioterapia adiuvante riduce le recidive dell’8% nell’arco di dieci anni, la mortalità per tumore al seno del 6,5% e la mortalità generale del 5% [2]. Nel confronto diretto qui consentito, il tamoxifene è più efficace: il rischio di recidiva si riduce del 13,2% nell’arco di 15 anni, la mortalità per cancro al seno del 9,2% e la mortalità generale del 9,5%. Tuttavia, l’effetto maggiore è riservato ai pazienti con tumori ormono-sensibili [3].
Tipi di cancro al seno intrinseci e marcatori surrogati
I profili di espressione genica hanno identificato quattro gruppi di carcinoma mammario con diverso decorso clinico e risposta alla terapia (“sottotipi intrinseci”) più di dieci anni fa:
- Tumori positivi al recettore ormonale (HR) con bassa aggressività (Luminal A)
- Tumori HR-positivi con maggiore aggressività (Luminal B)
- Tumori HER2-positivi (HER2+)
- Carcinomi HR- ed HER2-negativi con o senza caratteristiche di cellule basali (basali e normali, triplo-negativi) [4].
Le analisi successive hanno mostrato che i quattro gruppi semplificano la realtà. Il gruppo più eterogeneo è il tipo Luminal A con una resistenza relativa alla chemioterapia [5,6]. Va chiarito subito che questi metodi hanno utilizzato diverse migliaia di geni e non devono essere confusi con i test multigenici discussi qui. Poiché le prime non sono disponibili nella routine, sono state cercate definizioni surrogate (Tab. 1).

I sottotipi di carcinoma mammario intrinseco, basati sulla determinazione dei recettori dell’estrogeno (ER) e del progesterone (PR), della proliferazione (Ki67) e di HER2 (immunoistochimica o FISH), sono stati inclusi nella Consensus di San Gallo del 2011 [7]. Data l’importanza predittiva della risposta alle terapie disponibili (ormonali e chemioterapiche, nonché terapie mirate all’HER2), questi sottotipi hanno costituito la base delle raccomandazioni per la terapia adiuvante; in precedenza, queste raccomandazioni si basavano principalmente sulla valutazione della prognosi con fattori non biologici (dimensioni del tumore, numero di linfonodi interessati).
Il punto cruciale della definizione surrogata: carcinomi luminali A e luminali B
Una paziente con cancro al seno vuole sapere se trarrà beneficio da una determinata terapia o meno. A differenza dei carcinomi triplo-negativi e della maggior parte dei carcinomi HER2+, la questione relativa alla chemioterapia nel carcinoma mammario luminale è come identificare le persone colpite che trarranno beneficio da questa terapia – oltre alla terapia ormonale. La proliferazione è un fattore predittivo e viene utilizzata per distinguere i carcinomi di tipo luminale A da quelli di tipo luminale B (Tab. 1). Tuttavia, la proliferazione è una variabile continua, che richiede un valore soglia per l’applicazione clinica. Dopo che questo valore per definire il tipo Luminal B-like era del 14% nella Consensus di St Gallen del 2011 (cioè Ki67 >14% = Luminal B-like), è stato aumentato al 20% nel 2013 e al 20-30% nel 2015 con il 36% dei voti [6]. Nella votazione del 2015, il 20% dei presenti si è astenuto e la stessa percentuale del gruppo di esperti ha negato a Ki67 la giustificazione di questa distinzione [6].
Nonostante gli sforzi internazionali, la determinazione del Ki67 non è ancora stata standardizzata. La riproducibilità non è stata migliorata nemmeno dopo le discussioni tra 15 patologi svizzeri [8]. Tuttavia, è stato raggiunto un ottimo accordo nella fascia bassa (<10%) e alta (>30%). Il Ki67 macchia le cellule nelle fasi G1, S, G2 e M del ciclo cellulare, il che, oltre agli aspetti tecnici (definizione della positività, selezione delle frazioni tumorali), può spiegare i risultati discordanti. Nonostante la promozione intensiva dei test multigenici commerciali e il fascino delle tecniche moderne, sono auspicabili ulteriori studi in questo campo.
I test multigen non sono comparabili
Diversi test hanno colmato questa lacuna con un grande potenziale di mercato. Sono stati menzionati nel Consenso di San Gallo dal 2011 e sono già stati inclusi in diverse linee guida. Per una panoramica, si rimanda all’articolo di Patrizia Sager, MD (InFo ONKOLOGIE & HÄMATOLOGIE 2/2015). Nei modelli multivariati, i test quantificano la positività HR e la proliferazione.
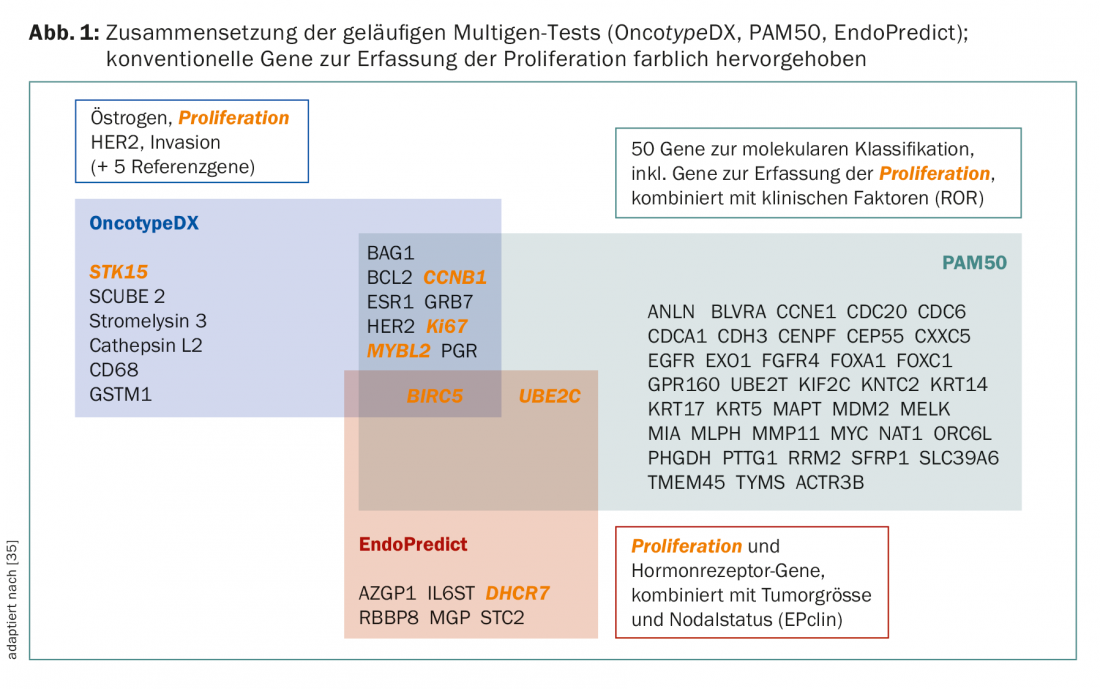
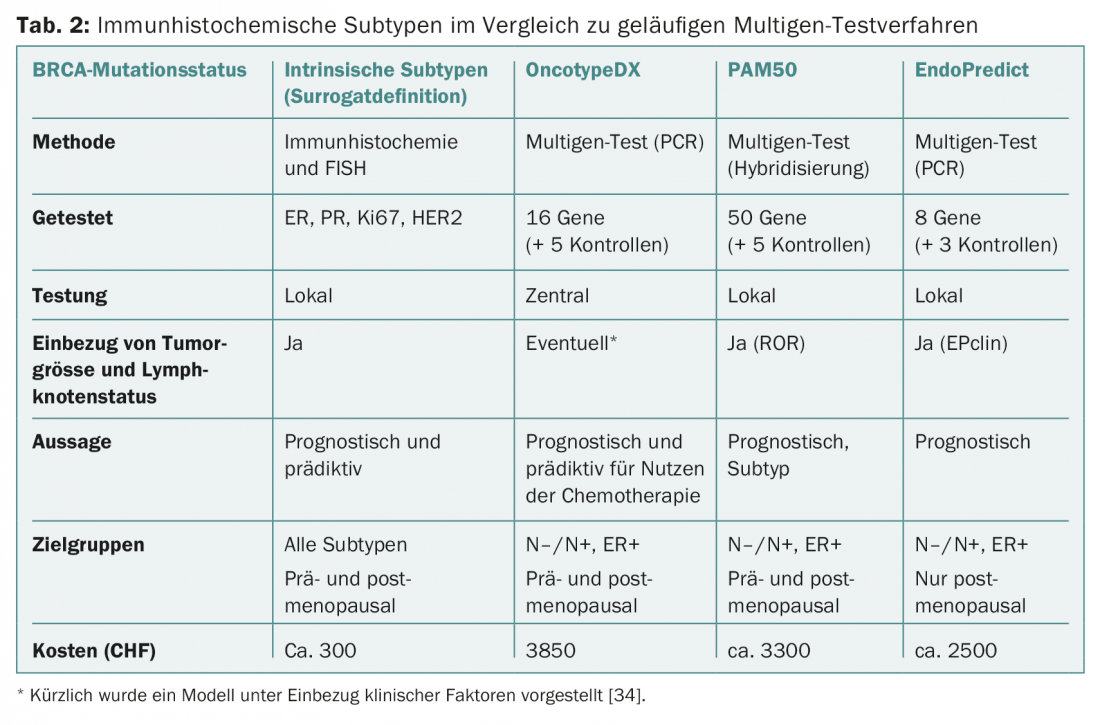
Anche se i test perseguono lo stesso obiettivo in linea di principio, non sono comunque concettualmente comparabili. Ci sono differenze nei set di geni e nei casi primari per lo sviluppo e la validazione (Fig. 1 e Tab. 2). Ad esempio, il PAM50 include i geni per i tumori ER+/- e riflette i tipi intrinseci [9], mentre l’OncotypeDX è stato compilato per prevedere il beneficio della chemioterapia nei tumori ER+ [10]. MammaPrint misura il rischio di recidiva nelle pazienti non trattate [11,12]. I fattori clinici influenzano il risultato finale di PAM50 (come PAM50 ROR) e di EndoPredict (come EPclin), diluendo il valore della “biologia”.
Di conseguenza, i diversi risultati nei confronti diretti (accademici!) dei test non sono inaspettati [13–15]. Il rischio rilevato da un test è anche una variabile continua, che si è rivelata un ostacolo nell’immunoistochimica.
Test multigene: prognostici e/o predittivi
I marcatori prognostici predicono il decorso della malattia, indipendentemente dal trattamento. I marcatori predittivi indicano se un trattamento avrà successo o meno. Alcuni fattori sono prognostici e predittivi; nel caso di HER2, la disponibilità di farmaci specifici ha poi fatto scomparire il valore prognostico [16]. È generalmente accettato che le procedure per il carcinoma mammario ER+/HER2- utilizzino informazioni aggiuntive, come le dimensioni del tumore e il grado di differenziazione, per determinare la probabilità di recidiva. I test di prima generazione (OncotypeDX, Mammaprint, Genomic Grade Index) possono prevedere le recidive nei primi cinque anni. I metodi più recenti (PAM50, EndoPredict, Breast Cancer Index) hanno prestazioni migliori nel predire la recidiva dopo cinque anni, il che è rilevante a causa della durata delle terapie ormonali [17–19]. Altre possibili applicazioni dei test, oltre al tipo intrinseco, sono la previsione del tasso di risposta nella terapia neoadiuvante [20–22] e, con alternative limitate, la valutazione del rischio nelle condizioni precancerose [23].
L’OncotypeDX porta – in studi per lo più non controllati – a un minor numero di chemioterapie e fa sì che i medici, attualmente spaventati, si sentano più sicuri nelle loro decisioni [24,25]. La “psicologia” della possibilità di utilizzare l’OncotypeDX nella scelta delle terapie adiuvanti faceva parte dello studio SAKK 26/10; prevedibilmente mostrerà la grande influenza dell’OncotypeDX sulle decisioni [25]. Recentemente, è stato dimostrato che il test PAM50 può identificare i pazienti nodali-positivi che non beneficiano della chemioterapia [26].
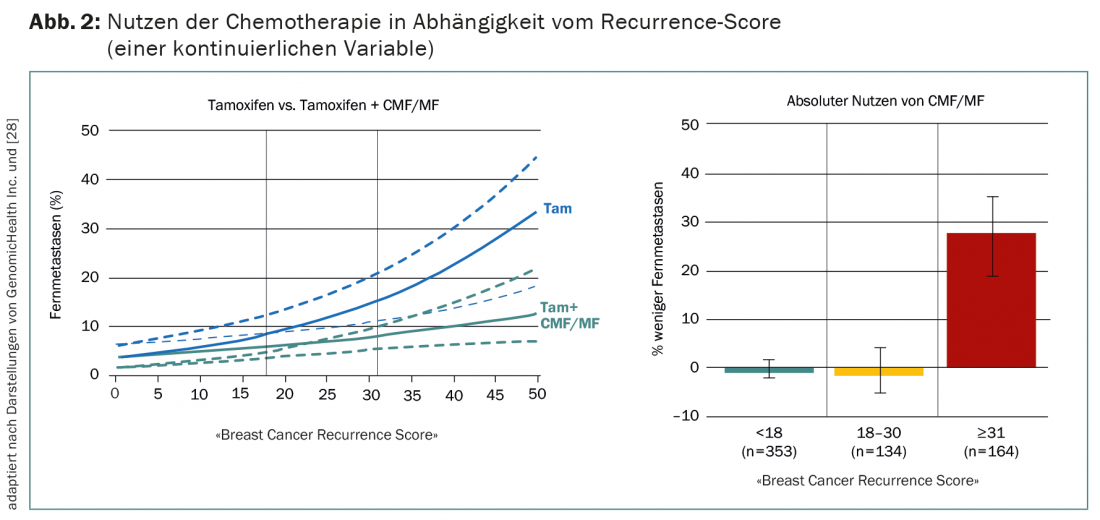
Attualmente, l’evidenza più convincente del test multigene nel cancro al seno proviene da un’analisi su pazienti ER+ nodo-negative. Nello studio NSABP B20, sono state randomizzate a ricevere il tamoxifene con o senza chemioterapia per la CMF/MF, che oggi viene utilizzata raramente [27]. Il successivo OncotypeDX in 651 dei 2299 pazienti mostra che la chemioterapia è utile solo per coloro che hanno un’alta probabilità di recidiva (punteggio di recidiva >30) (Fig. 2) [28]. Sensu stricto, non si tratta quindi di una convalida prospettica, come spesso si sostiene.
Valore aggiunto dei test multigene?
“Devo fare la chemioterapia?”. Con questa domanda retorica, i test commerciali fanno pubblicità, ad esempio con il seguente caso di studio sul sito web: carcinoma duttale invasivo di 1,8 cm in una donna in postmenopausa, N0, G2, ER 90%, PR 40%, Ki67 15%. La probabilità di recidiva, espressa come punteggio di recidiva, è bassa, pari a 13, e il beneficio aggiuntivo della chemioterapia è minimo [28]. In base agli attuali criteri di St. Gallen [6] o alle linee guida ESMO [29], questa donna non ha bisogno di una chemioterapia adiuvante in aggiunta a un inibitore dell’aromatasi.
Attualmente sono in corso tre grandi studi prospettici (Mindact, TailorX, RxPONDER) che testano in modo casuale la terapia ormonale rispetto alla combinazione con la chemioterapia, a seconda del risultato di OncotypeDX o MammaPrint (Fig. 3) .
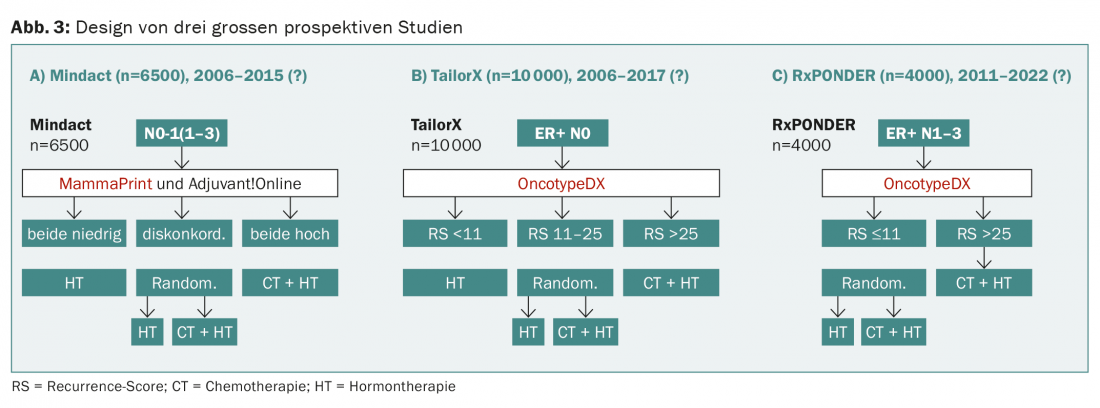
Nello studio prospettico WSG-planB, vengono confrontate due chemioterapie per un punteggio di recidiva di >11, tra gli altri. Il design di WSG-ADAPT è interessante: nel post-operatorio si segue un approccio simile a TailorX, ma si tiene conto anche della risposta a tre settimane di terapia ormonale. Tuttavia, in nessuno di questi studi uno dei test viene “testato”, come sarebbe richiesto dal disegno ideale dello studio ed è consueto per i farmaci (Fig. 4).
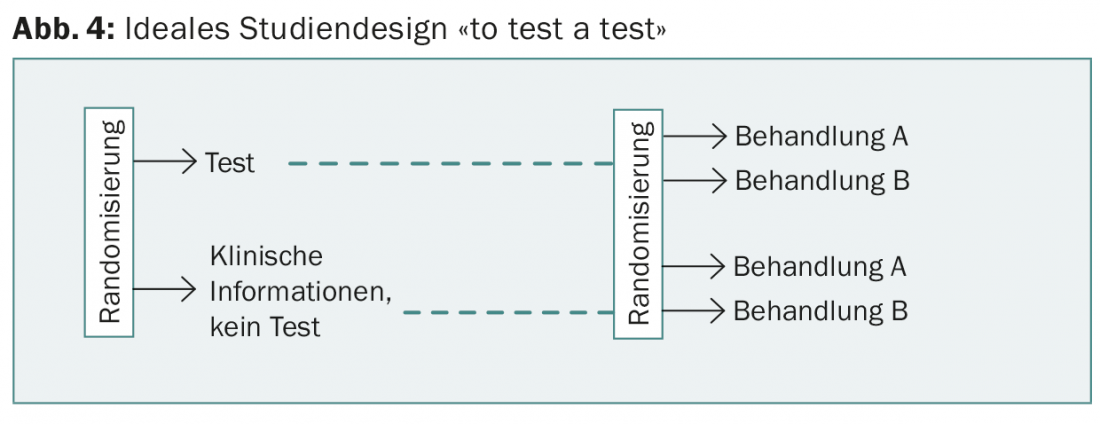
Tuttavia, ciò sarebbe necessario per dimostrare il valore aggiunto dei nuovi test rispetto alle informazioni precedenti (compresa la migliore determinazione Ki67 possibile) e per giustificare i costi aggiuntivi. Questi ultimi sono coperti dall’assicurazione sanitaria dall’inizio del 2015 e variano (Tab. 2). Nessun test finora permette di fare una previsione sulla scelta di una chemioterapia specifica.
I fornitori concorrenti si mettono comprensibilmente nella luce migliore e combattono duramente. Sebbene non sia confermato, il sito web del produttore di OncotypeDX, ad esempio, sostiene che il test può aiutare anche in caso di stato HER2 non chiaro [30,31]. Questo spiega perché i costi di Herceptin® sono stati inclusi nei calcoli che certificano in modo definitivo il rapporto costo-efficacia di questo test [32]. Come dimostra l’esperienza con altri prodotti concorrenti in oncologia, senza confronti pionieristici in Svizzera, i vari prodotti si affermeranno nella vita quotidiana e porteranno a un puzzle federale anche qui.
Finché la riproducibilità non è compromessa, il test locale è vantaggioso perché è possibile la consultazione tra i medici e la patologia. Lo dimostra il caso di una paziente con carcinoma mammario multifocale, inclusa nello studio SAKK 26/10 dell’Inselspital. La proliferazione dei carcinomi da tre a 1 cm, determinata con Ki67, era del 19%, 27% e 53%. Il punteggio di recidiva OncotypeDX determinato nella lontana California è stato indicato come 13%, il che non può essere messo in discussione in termini di rappresentatività. Inoltre, nello spirito della medicina basata sull’evidenza, le estrapolazioni a popolazioni non testate, ad esempio l’uso dell’EndoPredict nelle donne in premenopausa, non sono ammissibili.
Addendum: i primi risultati dello studio TailorX [33], pubblicati dopo la presentazione di questo manoscritto, rimangono concettualmente ininfluenti sulle affermazioni fatte.
Letteratura:
- Berry DA, et al: Chemioterapia ad alto dosaggio con supporto di cellule staminali autologhe come terapia adiuvante nel cancro al seno: panoramica di 15 studi randomizzati. J Clin Oncol 2011; 29: 3214-3223.
- Peto R, et al: Confronto tra diversi regimi di polichemioterapia per il carcinoma mammario precoce: meta-analisi dei risultati a lungo termine tra 100.000 donne in 123 studi randomizzati. Lancet 2012; 379: 432-444.
- Davies C, et al: Rilevanza dei recettori ormonali del cancro al seno e di altri fattori sull’efficacia del tamoxifene adiuvante: meta-analisi a livello di paziente di studi randomizzati. Lancet 2011; 378: 771-784.
- Sotiriou C, et al: Classificazione del cancro al seno e prognosi basata sui profili di espressione genica di uno studio basato sulla popolazione. Proc Natl Acad Sci USA 2003; 100: 10393-10398.
- Ciriello G, et al: La diversità molecolare dei tumori mammari luminali A. Breast Cancer Res Treat 2013; 141: 409-420.
- Coates AS, et al: Terapie su misura – migliorare la gestione del carcinoma mammario precoce: St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2015. Ann Oncol 2015; 26: 1533-1546.
- Goldhirsch A, et al: Strategie per i sottotipi – affrontare la diversità del cancro al seno: i punti salienti del consenso internazionale degli esperti di San Gallo sulla terapia primaria del cancro al seno precoce 2011. Ann Oncol 2011; 22: 1736-1747.
- Varga Z, et al: Quanto è affidabile l’immunoistochimica Ki-67 nei carcinomi mammari di grado 2? Uno studio di AQ del Gruppo di lavoro svizzero di ginecopatologi e senologi. PLoS One 2012; 7: e37379.
- Parker JS, et al: Predittore di rischio supervisionato del cancro al seno basato su sottotipi intrinseci. J Clin Oncol 2009; 27: 1160-1167.
- Paik S, et al: Un test multigene per prevedere la recidiva del cancro al seno trattato con tamoxifene, nodo-negativo. N Engl J Med 2004; 351: 2817-2826.
- van de Vijver MJ, et al: Una firma di espressione genica come predittore di sopravvivenza nel cancro al seno. N Engl J Med 2002; 347: 1999-2009.
- van ‘t Veer LJ, et al: Il profilo di espressione genica predice l’esito clinico del cancro al seno. Natura 2002; 415: 530-536.
- Dowsett M, et al: Confronto del punteggio di rischio di recidiva PAM50 con l’oncotype DX e l’IHC4 per prevedere il rischio di recidiva a distanza dopo la terapia endocrina. J Clin Oncol 2013; 31: 2783-2790.
- Fan C, et al: Concordanza tra i predittori basati sull’espressione genica per il cancro al seno. N Engl J Med 2006; 355: 560-569.
- Varga Z, et al: Confronto tra i risultati dei test EndoPredict e Oncotype DX nel carcinoma mammario invasivo positivo ai recettori ormonali. PLoS One 2013; 8: e58483.
- Buyse M, et al: Integrazione dei biomarcatori negli studi clinici. Expert Rev Mol Diagn 2011; 11: 171-182.
- Goss PE, et al: Uno studio randomizzato sul letrozolo nelle donne in postmenopausa dopo cinque anni di terapia con tamoxifene per il cancro al seno in fase iniziale. N Engl J Med 2003; 349: 1793-1802.
- Davies C, et al: Effetti a lungo termine della prosecuzione del tamoxifene adiuvante a 10 anni rispetto all’interruzione a 5 anni dopo la diagnosi di tumore al seno positivo al recettore degli estrogeni: ATLAS, uno studio randomizzato. Lancet 2013; 381: 805-816.
- Bianchini G, et al: La proliferazione e la segnalazione degli estrogeni possono distinguere le pazienti a rischio di recidiva precoce da quelle tardive tra i tumori al seno positivi al recettore degli estrogeni. Breast Cancer Res 2013; 15: R86.
- Pivot X, et al: Nell’era della genomica, le dimensioni del tumore dovrebbero essere riconsiderate come criterio per la chemioterapia neoadiuvante? Oncologist 2015; 20: 344-350.
- Gluck S, et al: La sottotipizzazione molecolare del cancro al seno in fase iniziale identifica un gruppo di pazienti che non traggono beneficio dalla chemioterapia neoadiuvante. Breast Cancer Res Treat 2013; 139: 759-767.
- Esserman LJ, et al: La risposta alla chemioterapia e la sopravvivenza libera da recidiva nel carcinoma mammario neoadiuvante dipendono dai profili dei biomarcatori: risultati dell’I-SPY 1 TRIAL (CALGB 150007/150012; ACRIN 6657). Breast Cancer Res Treat 2012; 132: 1049-1062.
- Rakovitch E, et al: Uno studio di validazione basato sulla popolazione del DCIS Score che predice il rischio di recidiva nelle persone trattate con la sola chirurgia conservativa del seno. Breast Cancer Res Treat 2015; 152: 389-398.
- Eiermann W, et al: Il test del punteggio di recidiva a 21 geni ha un impatto sulle raccomandazioni di terapia adiuvante per il carcinoma mammario precoce ER-positivo, nodo-negativo e nodo-positivo, con conseguente modifica dell’uso della chemioterapia in base al rischio. Ann Oncol 2013; 24: 618-624.
- Augustovski F, et al: Impatto decisionale sull’assegnazione della chemioterapia adiuvante nel carcinoma mammario precoce nodo-negativo con un test a 21 geni: revisione sistematica e meta-analisi. Breast Cancer Res Treat 2015; 152: 611-625.
- Gnant M, et al: Identificazione di sottogruppi prognostici clinicamente rilevanti di donne in postmenopausa con carcinoma mammario in stadio precoce positivo ai recettori ormonali, trattate con terapia endocrina: un’analisi combinata di ABCSG-8 e ATAC utilizzando il punteggio di rischio di recidiva PAM50 e il sottotipo intrinseco. Ann Oncol 2015; 26: 1685-1691.
- Fisher B, et al: Tamoxifene e chemioterapia per il cancro al seno linfonodo-negativo, positivo al recettore degli estrogeni. J Natl Cancer Inst 1997; 89: 1673-1682.
- Paik S, et al: Espressione genica e beneficio della chemioterapia nelle donne con cancro al seno nodo-negativo, positivo al recettore degli estrogeni. J Clin Oncol 2006; 24: 3726-3734.
- Senkus E, et al: Carcinoma mammario primario: Linee guida di pratica clinica ESMO per la diagnosi, il trattamento e il follow-up. Ann Oncol 2015; 26 Suppl 5: v8-v30.
- Dabbs DJ, et al: Alto tasso di falsi negativi della reazione a catena della polimerasi di trascrizione inversa quantitativa di HER2 del test Oncotype DX: uno studio indipendente di garanzia della qualità. J Clin Oncol 2011; 29: 4279-4285.
- Bhargava R, Dabbs DJ: Test Oncotype DX su casi inequivocabilmente HER2-positivi: potenziale di danno. J Clin Oncol 2012; 30: 570-571.
- Holt S, et al: Un impatto decisionale, un conflitto decisionale e una valutazione economica del test Oncotype DX di routine su 146 donne con tumore al seno nodo-negativo o pNImi, ER-positivo nel Regno Unito. Br J Cancer 2013; 108: 2250-2258.
- Sparano JA, et al: Validazione prospettica di un test di espressione di 21 geni nel cancro al seno. N Engl J Med 2015 Nov 19; 373(21): 2005-2014.
- Klein ME, et al: Previsione del punteggio di recidiva Oncotype DX: uso di equazioni generate dalla patologia e derivate dall’analisi di regressione lineare. Mod Pathol 2013; 26: 658-664.
- Denkert C, et al.: [Patologia molecolare del cancro al seno: importanza del profilo di espressione genica]. Patologo 2015; 36: 145-153.
InFo ONCOLOGIA & EMATOLOGIA 2016; 4(1): 10-14