Questo articolo offre una panoramica delle diverse forme di dermatosi autoimmuni bollose e una sintesi delle raccomandazioni terapeutiche e delle opzioni di trattamento attualmente valide. Gli immunosoppressori classici influenzano i processi metabolici delle cellule T e B a livello cellulare. Inoltre, negli ultimi anni, sono state create diverse terapie mirate.
Le malattie autoimmuni vescicanti sono di solito malattie gravi della pelle – e spesso anche delle membrane mucose. Sono caratterizzate dalla comparsa di autoanticorpi IgG o IgA contro le proteine strutturali della pelle. Queste proteine strutturali sono di grande importanza per l’adesione cellulare dei cheratinociti (malattie da pemfigo) o per l’adesione dell’epidermide al derma (malattie da pemfigoide, epidermolisi bollosa acquisita, dermatite erpetiforme).
Pertanto, le vesciche si verificano a livello intraepidermico nelle malattie da pemfigo e a livello subepidermico nelle altre malattie autoimmuni bollose. La grande eterogeneità clinica e i diversi decorsi rappresentano anche una sfida terapeutica per i dermatologi. I glucocorticosteroidi locali e orali sono il trattamento di prima linea, tranne che per la dermatite erpetiforme. In caso di terapia sistemica con corticosteroidi, sono necessarie misure terapeutiche additive (panoramica 1) . Per risparmiare i corticosteroidi, questi vengono combinati con altri immunosoppressori nel corso del trattamento.
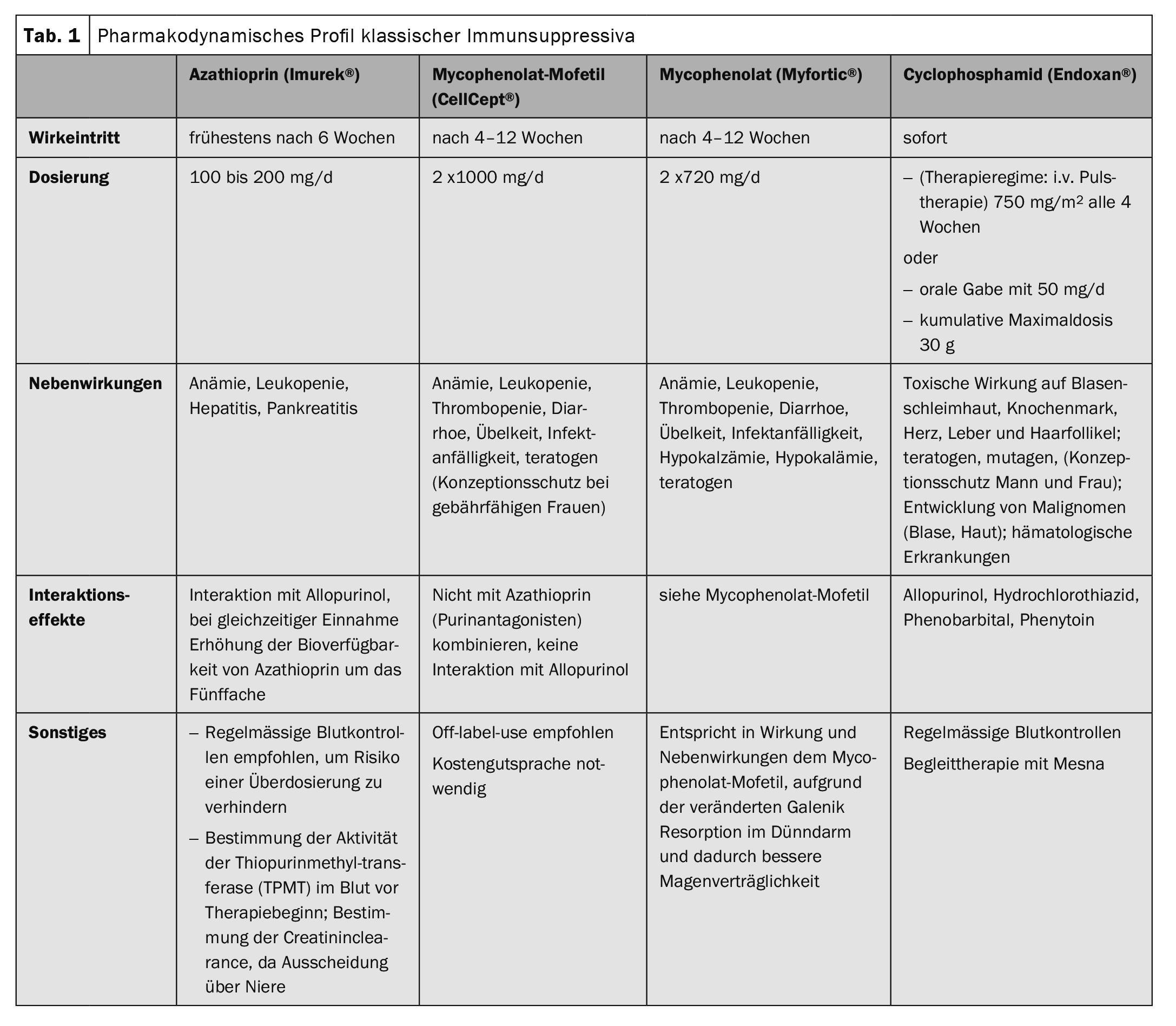
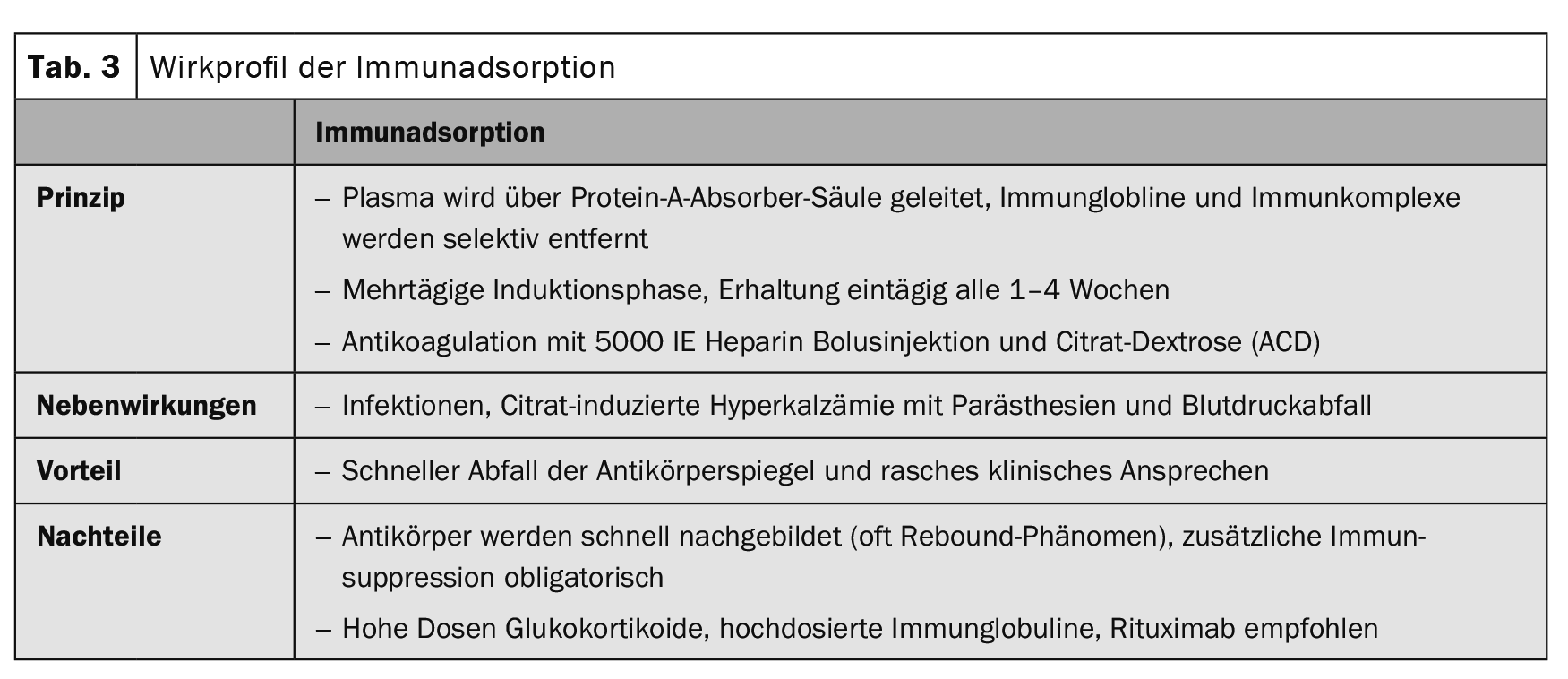
Negli ultimi anni, i farmaci immunosoppressivi classici sono stati (Tab. 1), che influenzano i processi metabolici delle cellule T e B a livello cellulare, sono integrati da terapie mirate. (Fig. 1). Essenzialmente, si tratta di rituximab (Tab. 2), metodo di immunoadsorbimento (Tab. 3) e l’uso di immunoglobuline ad alto dosaggio. (Tab. 4). Il rituximab è un anticorpo chimerico anti-CD20 per la deplezione delle cellule B periferiche che formano autoanticorpi. (Tab. 2).
Nelle procedure di immunoadsorbimento, gli autoanticorpi e gli immunocomplessi vengono rimossi selettivamente dal plasma attraverso assorbitori ad alta affinità (Tab. 3).
Le immunoglobuline ad alto dosaggio per via endovenosa hanno lo scopo di neutralizzare i mediatori infiammatori e gli autoanticorpi (Tabella 4).
Durante la terapia con immunosoppressori, c’è un rischio maggiore di riattivazione di infezioni latenti, per cui le infezioni come l’HIV, l’epatite B, la tubercolosi e le infezioni batteriche croniche devono essere escluse prima di iniziare la terapia. Durante la terapia possono verificarsi infezioni opportunistiche da candida e infezioni da herpes (herpes simplex, varicella zoster). Durante la terapia a lungo termine con immunosoppressori è stato descritto un aumento del rischio di disturbi linfoproliferativi e di tumori cutanei. A causa dell’aumento della fotocarcinogenesi, è necessaria una protezione dai raggi UV e controlli regolari della pelle. Prima di iniziare la terapia immunosoppressiva, verificare lo stato di vaccinazione del paziente. Le vaccinazioni con vaccini vivi durante la terapia immunosoppressiva sono controindicate, e le vaccinazioni con vaccini attenuati possono avere un successo ridotto. Nei pazienti di età superiore ai 50 anni, è indicata la vaccinazione contro l’herpes zoster con il vaccino della subunità-tot [1].
Malattie del pemfigo
Il pemfigo vulgaris, il pemfigo foliaceo e il pemfigo paraneoplastico sono racchiusi in questo termine ombrello. I glucocorticosteroidi sistemici sono al centro della terapia. A seconda della gravità della malattia, le dosi iniziali corrispondono a 1-2 mg/kg di prednisolone equivalente al giorno. La terapia di consolidamento dipende dall’attività della malattia. Se non compaiono nuove vesciche nell’arco di 8 giorni, la dose di steroidi viene ridotta del 25% ogni 2-4 settimane. A partire da 30 mg di prednisolone equivalente al giorno, l’ulteriore riduzione è ancora più lenta. L’obiettivo è raggiungere la soglia di Cushing (7,5 mg di prednisolone). Per risparmiare i glucocorticosteroidi, questi vengono combinati con altri immunosoppressori (Tab. 1) . La dose del farmaco immunosoppressore rimane invariata – a condizione che non ci siano effetti collaterali – per tutta la durata della terapia.
L’immunosoppressore adiuvante più comune è l’azatioprina , con un dosaggio di 100-150 mg/d. In caso di ridotta attività enzimatica della tiopurina metiltransferasi o di somministrazione contemporanea di allopurinolo, la dose deve essere ridotta. I campioni di sangue devono essere prelevati prima e durante la terapia (Tabella 1).
Se si verificano effetti collaterali con l’azatioprina, si utilizza il micofenolato mofetile o, in caso di effetti collaterali gastrointestinali, l’acido micofenolico . Entrambi i farmaci hanno un effetto di risparmio di steroidi e portano a una remissione più rapida (Tab. 1) .
Nei casi molto refrattari, la ciclofosfamide può essere combinata con i corticosteroidi. La ciclofosfamide è una sostanza alchilante, cioè che incrocia il DNA, con effetti irreversibili sulla riserva ovarica e sulla spermatogenesi ed è quindi obsoleta nei pazienti più giovani. Inoltre, possono verificarsi una serie di effetti collaterali tossici e lo sviluppo di tumori maligni (Tab. 1). L’approvazione nell’UE è stata quindi limitata alle malattie autoimmuni potenzialmente letali nel 2012.
Studi clinici prospettici, multicentrici e randomizzati con e senza corticosteroidi hanno dimostrato l’efficacia del rituximab (Tabella 2) con remissioni fino all’80% dopo 24 mesi. I titoli autoanticorpali (anti-desmogleina I e III) sono diminuiti lentamente nelle prime settimane dopo l’infusione e hanno raggiunto i valori più bassi dopo circa 180 giorni. Una risposta clinica è stata osservata dopo 2-3 mesi. Sulla base degli studi, il rituximab è stato approvato per il trattamento iniziale del pemfigo grave e moderato negli Stati Uniti nel giugno 2018 [2,3]. L’approvazione dell’UE per il pemfigo vulgaris è stata concessa a metà del 2019.
I primi risultati degli studi sull’immunoadsorbimento (IA) (Tab. 3) nel pemfigo sono stati pubblicati nel 2007 [4]. Nel frattempo, sono stati pubblicati più di 100 pazienti con diversi protocolli terapeutici. A differenza del rituximab, tutte le serie di casi hanno mostrato una rapida diminuzione degli autoanticorpi e un rapido miglioramento clinico, ma anche un alto tasso di ricaduta dopo poco tempo. La combinazione di IA con rituximab ha portato a remissioni rapide e durature [5].
Serie di casi e relazioni di casi individuali hanno riportato una buona risposta dopo diverse serie di terapie con immunoglobuline endovenose ad alto dosaggio (IVIG) (Tabella 4) in combinazione con glucocorticosteroidi nel pemfigo volgare e nel pemfigo paraneoplastico come terapia di seconda o terza linea dopo il fallimento della terapia immunosoppressiva combinata. Solo dopo diversi mesi di terapia c’è stata una risposta.
Pemfigoide bolloso
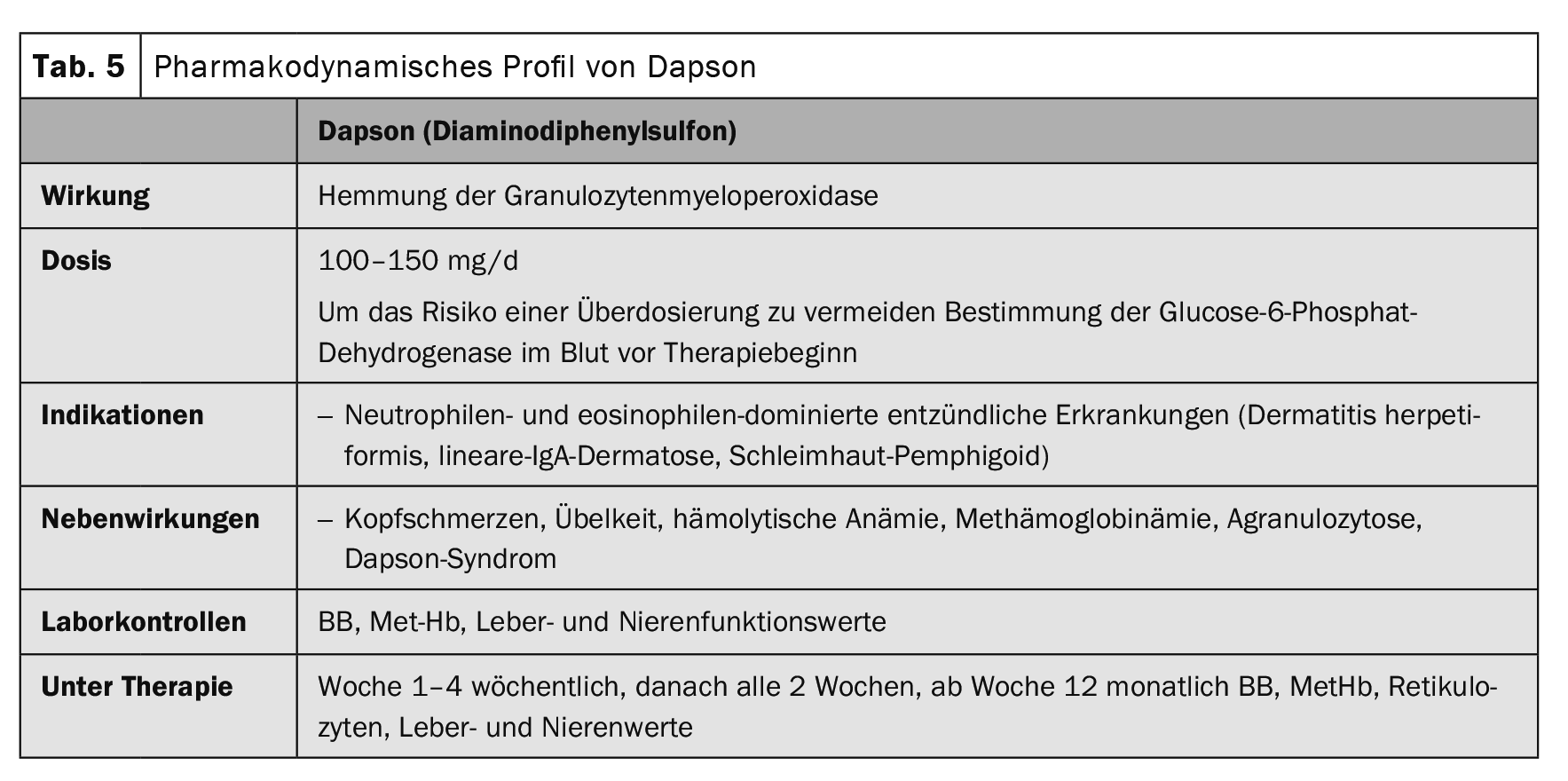
La terapia del pemfigoide bolloso deve essere adattata all’attività della malattia e alle comorbidità di ogni singolo paziente. In genere, vengono utilizzati metodi di terapia più blandi rispetto alle malattie da pemfigo. Nel pemfigoide bolloso localizzato e moderato, spesso sono sufficienti trattamenti disinfettanti e antinfiammatori topici con clobetasolo propionato due volte al giorno. Tuttavia, il trattamento topico ad ampio raggio due volte al giorno è spesso poco pratico nei pazienti anziani. Di solito è necessario un trattamento sistemico. La terapia sistemica con un equivalente iniziale di 0,5 mg/kg/d di prednisolone in combinazione con immunosoppressori adiuvanti come l’azatioprina o il micofenolato mofetile, per risparmiare i glucocorticoidi, è la terapia di prima scelta in aggiunta al trattamento topico (Tabella 1) . Altre terapie adiuvanti includono il metotrexato (15 mg/settimana), il dapsone (100 mg/d, Scheda. 5) e tetraciclina (200 mg/d) sono stati descritti. In una serie di casi con 20 pazienti, l’immunoadsorbimento (Tabella 3) è stato in grado di mostrare una rapida diminuzione dei livelli di autoanticorpi del pemfigoide bolloso nel siero e un effetto terapeutico associato [6].
Pemfigoide delle mucose
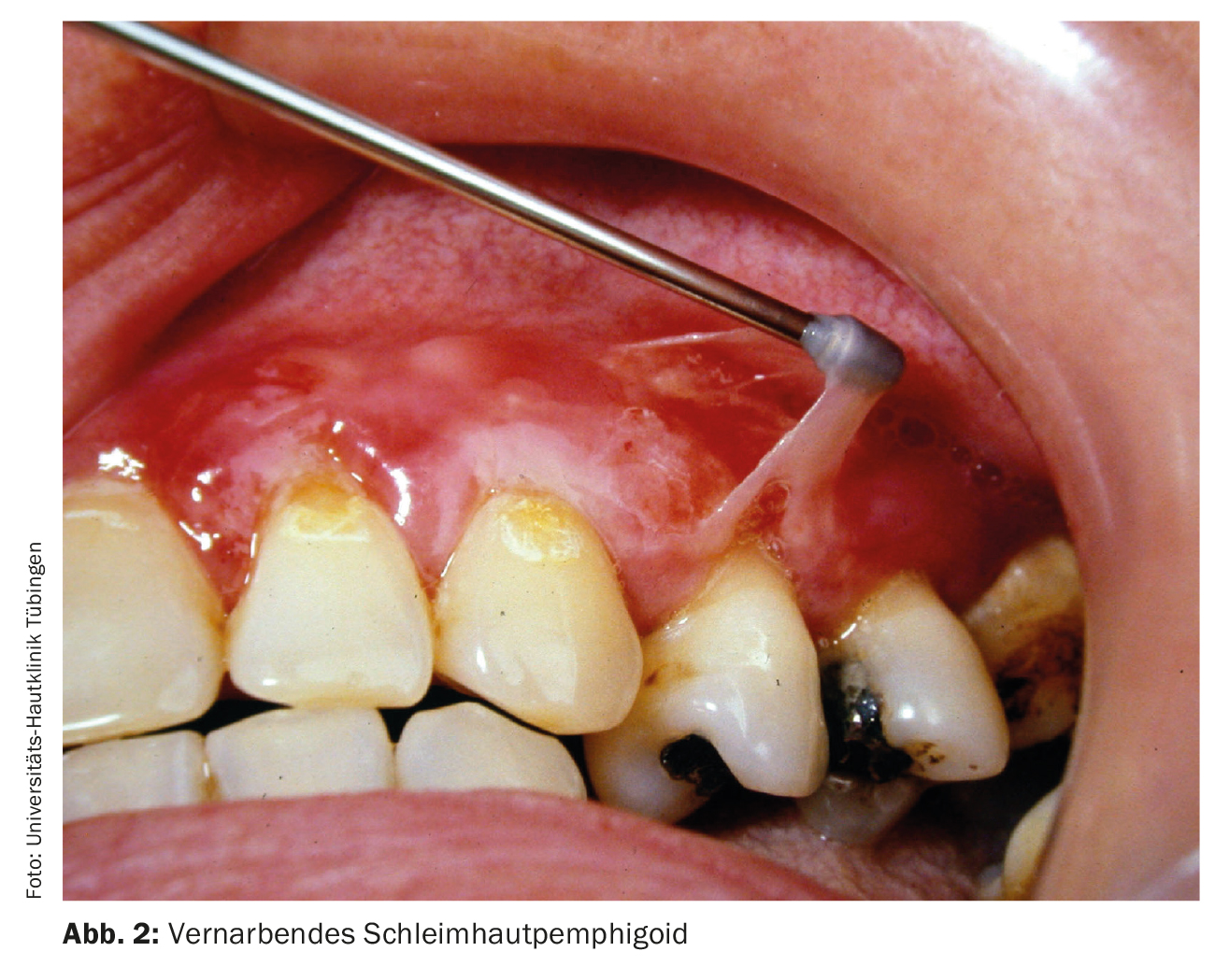
Questa dermatosi autoimmune è chiamata anche pemfigoide cicatriziale. La malattia è caratterizzata da una grande eterogeneità clinica con e senza cicatrici. Possono essere colpite tutte le membrane mucose con epitelio squamoso (mucosa orale, congiuntiva, rinofaringe, esofago, vulva e retto). La terapia dipende dalla manifestazione clinica; soprattutto, bisogna prevenire la cicatrizzazione (Fig. 2) . Oltre ai glucocorticoidi ad alte dosi in combinazione con immunosoppressori adiuvanti, la terapia con ciclofosfamide (Tab. 1), IVIG (Tab. 4 ) o rituximab (Tab. 2) può essere raccomandata per i pazienti refrattari [7].
Dermatosi lineare IgA
Gli agenti di prima linea per le dermatosi lineari da IgA sono i glucocorticosteroidi e il dapsone (Tabella 5) . I glucocorticosteroidi sono molto meno efficaci in questa malattia rispetto al pemfigo o al pemfigoide bolloso. L’immunoadsorbimento (Tabella 3), l’IVIG (Tabella 4) e il rituximab (Tabella 2) [8,9] sono stati descritti come efficaci nelle relazioni sui casi.
Epidermolisi bollosa acquisita
L’epidermolisi bollosa acquisita mostra una marcata resistenza alla terapia in molti casi. La forma meccanobollosa, in particolare, è spesso refrattaria al trattamento con glucocorticosteroidi in combinazione con immunosoppressori adiuvanti come l’azatioprina o il micofenolato mofetile. (Tab. 1). In una serie di casi con 3 pazienti e in relazioni di casi individuali è stato dimostrato che Il rituximab (tab. 2) come monoterapia porta a remissioni di lunga durata in più della metà dei pazienti e in combinazione con IVIG (tab. 4 ) o immunoadsorbimento (tab. 3 ) in più del 75% dei pazienti. [10].
Dermatite erpetiforme Duhring
Oltre alla malattia cutanea, è sempre presente un’enteropatia sensibile al glutine (celiachia), anche se più dell’80% dei pazienti non mostra sintomi gastrointestinali, ma di solito presenta un’atrofia villosa subclinica o un’infiammazione nel digiuno. La terapia si basa su una dieta priva di glutine per tutta la vita. Una dieta priva di glutine previene anche l’insorgenza di linfomi non-Hodgkin e probabilmente anche di carcinomi nel tratto digestivo. L’effetto della dieta priva di glutine sulla pelle si manifesta solo dopo diversi mesi, per cui inizialmente si deve sempre utilizzare il dapsone (tabella 5) . L’enteropatia sottostante non è influenzata da dapsone. In caso di intolleranza al dapsone, può essere somministrata la sulfasalazina o la colchicina.
Sommario
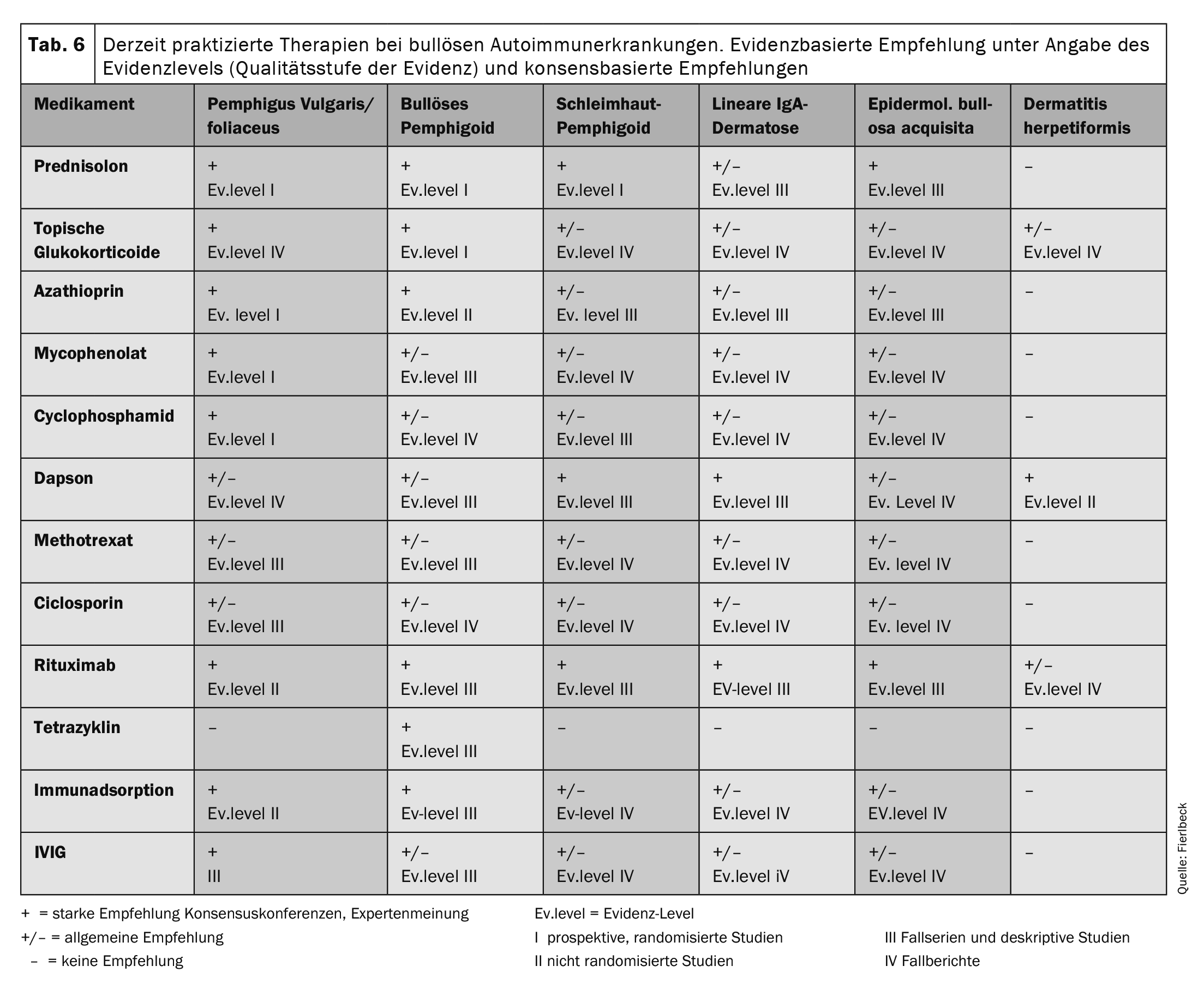
La Tabella 6 offre una panoramica delle terapie attualmente praticate . Le raccomandazioni terapeutiche si basano su studi clinici (livello di evidenza) e raccomandazioni generali (conferenze di consenso, opinioni di esperti).
Messaggi da portare a casa
- I glucocorticosteroidi locali e orali in combinazione con l’azatioprina sono agenti di prima linea, tranne che per la dermatite erpetiforme.
- Nel pemfigoide bolloso, si può fare una prova con glucocorticosteroidi topici potenti. Tuttavia, di solito è necessaria una terapia orale con basse dosi di glucorticosteroidi in combinazione con l’azatioprina.
- Nelle dermatosi bollose autoimmuni gravi e refrattarie, si raccomanda di Rituximab indicato. A causa dell’effetto ritardato del rituximab, esistono inizialmente combinare i glucocorticosteroidi.
- L’immunoadsorbimento porta a un miglioramento clinico nel giro di pochi giorni; è necessaria un’ulteriore immunosoppressione a causa del rapido rimbalzo degli autoanticorpi e del deterioramento clinico.
- Nella dermatite erpetiforme, è necessaria una dieta senza glutine per tutta la vita, anche senza la presenza di un’enteropatia manifesta. Il dapsone è il farmaco di prima scelta. L’effetto della dieta senza glutine si manifesta solo dopo mesi, mentre il dapsone agisce in pochi giorni.
Letteratura:
- STIKO: Comunicazione della Commissione permanente sulle vaccinazioni (STIKO) presso l’RKI. Razionale scientifico per raccomandare la vaccinazione con il vaccino totale a subunità dell’herpes zoster. Istituto Robert Koch (RKI), Bollettino epidemiologico 50, 13.12.2018. www.rki.de
- Jolly P, et al: Rituximab di prima linea combinato con il solo prednisolone a breve termine per il trattamento del pemfigo. Lancet 2017; 389(10083): 2031-2040.
dx.doi.org/10.1016/SO140-6736(17)30070-3 - Murrell DF, et al: Diagnosi e gestione del pemfigo: raccomandazioni di un gruppo internazionale di esperti. J Am Acad Dermatol 2018 Feb 10. pii: S0190-9622(18)30207-X. doi: 10.1016/j.jaad.2018.02.021. [Epub ahead of print]
- Zillikens D, et al: Raccomandazione per l’uso dell’immunoaferesi nel trattamento della malattia bollosa autoimmune. JDDG 2007; 5(10): 366-373.
- Behzad M, et al: Il trattamento combinato con immunoadsorbimento e rituximab porta a una remissione clinica rapida e prolungata nel pemfigo vulgaris. Br J Dermatol 2012; 166(4): 844-852.
- Hübner F, et al: Trattamento adiuvante del pemfigoide bolloso grave/refrattario con l’immunoadsorbimento della proteina A. JDDG 2008; 16(9): 1109-1119.
- Le-Roux-Viller C, et al: Rituximab per i pazienti con pemfigoide mucoso refrattario. Arch Dermatol 2011; 147(7): 843-849.
- Enk A, et al: Uso di immunoglobuline ad alto dosaggio in dermatologia. JDDG 2009; 7(9): 806-812.
- Pinard C, et al: Dermatosi bollosa lineare IgA trattata con rituximab. JAAD Case Rep. 2019; 5(2): 124-126. doi: 10.1016/j.jdcr.2018.11.004
- Bevans SL, Sami N: L’uso di Rituximab nel trattamento dell’epidermolisi bollosa acquisita: tre nuovi casi e una revisione della letteratura. Dermatol Ther 2018; 31(6): e12726. doi: 10.1111/dth12726 [Epub 2018 Oct 3]
DERMATOLOGIE PRAXIS 2023 ; 30(1) : 14–19