La sclerosi multipla è la malattia neurologica più comune nei giovani adulti. Anche in giovane età, può portare a un’invalidità permanente, anche se l’attività della malattia all’inizio sembra essere rilevante per il decorso successivo della malattia. L’inizio precoce di una terapia efficace è quindi importante. Grazie agli studi clinici completati di recente e agli attuali risultati promettenti della ricerca, si può prevedere un aumento delle opzioni terapeutiche nei prossimi mesi e anni.
La sclerosi multipla (SM) è la più comune malattia autoimmune del sistema nervoso centrale (SNC), la cui base fisiopatologica non è ancora stata chiarita nel dettaglio. In base ai nuovi criteri secondo McDonald 2010, la diagnosi di SM viene spesso fatta dopo il primo episodio clinico [1]. Nella maggior parte dei casi c’è un decorso recidivante (“sclerosi multipla recidivante remittente”, SMRR).
Nel corso della malattia, molti pazienti sperimentano una progressione secondaria-cronica dei sintomi indipendente dalle ricadute (“SM secondariamente progressiva”, SPMS); dopo dieci anni, ciò avviene in circa il 30-40% dei pazienti [2]. La SM primariamente progressiva (SMPP) è presente nel 10-20% dei pazienti e questo decorso può anche includere ricadute sovrapposte [3].
La fase iniziale della SMRR spesso corrisponde formalmente a una sindrome clinicamente isolata (CIS). Nei pazienti CIS, i criteri McDonald 2010 per la diagnosi di SMRR non sono soddisfatti, ma la presenza di SM deve essere spesso considerata probabile [4].
I processi nella fase iniziale delle malattie sembrano avere un’influenza significativa sull’ulteriore decorso della malattia, per cui è importante un inizio precoce della terapia. La transizione formale della CIS in SM clinicamente confermata può essere ritardata e l’ulteriore decorso influenzato positivamente dall’uso precoce di una terapia di base [5, 6].
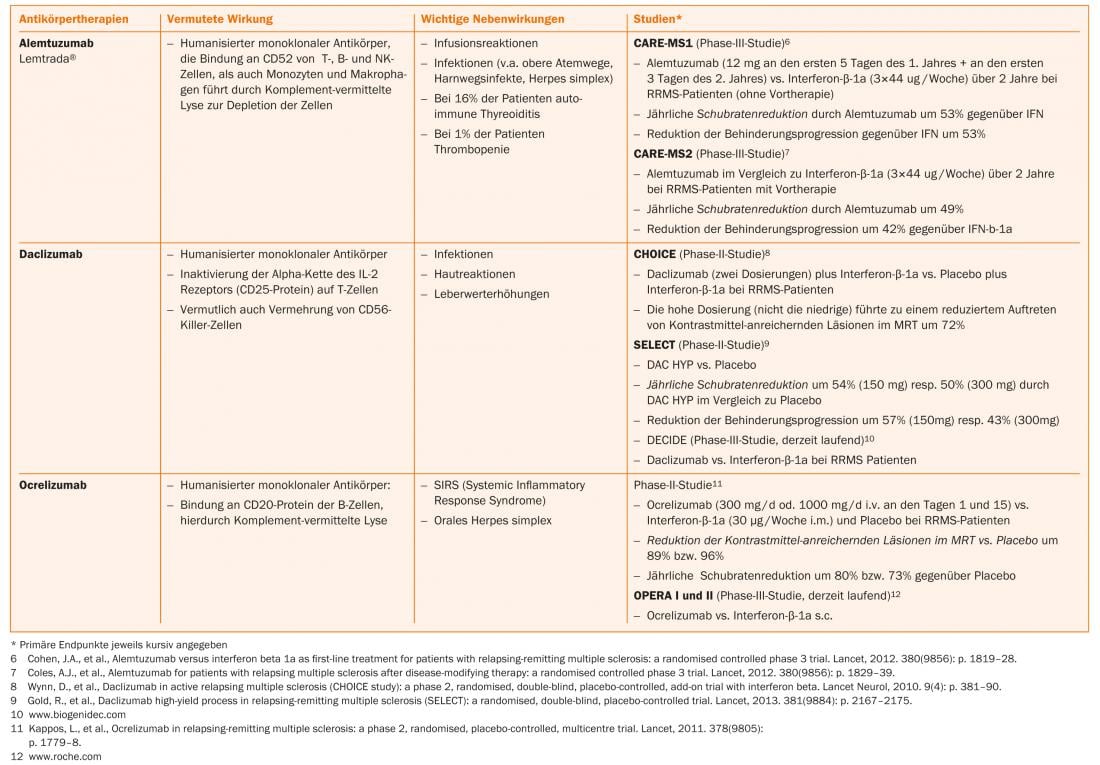
Più recentemente, sono stati fatti progressi nel trattamento della CIS e della SMRR. Oltre alle sostanze orali (come acido fumarico, laquinimod, teriflunomide), anche le terapie con anticorpi (come alemtuzumab, daclizumab, ocrelizumab) sono in fase di studio II o III o alcuni studi corrispondenti sono già stati completati.
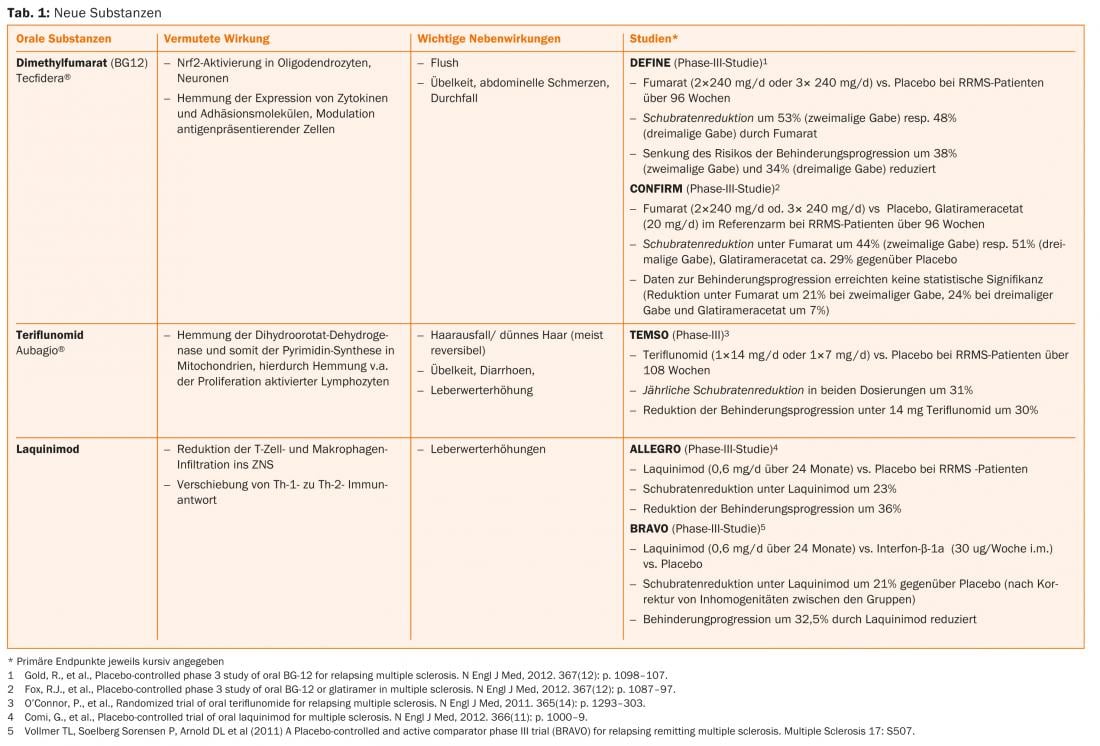
L’acido fumarico, la teriflunomide e l’alemtuzumab sono già approvati in alcuni Paesi, per cui ci si può aspettare un ampliamento delle opzioni terapeutiche anche in Svizzera nel prossimo futuro. (Tab. 1 e Fig. 1).
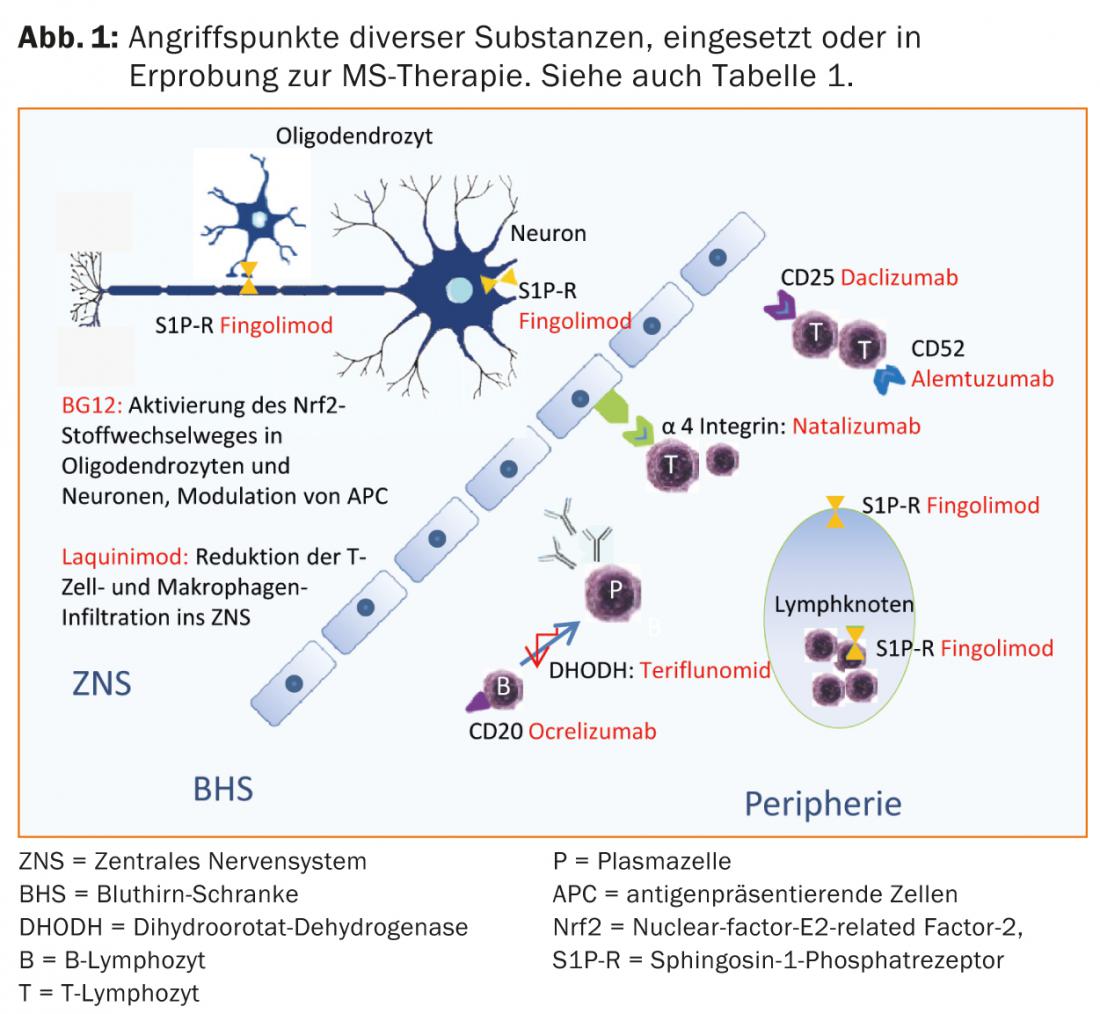
Le attuali opzioni terapeutiche
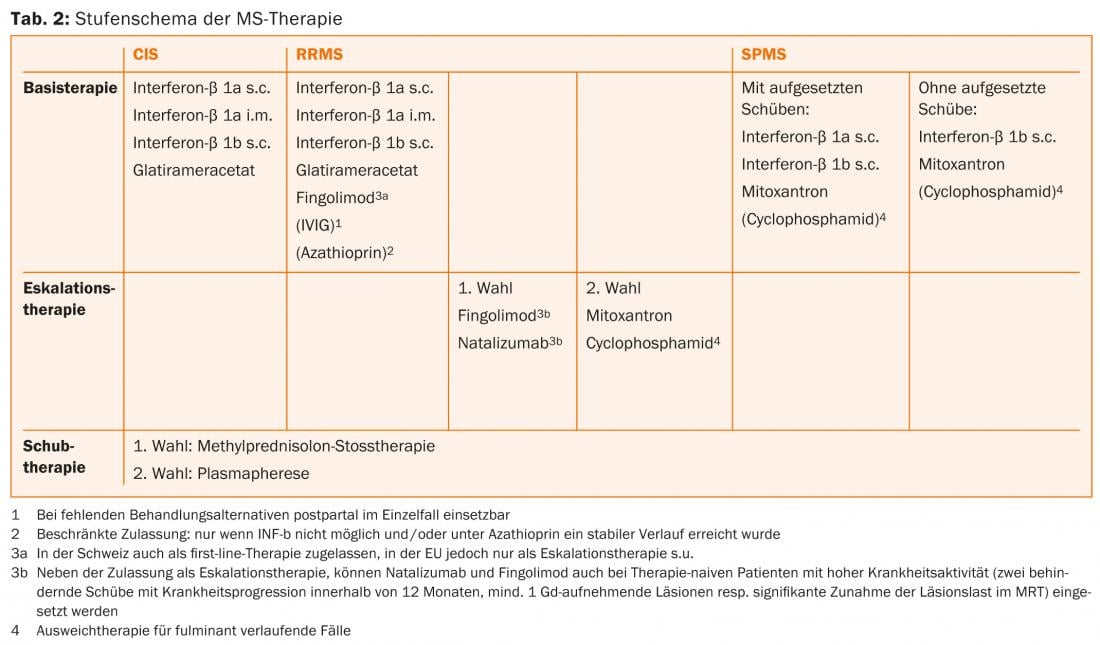
Per il trattamento dei pazienti affetti da CIS e SMRR, nell’UE e in Svizzera sono disponibili i beta-interferoni (interferone-beta 1b s.c. [Betaferon®]). [Betaferon®], interferone-beta 1a s.c. e i.m. [Rebif® e Avonex®] e Glatira. [Rebif® e Avonex®] e glatiramer acetato s.c. [Copaxone®] sono stati approvati [7, 8]. Per queste sostanze, che di solito vengono iniettate dal paziente stesso, esistono molti anni di esperienza e sono caratterizzate in particolare da un profilo di sicurezza favorevole [9]. Nel 2011, fingolimod è stato approvato anche in Svizzera come terapia di prima linea per il trattamento della SMRR [10]. Gli esami di risonanza magnetica (RM) devono essere eseguiti inizialmente e regolarmente durante il corso della terapia per determinare la situazione iniziale e per il successivo monitoraggio della terapia.
Gli interferoni (IFN) utilizzati sono prodotti in modo ricombinante. Gli IFN endogeni sono parte integrante del sistema immunitario e sono importanti per la risposta immunitaria alle infezioni virali. L’esatto meccanismo d’azione dei preparati di IFN-β nel trattamento della CIS/RRMS non è ancora del tutto chiaro. Spesso si verificano effetti collaterali di tipo influenzale, soprattutto nei primi mesi di terapia, che possono essere ridotti con l’assunzione di un farmaco antinfiammatorio non steroideo o di paracetamolo [11]. Nei siti di iniezione possono verificarsi effetti collaterali locali come dolore, arrossamento della pelle, lipoatrofia e indurimento [12, 13]. In alternativa ai beta-interferoni, si può utilizzare il copolimero glatiramer acetato, che ha un’efficacia paragonabile. Il glatiramer acetato è una miscela eterogenea di polipeptidi sintetici composti da quattro aminoacidi, il cui meccanismo d’azione non è ancora del tutto chiaro [14]. Gli effetti collaterali di tipo influenzale non sono rilevanti con questo farmaco, ma possono verificarsi reazioni post-iniezione con sintomi di arrossamento e indurimento locale o lipoatrofia nei siti di iniezione [15].
In Svizzera, fingolimod (compresse) è approvato anche per la terapia di base di prima linea della SMRR. Fingolimod è la prima terapia modificante la malattia disponibile per via orale, generalmente ben tollerata, che è risultata superiore al comparatore interferone-beta 1a i.m. in uno degli studi pivotal [17]. Fingolimod si lega come antagonista non selettivo ad alta affinità ai recettori della sfingosina-1-fosfato (S1P-R) sui linfociti, impedendo così la loro emigrazione dagli organi linfoidi secondari. La ridistribuzione dei linfociti provoca linfopenia e la metabolizzazione nel fegato può portare a un aumento dei valori epatici. A causa dell’espressione dei recettori S1P nell’area del sistema di conduzione cardiaca, possono verificarsi effetti collaterali come bradicardia o disturbi della conduzione atrioventricolare, soprattutto durante la prima assunzione. Per questo motivo, è necessario controllare la pressione sanguigna, il polso e l’ECG alla prima somministrazione e dopo le interruzioni della terapia. L’edema maculare può essere una complicanza rara [16]. A causa degli effetti sul sistema immunitario, i pazienti il cui tipo di pelle predispone a tumori maligni dovrebbero essere esaminati dermatologicamente con regolarità [17, 18]. Inoltre, sono favorite soprattutto le infezioni virali. Nei pazienti che non hanno avuto la varicella, i titoli anticorpali del virus Varicella zoster devono essere determinati prima di iniziare la terapia. I pazienti sieronegativi devono essere vaccinati.
Nuove sostanze come alemtuzumab (infusione, solo per i pazienti con attività di malattia in corso), dimetil fumarato (compressa) e teriflunomide (compressa) sono già state approvate per la terapia della SMRR in alcuni Paesi e sono state presentate per l’approvazione in Svizzera.
Terapia di escalation
L’escalation terapeutica dalla terapia di prima linea a fingolimod (di per sé di prima linea in Svizzera, non nell’UE) [16, 19] o natalizumab [20] può essere presa in considerazione se si è verificata ≥1 ricaduta con la terapia di base nell’anno precedente e se ci sono ≥9 lesioni T2-iperintense o ≥1 lesione acuta, cioè assorbente il contrasto, alla risonanza magnetica. Gli IFN sono citati come terapia di base corrispondente nelle indicazioni. Tuttavia, la prassi attuale è quella di valutare ugualmente l’escalation nei pazienti trattati con glatiramer acetato o, nel caso di escalation a natalizumab, con fingolimod. Il trattamento primario con natalizumab o (nell’UE, non limitato in Svizzera) fingolimod è indicato solo per i pazienti che hanno già avuto ≥2 ricadute con progressione della disabilità nell’ultimo anno e che presentano ≥1 lesione che aumenta il contrasto o un aumento “significativo” del carico delle lesioni T2 rilevabile alla risonanza magnetica cerebrale.
Natalizumab è un anticorpo monoclonale umanizzato contro la molecola di adesione cellulare α4-integrina, di cui i linfociti hanno bisogno per entrare nel sistema nervoso centrale. Nello studio pivotal, natalizumab ha ridotto il tasso di ricaduta del 68% rispetto al placebo e ha avuto anche un buon effetto sulla progressione della disabilità e sui segni di attività della malattia sulla risonanza magnetica [20]. Il natalizumab viene somministrato per infusione ogni 28 giorni e di solito è ben tollerato. L’uso di questo farmaco molto efficace è limitato dal rischio di leucoencefalopatia multifocale progressiva (PML). Questa infezione opportunistica causata dal virus JC spesso porta a gravi disabilità; è possibile un esito letale. Non esiste un trattamento specifico per la PML. Nella PML, il natalizumab viene quindi interrotto e lavato con la plasmaferesi per ripristinare l’immunocompetenza il più rapidamente possibile. Poco più della metà dei pazienti con SM e la corrispondente popolazione sana sono portatori del virus JC. Mentre i pazienti JC-seronegativi hanno un basso rischio di PML (circa 1:10.000) [21], il rischio nei pazienti sieropositivi può aumentare fino a circa 1:89 per il terzo e quarto anno, se in passato è stata somministrata una terapia immunosoppressiva. A seconda del rischio individuale, è quindi necessaria un’attenta consulenza ai pazienti sui benefici e sui rischi [22]. Quando si passa da fingolimod a natalizumab, si deve osservare un periodo di washout di circa due mesi, almeno in attesa che la conta dei linfociti si normalizzi [23]. Dopo un attento esame, mitoxantrone, ciclofosfamide o azatioprina [23] possono essere utilizzati come farmaci di riserva e agenti di seconda linea nella terapia di escalation (tab. 2). Possono essere prese in considerazione altre terapie off-label.
Infine, va ricordato che le combinazioni dei farmaci per la SM menzionati non sono approvate.
Desiderio di figli, gravidanza, allattamento
La SM colpisce spesso le giovani donne. La questione del trattamento durante il parto, la gravidanza e l’allattamento è quindi rilevante. L’uso degli agenti chemioterapici teratogeni o degli immunosoppressori azatioprina, ciclofosfamide e mitoxantrone è controindicato. Anche con fingolimod, se possibile, si deve osservare un periodo di washout prima di interrompere la contraccezione. Il glatiramer acetato è stato valutato come il migliore dall’Agenzia statunitense per gli alimenti e i medicinali (FDA) in termini di rischio di esposizione durante la gravidanza, poiché questo farmaco non è risultato teratogeno negli studi sugli animali e anche i dati precedenti sugli esseri umani sono favorevoli [24]. Anche per gli interferoni e il natalizumab, finora non è stata osservata alcuna teratogenicità negli esseri umani.
Sebbene questi dati non provengano da studi controllati, si dovrebbe prendere in considerazione la possibilità di interrompere il trattamento con uno di questi farmaci solo quando si verifica una gravidanza, tenendo conto della rispettiva etichetta. Durante la gravidanza, quando l’attività di ricaduta è solitamente bassa, il trattamento viene somministrato solo in rari casi eccezionali. Inoltre, il trattamento non viene solitamente somministrato durante l’allattamento, soprattutto perché molte pazienti con SM non allattano al seno per poter ricominciare il trattamento dopo il parto, dopo il quale c’è spesso un alto livello di attività della malattia.
Utilizzo di terapie di base in forme progressive
Attualmente non esistono opzioni di trattamento efficaci con un effetto chiaro per la forma progressiva del decorso; piuttosto, oltre a una terapia individuale, multimodale e sintomatica, sono in primo piano anche misure fisioterapiche e riabilitative. Nel caso della SMSP, è possibile utilizzare l’IFN-β-1b e, in caso di recidive, anche l’IFN-β-1a s.c. [25].
Se il decorso è particolarmente aggressivo, la somministrazione di mitoxantrone deve essere discussa [26]. È necessario effettuare un’attenta valutazione del rapporto rischio/beneficio in anticipo, soprattutto a causa dell’aumento del rischio di leucemia [27] e di cardiomiopatia, nonché dell’effetto tossico sulla funzione gonadica. La durata della terapia è limitata dalla dose cumulativa totale che può essere applicata (in Svizzera massimo 100 mg/m2 di superficie corporea). Questo valore può essere superato, se necessario, sotto un attento controllo della funzione cardiaca.
Conclusione
La terapia precoce della CIS/RMS è importante per il decorso della malattia. A questo scopo è disponibile un numero crescente di farmaci, che si differenziano in termini di efficacia, sicurezza, profilo di effetti collaterali e comfort terapeutico. La crescente scelta di terapie per la SM offre la possibilità di una terapia più personalizzata, adattata al profilo specifico del paziente.
Helen Könnecke
PD Michael Linnebank, MD
Letteratura:
- Polman CH, et al: Ann Neurol 2011; 69(2): 292-302.
- Weinshenker BG, et al: Brain 1989; 112(Pt1): 133-146.
- Weinshenker BG: Semin Neurol 1998; 18(3): 301-307.
- Miller DH, et al: Mult Scler 2008; 14(9): 1157-1174.
- Weinshenker BG, et al: Brain 1989; 112(Pt 6): 1419-1428.
- Hirst C, et al: J Neurol 2008; 255(2): 280-287.
- Buttmann M, Rieckmann P: Expert Rev Neurother 2007; 7(3): 227-239.
- Comi G, et al: Ann Neurol 2011; 69(1): 75-82.
- Reder AT, et al: Neurology 2010; 74(23): 1877-1885.
- www.swissmedic.ch.
- Hartung HP, et al: Nervenarzt 2013; 84(6): 679-704.
- Nikfar S, Rahimi R, Abdollahi M: Clin Ther 2010; 32(11): 1871-1888.
- Plosker GL: Farmaci CNS 2011; 25(1): 67-88.
- O’Connor P, et al: Lancet Neurol 2009; 8(10): 889-897.
- Ford C, et al: Mult Scler 2010; 16(3): 342-350.
- Cohen JA, et al: NEJM 2010; 362(5): 402-415.
- Comi G, et al: Mult Scler 2010; 16(2): 197-207.
- Kappos L, et al: NEJM 2006; 355(11): 1124-1140.
- Kappos L, et al: NEJM 2010; 362(5): 387-401.
- Polman CH, et al: NEJM 2006; 354(9): 899-910.
- Bloomgren G, et al: NEJM 2012; 366(20): 1870-1880.
- www.biogenidec.ch.
- Linea guida DGN sulla diagnosi e la terapia della SM. Diener HC, Weimar C (eds): Linee guida della Società Tedesca di Neurologia Thieme Verlag: Stuttgart 2012, 430-475.
- Salminen HJ, Leggett H, Boggild M: J Neurol 2010; 257(12): 2020-2023.
- Kappos L, et al: Neurology 2004; 63(10): 1779-1787.
- Hartung HP, et al: Lancet 2002; 360(9350): 2018-2025.
- Martinelli V, et al: Neurology 2011; 77(21): 1887-1895.
InFo Neurologia & Psichiatria 2013; 11(6): 13-20











