Con i più moderni test genetici, oggi si possono fare diagnosi che altrimenti non sarebbero possibili. Il chiarimento genetico è importante anche per la consulenza familiare e il trattamento farmacologico. Ma attenzione: non tutti i test genetici sono uguali.
Il costante progresso della genetica umana, paragonabile allo sviluppo esponenziale della tecnologia informatica, sta portando all’identificazione della causa di un numero sempre maggiore di malattie genetiche. Oggi la diagnosi può essere sempre più spesso effettuata, confermata o esclusa mediante test genetici del materiale genetico (DNA). Questi test genetici a scopo medico (diagnostica genetica), su cui si concentra questo articolo, non devono essere confusi con i test genetici (di stile di vita) a scopo non medico che si trovano su Internet o in farmacia (Fig. 1).
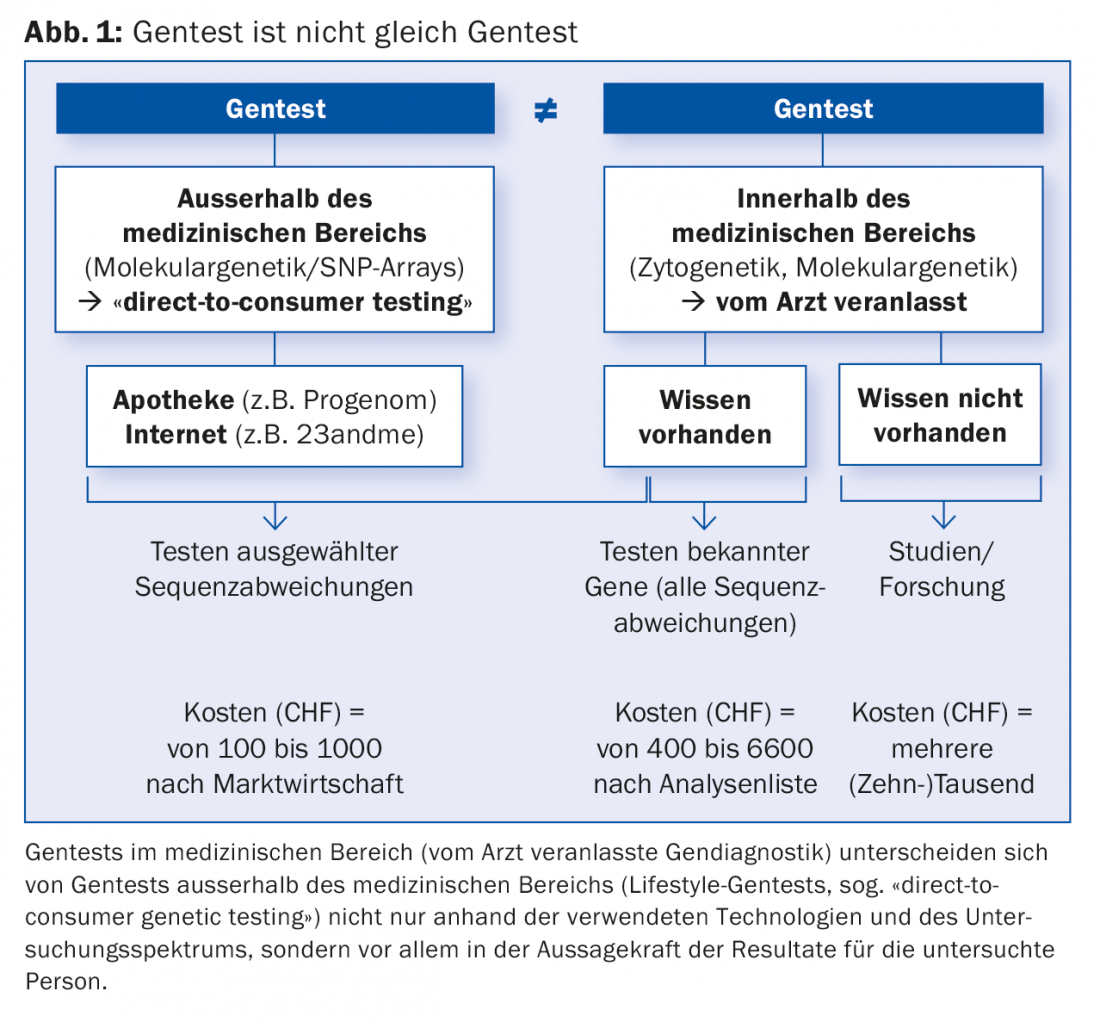
La crescente importanza della diagnostica genetica
Le malattie monogeniche sono causate dalla mutazione di un singolo gene, mentre nelle comuni malattie multifattoriali le influenze (genetiche) sono solitamente molteplici e forti solo nella somma. La diagnostica genetica può essere effettuata prima o dopo la nascita, esaminando i cromosomi (citogenetica) e/o i geni (genetica molecolare) e viene utilizzata principalmente nelle situazioni in cui gli esami clinici non consentono una diagnosi conclusiva. Questo è particolarmente importante nelle fasi iniziali di una malattia e nei bambini e negli adolescenti. Se la mutazione che causa la malattia è nota, si può anche chiarire in modo pre-sintomatico nei consanguinei se c’è o meno una predisposizione genetica alla malattia familiare. Va notato che il chiarimento genetico di una malattia a manifestazione tardiva e lo stato di portatore di una malattia recessiva sono riservati agli adulti.
La diagnosi del difetto genetico sottostante consente una gestione mirata della malattia e in alcuni casi le strategie terapeutiche possono essere adattate alla singola mutazione causale. La ricerca è alla costante ricerca di nuovi farmaci su misura che tengano conto delle caratteristiche genetiche individuali dei pazienti (“medicina personalizzata/di precisione”). Anche l’importanza della farmacogenetica, che consente la selezione e il dosaggio di un farmaco adatto, è in costante aumento, in quanto può aiutare a evitare effetti collaterali, inutili perdite di tempo nell’impostazione del farmaco e i costi associati.
Diagnostica genetica ad alto rendimento
Il metodo più importante per l’indagine mirata dei geni è il sequenziamento del DNA, che può determinare la sequenza delle basi nucleotidiche del materiale genetico (A, T, G, C) e quindi individuare con precisione le mutazioni genetiche. Queste analisi geniche vengono effettuate con un’efficienza senza precedenti, grazie al sequenziamento ad alto rendimento (“sequenziamento di nuova generazione”, NGS). L’NGS è più efficiente della classica analisi di un singolo gene mediante il sequenziamento Sanger e si rivela particolarmente efficace nel rilevamento delle cause delle malattie, nonché nell’analisi del DNA libero da cellule circolante nel sangue e nell’esame di una singola cellula dei campioni biologici più piccoli.
Nella NGS, viene esaminata una combinazione selezionata (il cosiddetto pannello) di geni (“sequenziamento mirato”, TS), l’intero genoma (“sequenziamento dell’intero genoma”, WGS; ~3 miliardi di basi nucleotidiche) o la sua regione codificante (“sequenziamento dell’intero esoma”, WES; ~20 000 geni). Già solo per questo motivo, non tutti gli NGS sono uguali (Fig. 2). Inoltre, esiste una differenza di prestazioni e di qualità tra i metodi NGS, che è rilevante per la diagnosi genetica.
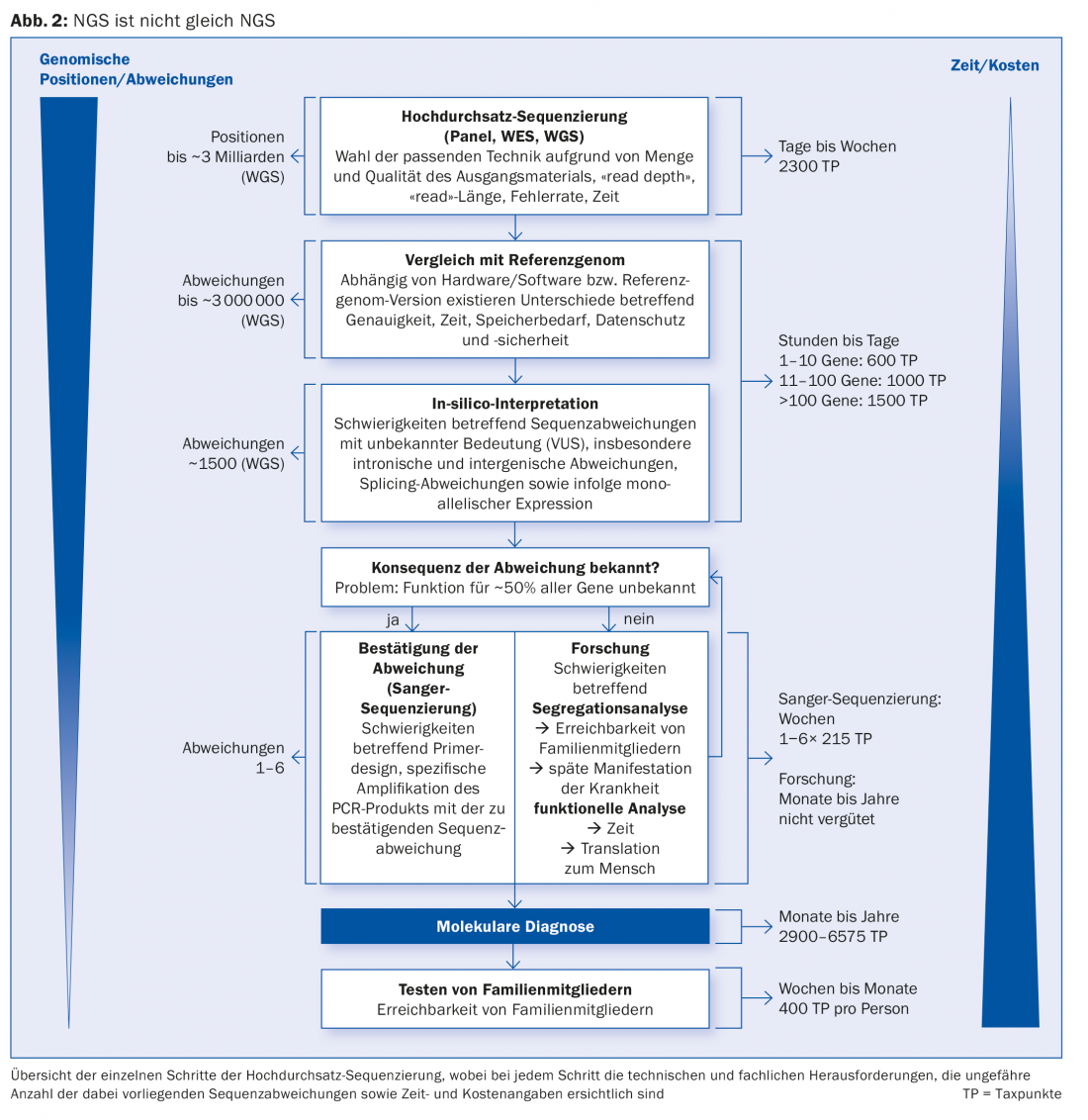
La TS può analizzare alcune regioni geniche in modo particolarmente intensivo, registrando la sequenza di oltre 1000 copie di DNA (“letture”) e rilevando così piccole quantità (<1:100) di alleli non di riferimento, che sono presenti come un cosiddetto mosaico. Questo è particolarmente necessario nell’indagine genetica dei tumori somatici. La TS è anche considerata poco costosa ed è quindi spesso utilizzata per il primo passo nello screening delle mutazioni. Tuttavia, se la mutazione che causa la malattia non viene trovata con la TS, la malattia rimane non diagnosticata e l’esame deve essere ripetuto con la WES o, meglio ancora, con la WGS. Attenzione: un risultato negativo nei geni associati alla malattia in esame al momento del chiarimento non significa che la malattia non possa essere genetica.
Sfide del sequenziamento ad alto rendimento
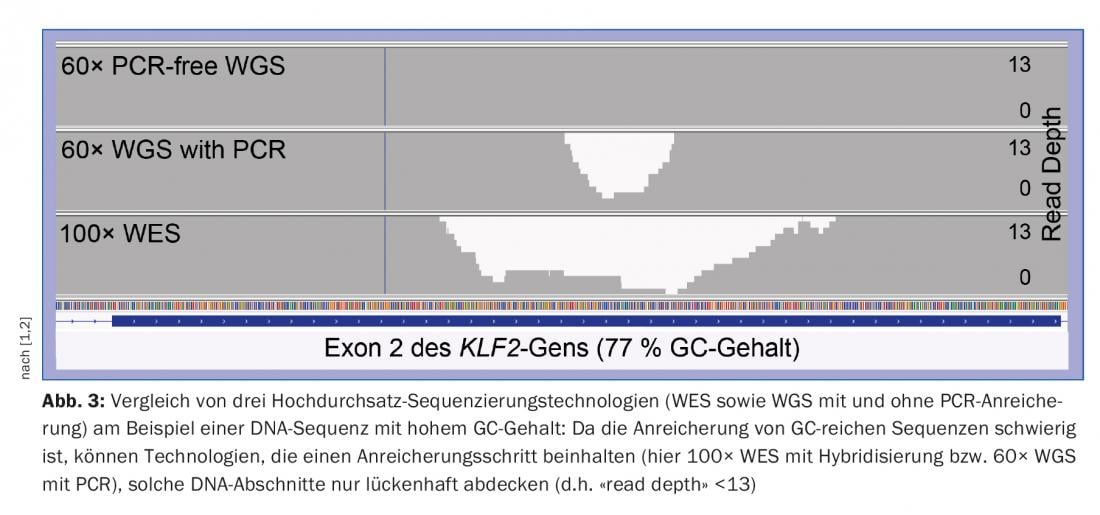
Ci sono importanti limitazioni alla NGS in termini di diagnostica genetica. In primo luogo, la lunghezza delle letture di sequenza della tecnologia NGS leader di mercato di Illumina è troppo breve (~150 basi nucleotidiche) per assegnare le regioni geniche ripetitive/omologhe più lunghe al genoma di riferimento con una posizione unica. Le più recenti tecnologie di sequenziamento (“sequenziamento di terza generazione”), ad esempio di Pacific Biosciences o Oxford Nanopore Technologies, che possono leggere frammenti di DNA significativamente più lunghi di diverse migliaia di basi nucleotidiche, promettono un rimedio. D’altra parte, la NGS delle regioni di DNA ricche di GC è più difficile, perché la coppia di basi nucleotidiche G e C ha un legame più forte rispetto alla coppia A e T. Soprattutto nella TS e nella WES, le regioni genetiche ricche di GC, come in molti casi all’inizio di un gene, non sono sufficientemente coperte (cioè non sono sufficientemente coperte da “letture di sequenziamento”), motivo per cui i requisiti di qualità della diagnostica genetica spesso non sono sufficientemente soddisfatti [1]. Con il WGS, questo problema si verifica molto meno, per cui il WGS non solo ha il vantaggio di coprire la regione non codificante del genoma, ma copre anche le regioni codificanti clinicamente particolarmente importanti (esoni) meglio del WES, soprattutto nelle regioni ricche di GC. (Fig.3). La WGS è quindi superiore alla WES e attualmente consente la migliore diagnosi genetica possibile delle malattie congenite le cui cause sono sconosciute o che si basano su mutazioni in geni grandi e complessi [2].
La grande quantità di dati (big data) generati nel contesto di un WGS può essere ridotta al livello di TS e WES con pannelli genici virtuali (in silico) e focalizzati sulla domanda clinica. Inoltre, il controllo della qualità e l’interpretazione della quantità di dati generati dalla NGS è una sfida elaborata, sia ad alta intensità di costi che intellettuale, che non è ancora adeguatamente riflessa dalla lista di analisi (AL) in vigore dal 2015 con la nuova posizione per la NGS. Soprattutto la raccolta e l’interpretazione di quei dati NGS che sono importanti per la diagnostica richiedono una grande esperienza genetica umana e possono richiedere molto tempo. Questo si applica, ad esempio, quando si trovano deviazioni di sequenza potenzialmente patogene in geni la cui funzione non è ancora (completamente) nota – il che è ancora il caso di circa la metà (~10.000) di tutti i geni umani oggi.
Sebbene gli attuali software di interpretazione tengano conto di molti parametri diversi e forniscano basi importanti per la valutazione, l’interpretazione di tali deviazioni di sequenza (le cosiddette “varianti con significato sconosciuto”, VUS) con certezza diagnostica richiede almeno un’elaborata analisi di segregazione nella famiglia (se possibile) e/o saggi/studi funzionali (ad esempio, utilizzando un modello animale corrispondente).
Risultati incidentali clinicamente rilevanti
Prima di un esame genetico, si deve anche discutere con la persona da esaminare se eventuali risultati incidentali con significato clinico ma senza riferimento alla domanda di ricerca (i cosiddetti “risultati incidentali”) debbano essere segnalati solo se si conoscono misure preventive o di trattamento [3]. Questo dimostra che i risultati di un esame genetico non sono paragonabili a quelli di altri esami medici di laboratorio e che la loro valutazione deve essere affidata alle mani esperte degli specialisti in genetica medica FAMH/FMH. L’attuale lista di analisi prevede quindi che la NGS di più di dieci geni possa essere prescritta solo da medici con una qualifica federale post-laurea in “genetica medica”. La consulenza genetica richiesta dalla legge prima e dopo un esame genetico deve essere fornita anche da medici genetisti (GUMG Art. 14). La consulenza deve prendere in considerazione solo la situazione individuale e familiare della persona interessata e non gli interessi sociali generali. Deve prendere in considerazione i possibili effetti psicologici e sociali del risultato dell’esame sulla persona interessata e sulla sua famiglia.
Rimborso da parte dell’assicurazione di base
La diagnostica genetica è un’attività particolarmente responsabile. Di norma, le scoperte genetiche non riguardano solo la persona esaminata per tutta la sua vita (“lifetime value”), ma possono avere un’influenza sull’intera famiglia per generazioni. Diagnosi errate o mancanti possono portare a trattamenti errati con gravi conseguenze, a stress psicologico e restrizioni inutili o alla nascita di altri bambini gravemente colpiti. Al di là dell’onere o della malattia dei singoli pazienti e delle famiglie, ciò può comportare anche notevoli costi economici. Al contrario, la quota di tutte le analisi diagnostiche genetiche e di laboratorio rappresenta solo il 3% circa dei costi annuali totali del nostro sistema sanitario.
La lista di analisi (www.bag.admin.ch) regola la remunerazione per la NGS, che può essere addebitata solo se i costi dell’analisi classica di un singolo gene mediante sequenziamento Sanger sarebbero superiori a 2795 punti fiscali (TP), che si applicano ai geni con più di 13 sequenze target (esoni). La tariffa per l’NGS consiste nell’effettivo sequenziamento ad alto rendimento (2300 TP) e nell’analisi bioinformatica per 1-10 geni (600 TP), per 11-100 geni (1000 TP) o per più di 100 geni (1500 TP). Insieme all’indagine di conferma dei risultati NGS positivi, il listino di analisi prevede una remunerazione da 2900 TP a 6575 TP, che tuttavia non copre i costi per il chiarimento genetico di casi clinicamente complessi (rari) fino all’endpoint diagnostico. È difficile credere che questa lacuna nel sistema sanitario svizzero debba essere colmata dall’impegno della popolazione e delle organizzazioni private (cfr. stiftung-seltene-krankheiten.ch). Inoltre, gli esami genetici esplicitamente elencati nella lista delle analisi vengono rifiutati arbitrariamente da diverse compagnie di assicurazione sanitaria, per cui anche in questo caso è urgente intervenire. Il rimborso dei test genetici per scopi medici deve essere migliorato, in modo che gli sviluppi clinicamente molto rilevanti nel campo della genetica umana possano essere tradotti in diagnostica.
Prospettiva
In futuro, la diagnostica genetica sarà fondamentale – non solo per il rilevamento dei difetti genetici che causano malattie, ma anche per l’analisi farmacogenetica dei geni che aiutano a determinare la farmacocinetica e la dinamica dei farmaci utilizzati e quindi la loro selezione e il loro dosaggio. Inoltre, aumenterà l’importanza medica della registrazione delle mutazioni genetiche somatiche. Anche le modifiche (epi)genetiche che non influenzano direttamente la sequenza del DNA dei geni, ma piuttosto la loro regolazione, sono sempre più studiate e comprese. Forti effetti genetici possono essere identificati anche in malattie multifattoriali comuni.
Nuovi metodi come CRISPR/Cas aprono possibilità ma anche pericoli nel trattamento delle malattie genetiche. Nonostante i risultati promettenti degli esperimenti in vivo, questa tecnologia è ancora lontana dall’essere introdotta nella pratica medica quotidiana. Da un lato, perché il metodo non è ancora completamente sviluppato, dall’altro, perché le questioni etiche e legali devono essere discusse per limitare qualsiasi potenziale di abuso.
Tuttavia, è ovvio che la genetica determinerà il futuro della medicina e che la medicina sarà orientata alla genetica nella prevenzione, nella diagnosi e nella terapia.
Messaggi da portare a casa
- Non tutti i test genetici sono uguali: I metodi utilizzati determinano la significatività di ogni test.
- Con gli opportuni test genetici all’avanguardia, oggi si possono fare diagnosi che altrimenti non sarebbero possibili.
- La comparsa frequente e/o precoce o sindromica di una malattia nella famiglia può indicare una causa genetica.
- Il chiarimento genetico è importante non solo per la diagnosi, la prognosi, la prevenzione e la consulenza familiare, ma anche per il trattamento causale o farmacologico.
Letteratura:
- Meienberg J, et al.: Nuove intuizioni sulle prestazioni delle piattaforme di cattura dell’esoma intero umano. Nucleic Acids Res 2015; 43: e76.
- Meienberg J, et al: Sequenziamento clinico: il WGS è il WES migliore? Hum Genet 2016; 135: 359-362.
- Kalia SS, et al: Raccomandazioni per la segnalazione dei risultati secondari nel sequenziamento clinico dell’esoma e del genoma, aggiornamento 2016 (ACMG SF v2.0): una dichiarazione politica dell’American College of Medical Genetics and Genomics. Genet Med 2017; 19: 249-255.
Ulteriori letture:
- Henggeler C, Matyas G: Modi di diagnosticare – test genetici per scopi medici. HAUSARZT PRAXIS 2015; 10(3): 4.
- Matyas G, Henggeler C, Oexle K: Genetica cardiovascolare e diagnostica genetica. Medinfo 2015; 2: 16-24.
- Matyas G, Spiegel R: Chiarimento genetico per scopi medici. Medinfo 2012; 2: 50-58.
- Oexle K, Henggeler C, Matyas G: La crescente importanza della genetica in medicina. HAUSARZT PRAXIS 2015; 10(9): 9.
PRATICA GP 2017; 12(9): 14-18











