Considerata a lungo la “valvola dimenticata”, la valvola tricuspide (TC) ha guadagnato sempre più attenzione negli ultimi anni. Ciò è dovuto non da ultimo allo sviluppo di nuove procedure terapeutiche attraverso un approccio transcatetere, che ora possono offrire a molti pazienti un’opzione di trattamento efficace in aggiunta alla terapia farmacologica e chirurgica.
Considerata a lungo la “valvola dimenticata”, la valvola tricuspide (TC) ha guadagnato sempre più attenzione negli ultimi anni. Ciò è dovuto non da ultimo allo sviluppo di nuove procedure terapeutiche attraverso un approccio transcatetere, che ora possono offrire a molti pazienti un’opzione di trattamento efficace in aggiunta alla terapia farmacologica e chirurgica.
Il rigurgito tricuspidale (TI) rilevante si riscontra in circa il 4% della popolazione anziana (≥75 anni di età), con una percentuale maggiore nelle donne [1]. A causa dello sviluppo demografico, si prevede un aumento della prevalenza nei prossimi anni. Mentre in precedenza si riteneva che la TI fosse solo una concomitanza di un’altra malattia cardiaca, oggi si sa che ha un impatto significativo sulla prognosi e sul decorso clinico dei pazienti a sé stante. L’aumento della mortalità può essere osservato già con la TI lieve – anche dopo l’analisi aggiustata per altri fattori come le comorbidità, la compromissione della funzione ventricolare sinistra o l’ipertensione polmonare. Anche dopo che la causa originale è stata corretta, per esempio con un intervento chirurgico o un trattamento transcatetere della patologia valvolare sinistra, la gravità della TI può persistere e peggiorare significativamente la prognosi del paziente [2,3].
Poiché la maggior parte dei pazienti non può essere sottoposta a un trattamento chirurgico a cielo aperto a causa dell’età e delle co-morbilità, con il conseguente rischio chirurgico elevato, e poiché la terapia farmacologica presenta limitazioni significative, per molto tempo è rimasto un grande divario terapeutico. L’obiettivo dello sviluppo di procedure transcatetere è quello di colmare questa lacuna. Questo articolo si propone di fornire una panoramica dell’attuale comprensione dell’eziologia, delle modalità diagnostiche e delle attuali opzioni di trattamento interventistico.
Eziologia e presentazione clinica
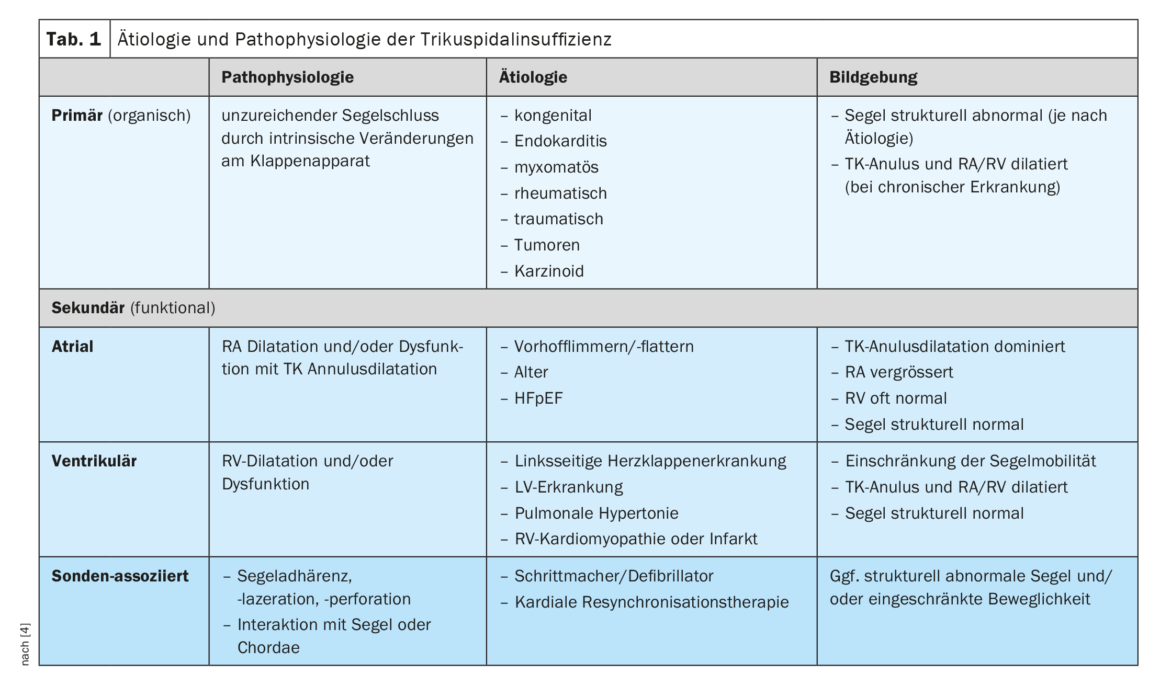
La TI primaria (organica) si riscontra nell’8-10% dei pazienti e fisiopatologicamente corrisponde a una chiusura insufficiente del lembo a causa di cambiamenti intrinseci nell’apparato valvolare (Tabella 1) [4]. Dal punto di vista eziologico, ciò può essere dovuto ad alterazioni congenite, endocardite, malattie mixomatose o reumatiche, traumi, tumori o carcinoidi (sindrome di Hedinger). La diagnostica per immagini mostra una struttura anomala dei foglietti, a seconda della causa sottostante, e spesso una successiva dilatazione dell’anulus TC e dei seni cardiaci destri [5]. Al contrario, nella TI atriale secondaria (funzionale), la dilatazione dell’anulus TC dovuta alla dilatazione dell’atrio destro (RA) è il meccanismo dominante. Dal punto di vista eziologico, la TI atriale secondaria deriva spesso dalla fibrillazione/flutter atriale o dall’insufficienza cardiaca con frazione di eiezione conservata (HFpEF). Se la TI sia una conseguenza o una causa della VHF è oggetto di ricerca attuale, ma è stato dimostrato che la conversione al ritmo sinusale può ridurre significativamente la gravità della TI. La forma più comune è la TI ventricolare secondaria, in cui la dilatazione della RV limita o interrompe la mobilità della vela. Questo è spesso causato da una malattia valvolare o ventricolare sinistra, dall’ipertensione polmonare o da una patologia del ventricolo destro (RV, cardiomiopatia o infarto). Se la funzione RV è compromessa, questo è anche un predittore di prognosi clinica peggiore, indipendentemente da qualsiasi dilatazione RV [6]. All’imaging, la mobilità dei lembi sembra essere principalmente limitata in sistole e le cavità cardiache del lato destro sono dilatate e/o disfunzionali. Infine, la TI può verificarsi in combinazione con una sonda di pacemaker o di defibrillatore; una forma di TI che spesso viene sottovalutata nella sua prevalenza. La causa può essere una lesione diretta dell’apparato valvolare durante l’impianto o un’interazione meccanica con un foglietto o con le corde. Anche la dissincronia indotta dal pacing RV può avere un ruolo, dato che lo sviluppo di TI è stato osservato anche con i pacemaker wireless. Ciò che tutte le forme di TI hanno in comune è che la dilatazione delle cavità cardiache del lato destro e dell’anulus TK da parte della TI stessa la intensifica ulteriormente, dando luogo a un circolo vizioso con un’insufficienza in costante aumento.
A livello clinico, la TI provoca principalmente i sintomi dell’insufficienza cardiaca destra, come l’edema periferico, l’ascite, la diminuzione dell’appetito, il gonfiore e la congestione venosa giugulare, dovuta al reflusso nel sistema venoso. In caso di TI molto pronunciato, si può osservare una chiara pulsatilità della vena giugulare a occhio nudo durante l’esame clinico. Tuttavia, contrariamente a quanto si crede, la TI grave può anche portare ad affaticamento, intolleranza alle prestazioni e dispnea da sforzo a causa del cedimento in avanti (bassa potenza) . A causa del cedimento in avanti e dell’aumento della pressione venosa centrale causata dalla TI, si verifica anche una riduzione del gradiente artero-venoso negli organi terminali (bassa pressione arteriosa media e alta CVD). Anche nei pazienti che sono soggettivamente privi di sintomi, questo può compromettere la funzione epatica e renale in particolare – come sindrome cardio-epatica o cardio-renale.
Modalità diagnostiche
Oltre all’anamnesi e ai segni clinici all’esame, l’ecocardiografia transtoracica (TTE) svolge un ruolo decisivo nella diagnosi e nella valutazione della TI. Tuttavia, a causa di vari aspetti, la presentazione della TC e della sua insufficienza è molto impegnativa, per cui spesso la TI non viene riconosciuta o viene sottovalutata. Rispetto al lato sinistro del cuore, nel TC prevalgono condizioni di bassa pressione e la struttura della valvola è molto delicata; inoltre, il grado di gravità del TI che può essere rappresentato è fortemente dipendente dal volume e quindi soggetto a grandi fluttuazioni (ad esempio, nei pazienti in dialisi o in terapia diuretica). Ulteriori sfide derivano dalla complessa geometria tridimensionale della valvola tricuspide con il suo anulus ellittico, non planare e a forma di sella, il layout spesso multi-segmentato (>3 foglietti) della TC, nonché i possibili artefatti dell’immagine dovuti alle sonde di pacemaker/defibrillatori e alle valvole cardiache protesiche sinistre [7].
La TTE è di solito sufficiente per la diagnosi e la classificazione della gravità, in quanto la valvola tricuspide si trova in posizione ventrale rispetto al torace e vicino al trasduttore, ma l’ecocardiografia transesofagea (TEE) è di solito necessaria per una valutazione accurata del meccanismo di base della TI e per la pianificazione di qualsiasi intervento. Per domande particolari o per la pianificazione di determinati interventi, si può eseguire anche una tomografia computerizzata (TC) o una risonanza magnetica (RM). Oltre al TI, la RV può essere valutata accuratamente in termini di funzione e dimensione. Dal momento che la valutazione ecocardiografica del gradiente di pressione polmonare nella TI grave non è affidabile e spesso è significativamente sottostimata, si dovrebbe prendere in considerazione l’esecuzione di un cateterismo cardiaco destro per la valutazione emodinamica.
Nell’ecocardiografia vengono utilizzati diversi parametri per classificare la gravità, per cui di solito si fa una distinzione tra TI lieve, moderata e grave. Tuttavia, poiché, soprattutto nel caso della malattia TK, i pazienti spesso si presentano o vengono diagnosticati tardivamente nel corso della malattia e i parametri sono molto al di sopra del cut-off per la TI grave, gli esperti hanno proposto di estendere lo spettro di gravità con due ulteriori livelli: oltre alla TI grave, esistono anche la TI “massiccia” e la TI “torrenziale”. (torrenziale) TI [8,9]. Questo ha un impatto particolare sull’interpretazione appropriata del risultato post-intervento: per esempio, la riduzione di un TI “torrenziale” a un TI grave può comportare un miglioramento significativo dei sintomi clinici e della prognosi del paziente, anche se formalmente il TI rimane grave dal punto di vista ecocardiografico. La classificazione della gravità in cinque fasi è stata utilizzata negli studi clinici per diversi anni ed è stata anche inclusa nelle nuove linee guida ESC per la cardiopatia valvolare, pubblicate di recente [10].
Opzioni terapeutiche
Farmaci: la terapia nei pazienti con TI si basa principalmente sulle comorbidità cardiopolmonari presenti. Il trattamento dell’insufficienza cardiaca o della cardiopatia valvolare sinistra con o senza ipertensione polmonare deve essere conforme alle linee guida attuali. La somministrazione di diuretici è utile per ridurre i sintomi, ma l’equilibrio di trovare il dosaggio ottimale tra i sintomi clinici e la funzione renale dei pazienti è spesso difficile. Molti pazienti hanno già una funzione renale compromessa al momento della diagnosi, che può aggravarsi con la terapia diuretica. Tuttavia, anche in questo caso, il trattamento diuretico non deve essere completamente interrotto in caso di TI grave, poiché ciò aumenta notevolmente il rischio di scompenso cardiaco destro e aumenta anche l’aspetto dannoso per i reni della TI stessa. Si può prendere in considerazione anche la somministrazione di antagonisti del recettore mineralcorticoide e di inibitori del trasportatore di glucosio sodio-dipendente renale SGLT2 (co-trasportatore di glucosio sodio-dipendente 2), ma anche in questo caso mancano studi specifici sul loro utilizzo nella TI di alto grado. L’obiettivo della terapia farmacologica dovrebbe essere quello di raggiungere e mantenere una TI lieve. Se questo non è possibile, si deve presentare precocemente a un centro per le valvole cardiache, secondo le linee guida dell’ESC.
Chirurgico: il trattamento chirurgico rimane la prima scelta per i pazienti sintomatici con TI primaria grave. Se la dilatazione o il declino funzionale della RV sono già evidenti come risultato della TI primaria, la chirurgia può essere presa in considerazione anche nei pazienti a- o oligosintomatici. La correzione chirurgica di una TI secondaria è particolarmente utile quando il paziente deve sottoporsi a un intervento chirurgico alla valvola sinistra. Il rischio perioperatorio probabilmente non aumenta in modo significativo, ma la riduzione dell’anulus TC può avere effetti positivi sulla RV e sullo stato funzionale del paziente. L’intervento chirurgico isolato per la TI secondaria, invece, dovrebbe essere eseguito solo in pazienti strettamente selezionati che non hanno subito un intervento di chirurgia cardiaca e nei quali la malattia non è ancora molto avanzata e la funzione RV è intatta. Nel frattempo, sono stati sviluppati due punteggi di rischio per la valutazione del rischio operatorio nel TI isolato [11,12], che consentono di valutare la mortalità e la morbilità operativa. In generale, i dati al riguardo sono limitati, ma mostrano un alto tasso di mortalità, un elevato carico di costi, lunghe degenze ospedaliere e lunghi processi di recupero nei pazienti che hanno subito un intervento chirurgico [13,14].
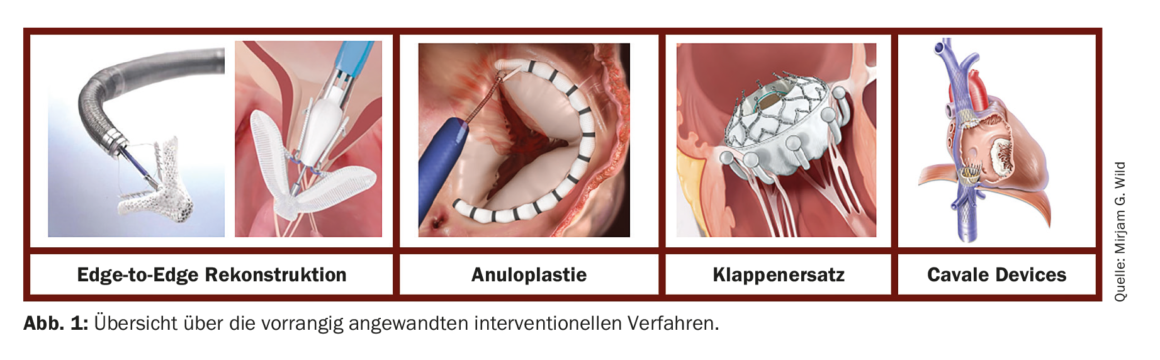
Intervento: negli ultimi anni, sono state sviluppate diverse procedure interventistiche per il trattamento della TC tramite accesso transcatetere. La maggior parte è presa in prestito da procedure chirurgiche, come nel caso della valvola mitrale. Viene fatta una distinzione tra i metodi di ricostruzione che mirano ad approssimare le vele mediante una tecnica edge-to-edgee quelli che riducono le dimensioni dell’anulus TC mediante il reefing dell’anulus. Oltre alla ricostruzione, oggi sono disponibili diversi sistemi per la sostituzione transcatetere della valvola. Rispetto al trattamento della valvola mitrale, le condizioni anatomiche (struttura del lembo più sottile, dimensioni anulari maggiori e lacune di coaptazione più ampie) e tecniche (imaging impegnativo, navigazione più difficile nell’apparato valvolare multi-fogliale) pongono talvolta sfide immense, motivo per cui gli interventi devono essere eseguiti solo presso centri esperti e specializzati. La Figura 1 mostra una panoramica dei metodi attualmente utilizzati in via prioritaria.
La maggior parte delle procedure utilizza una via di accesso femoro-venosa e di solito richiede l’anestesia generale, in quanto è necessario un monitoraggio TEE continuo oltre alla fluoroscopia. L’ecocardiografia intracardiaca ( ICE) può essere utile come complemento alla TEE se la qualità dell’immagine è limitata.
A: Ricostruzione da bordo a bordo
Attualmente, la tecnica transcatetere più utilizzata in tutto il mondo per il trattamento della TI grave è la cosiddetta ricostruzione edge-to-edge, per la quale sono disponibili due sistemi approvati in commercio: il sistema TriClip®(Abbott Vascular, Chicago US) e il sistema PASCAL®(Edwards Lifesciences, Irvine US). Entrambi i sistemi si differenziano per le caratteristiche tecniche del catetere di alimentazione, la controllabilità e la struttura fine dei dispositivi a clip, ma il principio di base è lo stesso: nel sito del getto di maggiore insufficienza, la coaptazione viene migliorata avvicinando i lembi della valvola attraverso l’impianto, riducendo così il reflusso. In una valvola possono essere impiantate diverse clip e i diversi sistemi possono essere combinati per adattarsi alle condizioni anatomiche individuali del paziente. Entrambi i sistemi TriClip® e PASCAL® hanno dimostrato negli studi di essere sicuri e benefici [15–18]. Oltre al miglioramento dei sintomi clinici, sono stati osservati una riduzione delle dimensioni cardiache del lato destro, un miglioramento della funzione RV, una maggiore gittata cardiaca e una diminuzione degli enzimi epatici elevati [19,20].
B: Annuloplastica
Il sistema Cardioband®(Edwards Lifesciences, Irvine US) imita l’annuloplastica chirurgica ed è stato originariamente sviluppato per la valvola mitrale. Tuttavia, questo sistema si è ormai affermato per l’annuloplastica percutanea diretta della valvola tricuspide e ha ricevuto l’approvazione (marchio CE) nel 2018 [21]. Durante l’intervento, un legamento viene ancorato nell’anulus per mezzo di un massimo di 17 viti e poi stretto, il che porta a una sorta di serraggio dell’anulus e in questo modo a un miglioramento della coaptazione della vela. In uno studio prospettico, il sistema ha ottenuto buoni risultati tecnici e funzionali. A causa della stretta vicinanza all’arteria coronaria destra, il suo decorso deve essere attentamente monitorato prima della procedura (mediante TAC) e intraprocedurale (mediante fluoroscopia e angiografia) per escludere una compromissione.
C: Sostituzione della valvola
Attualmente sono in fase di sperimentazione preclinica e clinica diversi sistemi per la sostituzione percutanea della valvola tricuspide nativa. L’esperienza e l’applicazione più attuale è quella del sistema EVOQUE (Edwards Lifesciences, Irvine US), in cui la valvola artificiale viene stabilizzata per mezzo di piccoli bracci di ancoraggio che racchiudono i foglietti nativi. Il sistema ha già alcuni dati promettenti [22] e l’approvazione CE è prevista nel prossimo futuro.
D: Dispositivi Cavale
Nei pazienti in cui l’intervento diretto sulla valvola tricuspide non è possibile per motivi anatomici, si possono impiantare sistemi di valvole stent a monte nelle vena cavae per ridurre al minimo il ritorno venoso. Il sistema TricValve (P+F PRODUCTS + FEATURES GMBH, Vienna AT) è composto da due stent con un elemento a lembo ciascuno, che sono disponibili in diverse dimensioni e possono quindi essere adattati alle dimensioni cavali. Il sistema ha recentemente (2021) ricevuto l’approvazione commerciale grazie alla comprovata sicurezza ed efficienza [23].
L’evidenza attualmente disponibile sulla terapia transcatetere della TI è costituita in gran parte da dati di registro, rapporti di esperienze cliniche e studiprospettici «single-arm». Il registro TriValve è stato il primo grande registro TI a raccogliere dati multicentrici. In questo caso, è stato dimostrato un alto tasso di successo tecnico e un basso tasso di complicanze per tutte le procedure registrate [24]. In un ulteriore studio comparativo (studio caso-controllo con corrispondenza di propensione), 268 pazienti del registro sono stati confrontati con pazienti trattati solo con farmaci. Questo ha mostrato un chiaro vantaggio in termini di sopravvivenza e una riduzione del tasso di riospedalizzazione dopo un anno [25].
Significato per la pratica clinica quotidiana
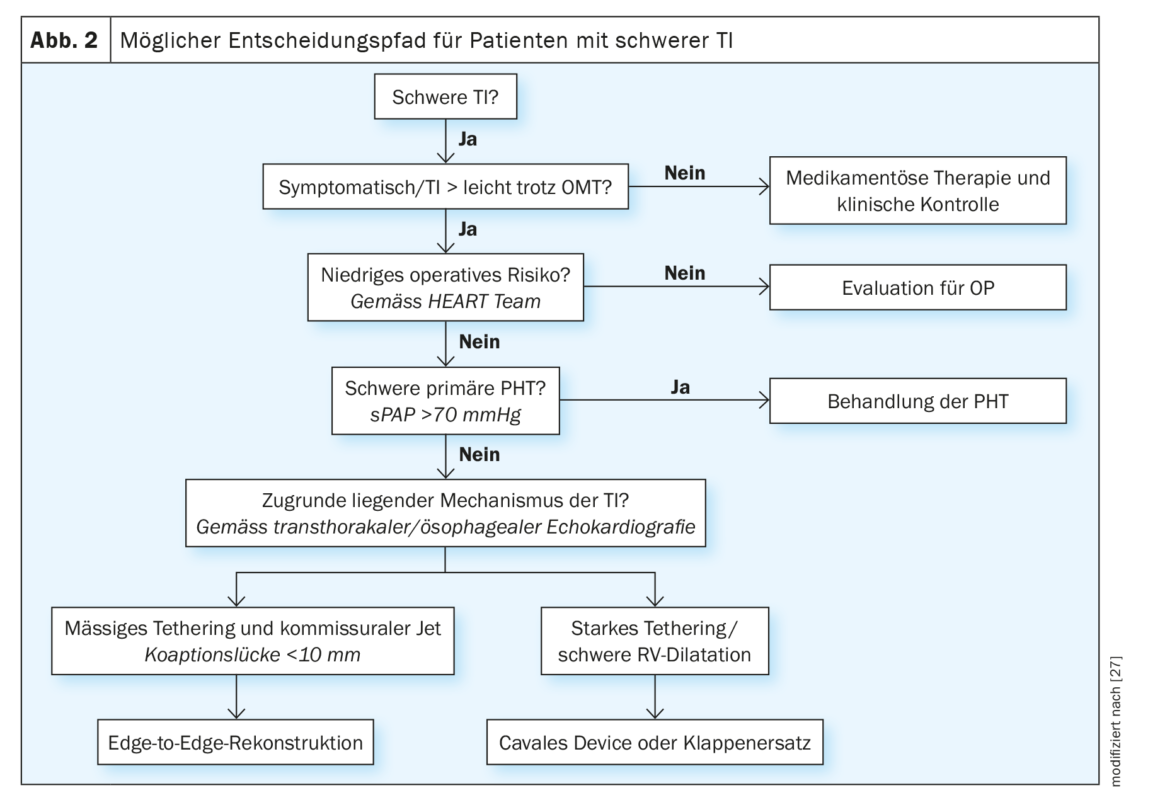
I pazienti con sospetto clinico o ecocardiografico di TI rilevante devono essere indirizzati precocemente a un centro valvolare specializzato per una valutazione più dettagliata (secondo le attuali linee guida ESC). Tuttavia, la scelta del tempo di intervento ottimale e delle procedure di trattamento appropriate continua ad essere una sfida importante anche per gli esperti. Finora non sono disponibili studi comparativi per le diverse procedure transcatetere, ma sulla base dell’esperienza clinica e delle evidenze raccolte finora, si possono formulare raccomandazioni orientative. (Fig. 2). Nei pazienti che sono sintomatici nonostante l’intensificazione della terapia medica, che hanno scompensi cardiaci destrorsi ricorrenti o nei quali non è possibile ridurre la TI a un grado lieve, il meccanismo sottostante della TI e la funzione RV devono essere indagati dopo aver escluso l’ipertensione polmonare primaria grave. Questo di solito include una TEE e un cateterismo cardiaco destro, oltre a una TAC aggiuntiva se l’annuloplastica, la sostituzione della valvola o il dispositivo cavale sono una possibilità. Tutti i pazienti devono essere discussi e valutati in un team cardiaco interdisciplinare. Sulla base dell’imaging pre-procedurale, si possono identificare diverse caratteristiche anatomiche che qualificano il paziente per i diversi sistemi di trattamento.
Ad esempio, per i getti da insufficienza con deficit di coaptazione limitato (<8 mm), è più probabile che si consideri la ricostruzione da bordo a bordo. Nella malattia avanzata con dilatazione della RV, ampio deficit di coaptazione e legatura dei lembi, la ricostruzione transcatetere della valvola potrebbe non essere tecnicamente possibile. Questi pazienti possono essere valutati per la sostituzione valvolare ortotopica (attualmente solo in fase di sperimentazione clinica) o eterotopica. La presenza di un pacemaker o di una sonda di defibrillatore non è una controindicazione fondamentale al trattamento TI transcatetere. Poiché per questo gruppo di pazienti sono stati mostrati risultati di trattamento simili a quelli dei pazienti senza elettrodo, si possono utilizzare gli stessi criteri per determinare il percorso di trattamento [26]. La rimozione della sonda può anche essere valutata come parte di un piano terapeutico individuale.
Prospettiva
I pazienti con TI grave rappresentano una popolazione di pazienti molto eterogenea e complessa. Negli ultimi anni, sono state sviluppate e approvate commercialmente diverse procedure transcatetere per il trattamento, offrendo un’opzione terapeutica a molti pazienti precedentemente non serviti. Numerosi studi, come grandi registri longitudinali o studi controllati randomizzati condotti dall’industria (ad esempio TRILUMINATE, CLASP TR, TRISCEND II) e dai ricercatori (ad esempio TRIC-I-HF) saranno in grado di fornire nuove conoscenze nei prossimi anni.
La selezione dei pazienti e la scelta della procedura di trattamento appropriata continuano a rappresentare delle sfide, motivo per cui i pazienti affetti dovrebbero essere indirizzati a un centro valvolare specializzato in una fase precoce, prima dell’insorgenza della disfunzione RV. Si dovrebbe anche cercare una comprensione più completa dello sviluppo della malattia e dei meccanismi fisiopatologici sottostanti, per poter modulare il decorso della malattia, se necessario.
Messaggi da portare a casa
- Il rigurgito tricuspidale (TI), anche indipendentemente da altri fattori, ha un impatto significativo sulla prognosi e sul decorso clinico dei pazienti.
- Nuove procedure transcatetere come la ricostruzione da bordo a bordo o
La sostituzione della valvola offre opzioni di trattamento alternative per molti pazienti precedentemente non serviti. - I pazienti affetti dovrebbero essere indirizzati a un centro valvolare specializzato in una fase precoce, in modo che un team cardiaco possa determinare l’indicazione,
si può identificare il momento e la procedura di trattamento appropriata. - Auf Basis des derzeitigen Wissensstandes kann eine interventionelle
Therapie der TI bei den folgenden Konstellationen erwogen werden:- TI sintomatico, grave,
- TI sintomatica, da moderata a grave, con precedente scompenso cardiaco destro,
- TI sintomatica, da moderata a grave, con dosi di diuretico crescenti.
Letteratura:
- Topilsky Y, Maltais S, Medina Inojosa J, et al.: Burden of Tricuspid Regurgitation in Patients Diagnosed in the Community Setting. JACC Cardiovascular imaging 2019; 12: 433–442.
- Nath J, Foster E, Heidenreich PA: Impact of tricuspid regurgitation on long-term survival. Journal of the American College of Cardiology 2004; 43: 405–409.
- Wang N, Fulcher J, Abeysuriya N, et al.: Tricuspid regurgitation is associated with increased mortality independent of pulmonary pressures and right heart failure: a systematic review and meta-analysis. European heart journal 2019; 40: 476–484.
- Praz F, Muraru D, Kreidel F, et al.: Transcatheter treatment for tricuspid valve disease. EuroIntervention: journal of EuroPCR in collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology 2021; 17: 791–808.
- Hahn RT, Waxman AB, Denti P, Delhaas T: Anatomic Relationship of the Complex Tricuspid Valve, Right Ventricle, and Pulmonary Vasculature: A Review. JAMA cardiology 2019; 4: 478–487.
- Dietz MF, Prihadi EA, van der Bijl P, et al.: Prognostic Implications of Right Ventricular Remodeling and Function in Patients With Significant Secondary Tricuspid Regurgitation. Circulation 2019; 140: 836–845.
- Hahn RT, Thomas JD, Khalique OK, et al.: Imaging Assessment of Tricuspid Regurgitation Severity. JACC Cardiovascular imaging 2019; 12: 469–490.
- Hahn RT, Zamorano JL: The need for a new tricuspid regurgitation grading scheme. European heart journal cardiovascular Imaging 2017; 18: 1342–1343.
- Go YY, Dulgheru R, Lancellotti P: The Conundrum of Tricuspid Regurgitation Grading. Frontiers in cardiovascular medicine 2018; 5: 164.
- Vahanian A, Beyersdorf F, Praz F, et al.: 2021 ESC/EACTS Guidelines for the management of valvular heart disease. European heart journal 2022; 43: 561–632.
- Dreyfus J, Audureau E, Bohbot Y, et al.: TRI-SCORE: a new risk score for in-hospital mortality prediction after isolated tricuspid valve surgery. European heart journal 2022; 43: 654–662.
- LaPar DJ, Likosky DS, Zhang M, et al.: Development of a Risk Prediction Model and Clinical Risk Score for Isolated Tricuspid Valve Surgery. The Annals of thoracic surgery 2018; 106: 129-136.
- Zack CJ, Fender EA, Chandrashekar P, et al.: National Trends and Outcomes in Isolated Tricuspid Valve Surgery. Journal of the American College of Cardiology 2017; 70: 2953–2960.
- Alqahtani F, Berzingi CO, Aljohani S, et al.: Contemporary Trends in the Use and Outcomes of Surgical Treatment of Tricuspid Regurgitation. Journal of the American Heart Association 2017; 6.
- Braun D, Nabauer M, Orban M, et al.: One-year results of transcatheter treatment of severe tricuspid regurgitation using the edge-to-edge repair technique. EuroIntervention: journal of EuroPCR in collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology 2018; 14: e413–e415.
- Nickenig G, Weber M, Lurz P, et al.: Transcatheter edge-to-edge repair for reduction of tricuspid regurgitation: 6-month outcomes of the TRILUMINATE single-arm study. Lancet 2019; 394: 2002–2011.
- Kodali S, Hahn RT, Eleid MF, et al.: Feasibility Study of the Transcatheter Valve Repair System for Severe Tricuspid Regurgitation. Journal of the American College of Cardiology 2021; 77: 345–356.
- Wild MG, Low K, Rosch S, et al.: Multicenter Experience With the Transcatheter Leaflet Repair System for Symptomatic Tricuspid Regurgitation. JACC Cardiovascular interventions 2022; 15: 1352–1363.
- Karam N, Braun D, Mehr M, et al.: Impact of Transcatheter Tricuspid Valve Repair for Severe Tricuspid Regurgitation on Kidney and Liver Function. JACC Cardiovascular interventions 2019; 12: 1413–1420.
- Orban M, Braun D, Deseive S, et al.: Transcatheter Edge-to-Edge Repair for Tricuspid Regurgitation Is Associated With Right Ventricular Reverse Remodeling in Patients With Right-Sided Heart Failure. JACC Cardiovascular imaging 2019.
- Nickenig G, Weber M, Schuler R, et al.: Two-year Outcomes with the Cardioband Tricuspid System from the Multicentre, Prospective TRI-REPAIR Study. EuroIntervention: journal of EuroPCR in collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology 2020.
- Webb JG, Chuang AM, Meier D, et al.: Transcatheter Tricuspid Valve Replacement With the EVOQUE System: 1-Year Outcomes of a Multicenter, First-in-Human Experience. JACC Cardiovascular interventions 2022; 15: 481–491.
- Estevez-Loureiro R, Sanchez-Recalde A, Amat-Santos IJ, et al.: 6-Month Outcomes of the TricValve System in Patients With Tricuspid Regurgitation: The TRICUS EURO Study. JACC Cardiovascular interventions 2022; 15: 1366–1377.
- Mehr M, Taramasso M, Besler C, et al.: 1-Year Outcomes After Edge-to-Edge Valve Repair for Symptomatic Tricuspid Regurgitation: Results From the TriValve Registry. JACC Cardiovascular interventions 2019; 12: 1451–1461.
- Taramasso M, Benfari G, van der Bijl P, et al.: Transcatheter versus medical treatment of symptomatic severe tricuspid regurgitation. Journal of the American College of Cardiology 2019.
- Taramasso M, Gavazzoni M, Pozzoli A, et al.: Outcomes of TTVI in Patients With Pacemaker or Defibrillator Leads: Data From the TriValve Registry. JACC Cardiovascular interventions 2020.
- Winkel MG, Brugger N, Khalique OK, et al.: Imaging and Patient Selection for Transcatheter Tricuspid Valve Interventions. Frontiers in cardiovascular medicine 2020; 7: 60.
HAUSARZT PRAXIS 2023; 18(4): 8–13