La genesi della poliartrite reumatoide (RA) è ancora in gran parte poco chiara. Tuttavia, con l’introduzione dei nuovi farmaci biologici – dopo decenni di ricerca immunologica – sono state finalmente sviluppate nuove strategie terapeutiche rivoluzionarie per questa malattia, che finora poteva essere trattata solo in modo incompleto.
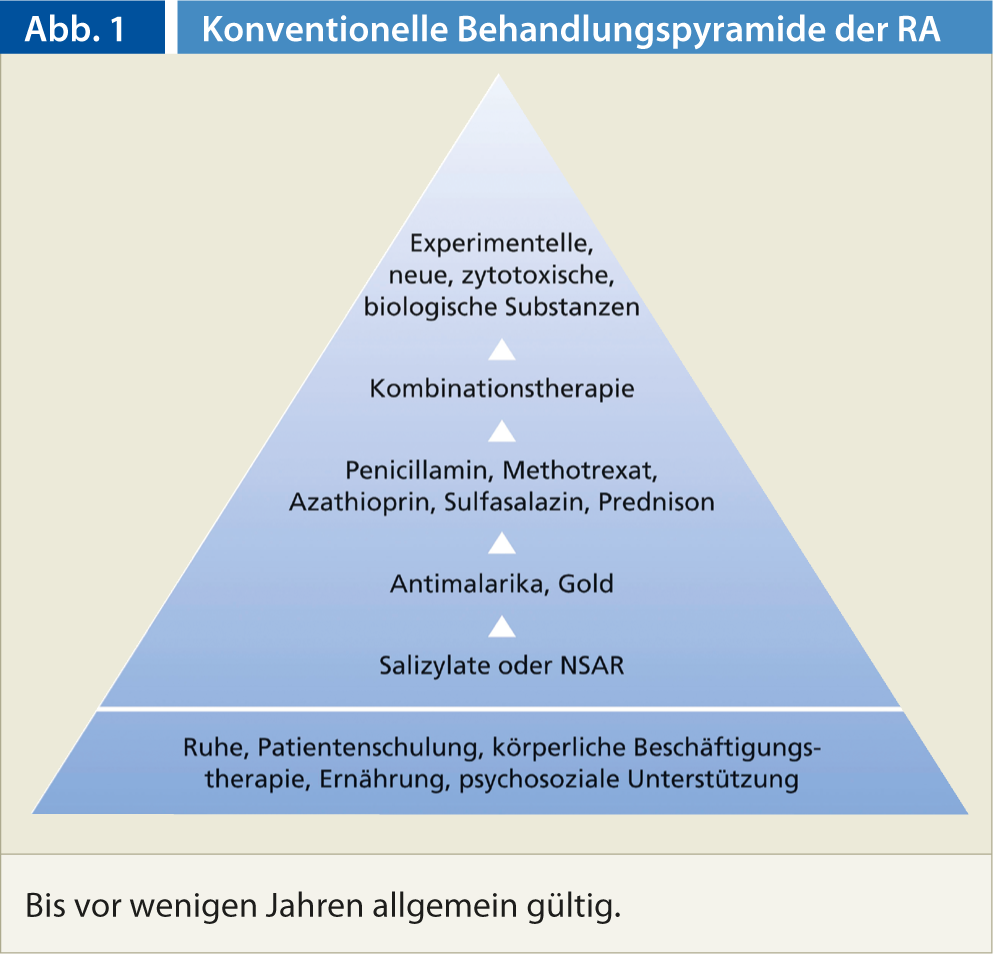
Finora, il trattamento farmacologico dell’artrite reumatoide si è basato sulla piramide di trattamento convenzionale (Fig. 1). Il modello piramidale si basa da un lato sul concetto di rischio-beneficio e dall’altro sul presupposto che la prognosi dell’AR sia generalmente favorevole. La precedente piramide terapeutica è stata modificata in modo che la terapia con farmaci antireumatici modificanti la malattia (DMARD) e biologici inizi molto prima.
Le ragioni sono molteplici: innanzitutto, l’artrite reumatoide non è una malattia benigna. Inoltre, i farmaci antinfiammatori non steroidei (FANS) non sono innocui, la loro tossicità gastrointestinale e altri effetti collaterali causano una notevole morbilità e mortalità. È anche importante considerare che le terapie di base non sono più tossiche dei FANS in mani esperte. Infine, ma non meno importante, con l’uso precoce di farmaci biologici, le forme aggressive di artrite reumatoide possono essere affrontate in una fase iniziale, la malattia può essere influenzata in modo significativo e, in alcuni casi, addirittura messa in remissione.
Terapeutici di base modificanti la malattia (DMARD)
I farmaci antireumatici modificanti la malattia (DMARD)(Tabella 1) sono utilizzati per la poliartrite attiva dal punto di vista clinico e umorale, molto prima che si verifichino cambiamenti biologici. Questo è particolarmente vero quando la diagnosi di artrite reumatoide viene confermata. Attualmente, il metotrexato è l’agente terapeutico di base di prima scelta, che ha sostituito completamente l’oro, che in passato era l’agente primario. In mani esperte, il metotrexato non è più tossico dei FANS o dei corticosteroidi. Un altro vantaggio di questo farmaco è la sua gamma di somministrazione (per os, i.v., i.m., s.c., come siringa preriempita per l’autoiniezione).
I prodotti biologici attuali
Una panoramica dei prodotti biologici si trova in Tabella 2.
Inibitori del TNF-α (Fig. 2, 3): Nel 1998, è stato registrato come farmaco il primo antagonista del fattore di necrosi tumorale-α (inibitore del TNF-α). Attualmente sono disponibili i principi attivi Etanercept (Enbrel®), Infliximab (Remicade®), Adalimumab (Humira®) e, dal 2010, Golimumab (Simponi®) e Certolizumab (Cimzia®). Si differenziano da un lato per la durata d’azione e dall’altro per la modalità di applicazione (settimanale s.c., bisettimanale s.c., quadrisettimanale s.c. e da 2 a 3 mesi i.v. come infusione).
Gli inibitori del TNF-α riducono il gonfiore e il dolore articolare fino al >50% e riducono i parametri infiammatori. Si ritiene inoltre che questi agenti inibiscano, ma non prevengano completamente, la progressione delle alterazioni radiologiche. Gli inibitori del TNF-α funzionano particolarmente bene in combinazione con il metotrexato. Vengono utilizzati dopo una risposta insufficiente (3-6 mesi) o dopo gli effetti collaterali della terapia DMARD. La prescrizione deve essere approvata dal medico di fiducia della cassa malattia.
Le controindicazioni sono rappresentate da infezioni floride o latenti (HIV, epatite, tubercolosi), nonché da tumori maligni o da una recente terapia contro i tumori. Prima di iniziare una terapia, è quindi importante cercare, o meglio trovare, il trattamento giusto. è necessario escludere le infezioni latenti. Il nuovo inibitore del TNF-α certolizumab (Cimzia®) può essere utilizzato anche in gravidanza.
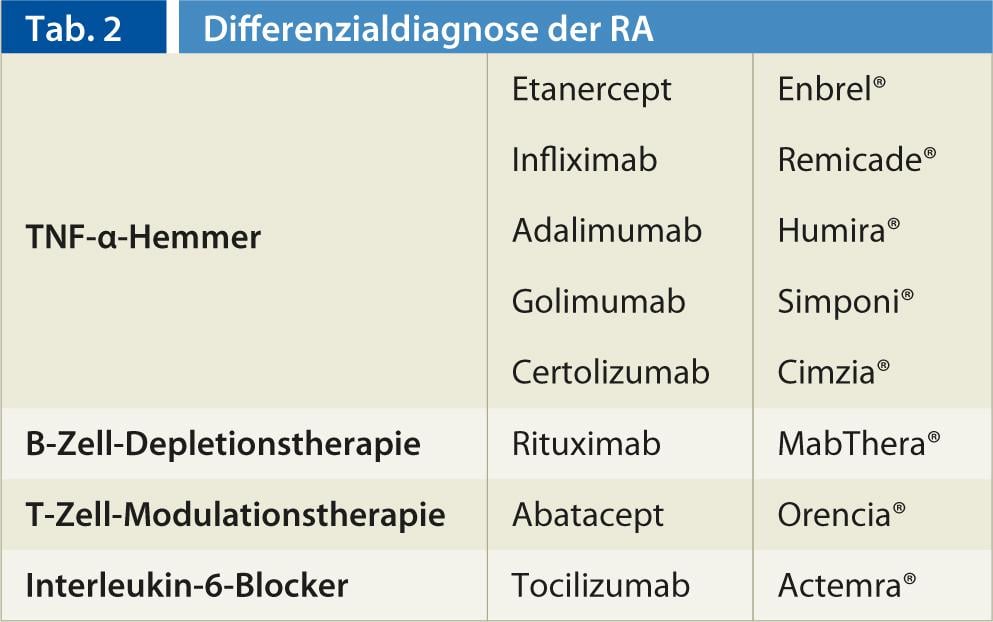
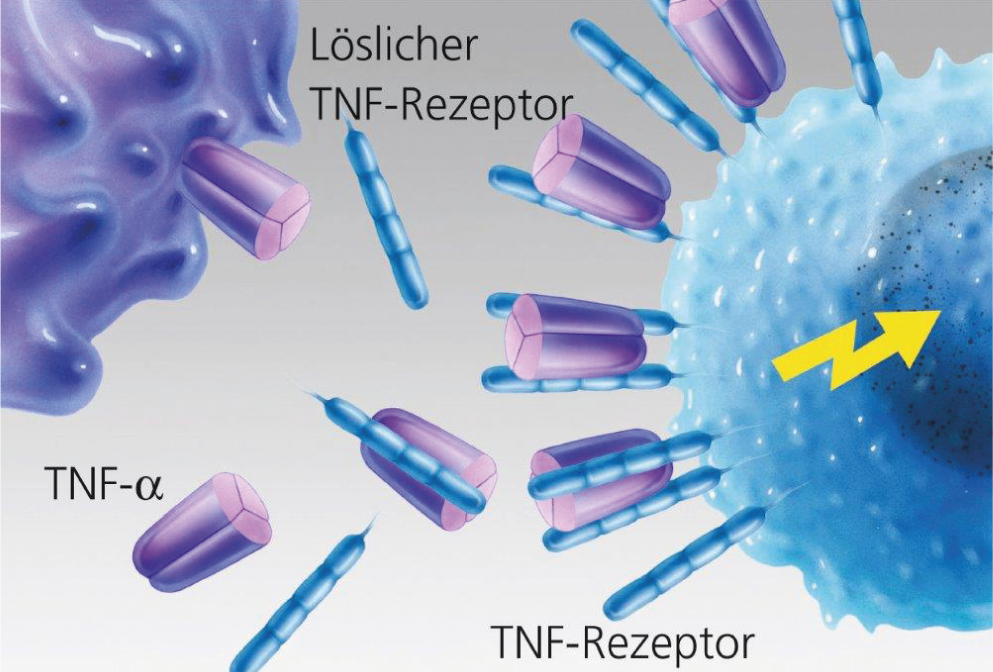
Fig. 2: legame non ostacolato del TNF-α alla cellula bersaglio.
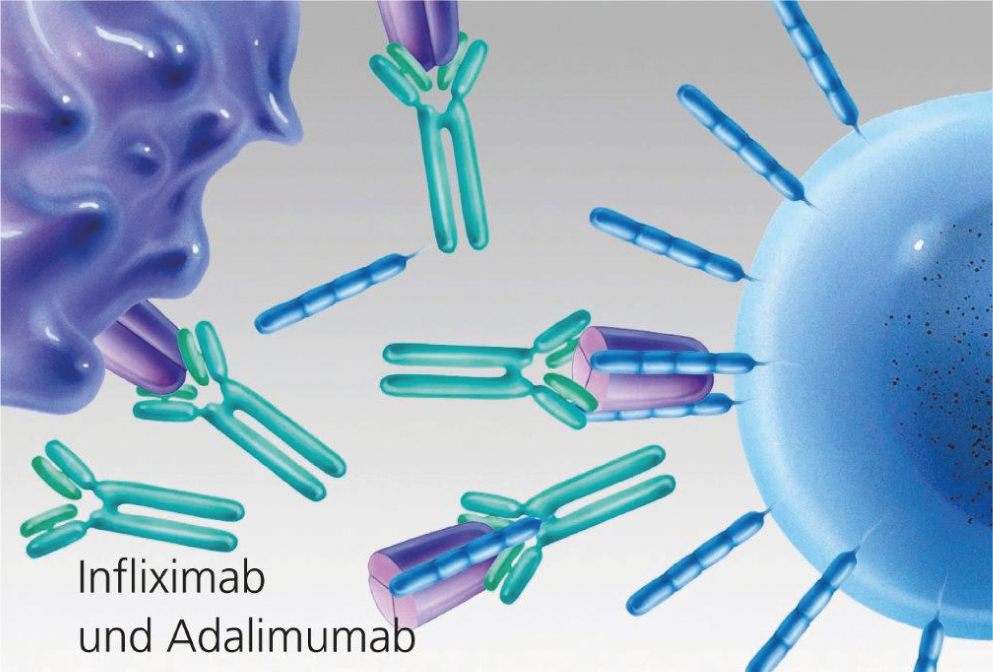
Fig. 3: blocco del TNF mediante anticorpi monoclonali (infliximab e adalimumab).
Terapia di deplezione delle cellule B: l’introduzione dell’anticorpo monoclonale anti-cellule B altamente specifico rituximab (MabThera®) nella terapia reumatoide nel 2006 ha portato una nuova prospettiva alla gamma biologica. Il rituximab è un anticorpo monoclonale chimerico topo-umano che si lega specificamente all’antigene transmembrana CD20, che si trova in gran numero sulla superficie delle cellule B. Il rituximab viene utilizzato per il trattamento del linfoma non-Hodgkin dal 1997. Il vantaggio del rituximab rispetto alla terapia con TNF-α è che non si verifica un aumento delle infezioni opportunistiche o di altro tipo. Il rituximab viene somministrato in infusione (2 infusioni a intervalli di 14 giorni) e il trattamento può essere ripetuto a intervalli di 6-12 mesi. Tuttavia, l’effetto massimo si manifesta solo dopo alcune settimane o mesi.
Terapia di modulazione cellulare: un’altra terapia biologica è disponibile sotto forma del modulatore delle cellule T Abatacept (Orencia®). Abatacept è una proteina di fusione completamente umana che lega le molecole co-modulanti CD-80 e CD-86 alle cellule T in modo che non possano più essere attivate. Per questo motivo, viene definito un bloccante della co-stimolazione delle cellule T. Abatacept è stato approvato in Svizzera come trattamento infusionale mensile dall’agosto 2007 e dall’aprile 2012 anche come forma di somministrazione sottocutanea (siringa pre-riempita settimanale). Si sospetta un rallentamento dell’attività della malattia e della progressione radiologica. In generale, abatacept sembra avere un profilo di effetti collaterali favorevole, le reazioni all’infusione e le infezioni opportunistiche si verificano raramente e non è possibile fare una dichiarazione chiara sul rischio di malignità sulla base dei dati attuali. Un piccolo svantaggio è forse che l’effetto si verifica solo con una certa latenza (3-6 mesi), ma poi dura per un tempo molto lungo e difficilmente o per nulla diminuisce nel corso successivo.
Bloccanti dell’interleuchina-6: l’ interleuchina-6 (IL-6) è una citochina chiave nel processo infiammatorio ed è specificamente presente nei tessuti della sinovite reumatoide in parallelo all’attività infiammatoria. L’anticorpo monoclonale tocilizumab (Actemra®) si lega ai recettori IL-6 solubili e di membrana e inattiva l’IL-6, in modo che non possa più esercitare un effetto pro-infiammatorio sulla cellula. Il tocilizumab è approvato in Svizzera dal 2009. Il tocilizumab viene somministrato in infusioni mensili. Un grande vantaggio è l’inizio dell’azione molto rapido e convincente.
L’esperienza con i biologici finora
Dal 1998, sempre più pazienti affetti da artrite in Europa e anche in Svizzera sono stati trattati con i nuovi biologici, soprattutto con gli inibitori del TNF-α, che vengono utilizzati sempre più precocemente nel trattamento dell’AR. La supervisione di questi farmaci da parte di specialisti esperti è necessaria per riconoscere e trattare gli effetti collaterali in tempo. Le infezioni gravi e incontrollabili sono ancora gli effetti collaterali più temuti di questo gruppo di farmaci. Gli effetti collaterali lievi includono dolore e bruciore nel sito di iniezione, aumento della sudorazione, fluttuazioni della pressione sanguigna.
Negli ultimi anni, è stata osservata la formazione di anticorpi in singoli casi di terapia con inibitori del TNF-α , che portano a una diminuzione o a una perdita di efficacia, per cui è necessario passare a un altro biologico. Nelle terapie infusionali, soprattutto con gli anticorpi monoclonali, molto raramente possono verificarsi reazioni allergiche più gravi fino all’anafilassi. Attualmente, queste terapie infusionali vengono eseguite sotto stretta sorveglianza e da personale adeguatamente formato. Nella nostra popolazione di pazienti, nessuna di queste terapie ha dovuto essere interrotta a causa di gravi effetti collaterali.
Prospettiva
Per tutti i biologici, sono necessari ulteriori studi sugli effetti collaterali, l’efficacia e la tollerabilità, soprattutto per la somministrazione a lungo termine. In considerazione della natura eterogenea delle malattie reumatiche infiammatorie, in futuro dovrebbe essere possibile definire ancora meglio quali pazienti beneficiano maggiormente di quale agente attivo; non esistono ancora linee guida effettive in merito. I preparati esistenti vengono continuamente integrati o sostituiti da nuove generazioni di anticorpi monoclonali e si continua a lavorare per semplificare il metodo di applicazione.
CONCLUSIONE PER LA PRATICA
- L’infiammazione articolare è reversibile, il danno articolare secondario no.
- Quanto più precocemente viene diagnosticata l’AR e quanto più efficacemente viene trattata la malattia, tanto più è possibile evitare danni permanenti alle articolazioni e rallentare e possibilmente prevenire la progressione radiografica.
- Nell’attuale terapia dell’AR, il concetto di trattamento convenzionale (piramide di trattamento) è adattato alla rispettiva attività della malattia.
- Con i biologici, è nata una nuova era nel trattamento delle malattie reumatiche infiammatorie. La remissione è diventata un obiettivo terapeutico realistico.
Letteratura:
- Bartelds GM, et al: Dtsch Med Wochenschrift 2011; 136: 1410.
- Ernst J: Acta Rheumatol 2005; 30: 119-124.
- Forster A: Ars Medici 1/2009.
- Kyburz D: Rheuma Schweiz, numero 4, luglio 2011.
- Visser K, et al: Ann Rheum Dis 2010; 69: 1333-1337.
- Grigor C, et al: Lancet 2004; 364: 263-269.
- Goekoop-Ruiterman YP, et al: Ann Intern Med 2007; 146: 406-415.
- Goekoop-Ruiterman YP, et al: Ann Rheum Dis 2007; 6: 1227-1232.
- Quinn MA, et al: Arthritis Rheum 2005; 52: 27-35.
- Smolen JS, et al: Arthritis Rheum 2006; 54: 702-710.











