L’ipertensione polmonare è di solito un segno di uno stadio più avanzato della cardiopatia sinistra (PH-LHD). La caratteristica centrale della PH-LHD è un’elevata pressione di cuneo arterioso polmonare di >15 mmHg. In casi altamente selezionati, la terapia approvata per l’ipertensione arteriosa polmonare, cioè gli inibitori della fosfodiesterasi 5 (PDE5i), potrebbe essere indicata come ponte verso il trapianto di cuore e dopo il dispositivo di assistenza ventricolare sinistra in caso di grave compromissione della funzione ventricolare destra. Nei casi di rigurgito mitralico da moderato a grave, le opzioni di trattamento (riparazione della valvola chirurgica o transcatetere) devono essere valutate in un team cardiaco che comprende cardiologi, cardiochirurghi e specialisti di imaging.
L’ipertensione polmonare (PH) può essere il risultato di tutte le cause della cardiopatia sinistra (LHD) e di solito è un segno di uno stadio più avanzato della LHD. (tabella 1). È stato dimostrato che i sintomi progressivi dell’insufficienza cardiaca con intolleranza all’esercizio fisico dovuti alla PH-LHD determinano un esito peggiore a seconda di quanto precocemente ed efficacemente la LHD possa essere trattata [1].

Definizione di PH-LHD
La PH è generalmente definita per tutti i gruppi clinici come uno stato emodinamico e fisiopatologico con un aumento della pressione arteriosa polmonare media a riposo (PAPm) di ≥25 mmHg, valutata mediante cateterismo cardiaco destro. La caratteristica centrale della PH-LHD è un’elevata pressione di cuneo arterioso polmonare (PAWP) di >15 mmHg a causa dell’aumento delle pressioni di riempimento dell’atrio sinistro e della PH post-capillare.
Le linee guida della Società Europea di Cardiologia e della Società Europea di Respirazione (ESC/ERS) del 2009 per la diagnosi e il trattamento della PH definiscono le caratteristiche emodinamiche della PH-LHD in base al gradiente transpolmonare (TPG), la differenza tra PAPm e PAWP [1,2]. La PH-LHD post-capillare è definita passiva (TPG ≤12 mmHg) o reattiva (fuori proporzione, TPG >12 mmHg). Nel 10-15% dei casi l’emodinamica indica una combinazione di PH pre e post-capillare [1]. Tuttavia, prendere in considerazione solo il TPG può portare a una classificazione errata della PH-LHD, influenzando l’approccio terapeutico della LHD.
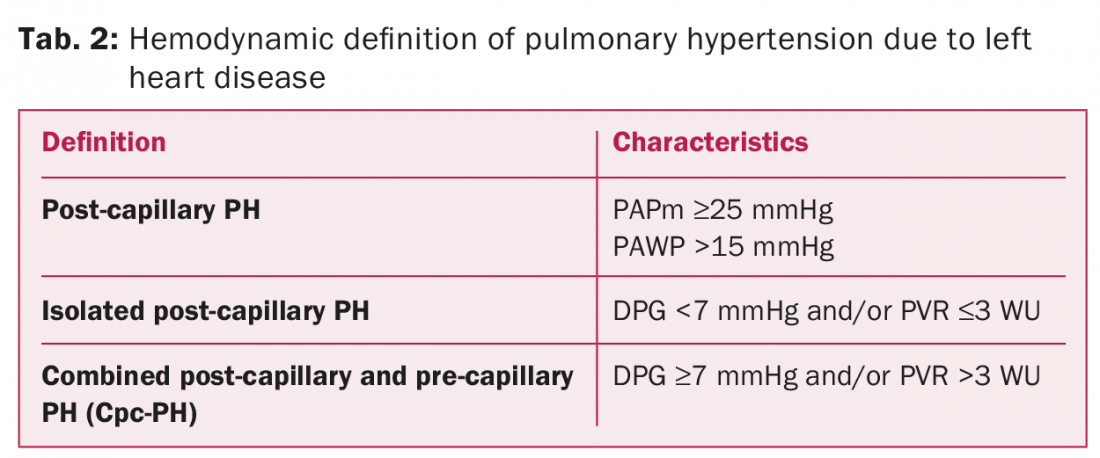
Le linee guida sulla PH del 2015 dell’ESC/ESR definiscono tre diversi stati emodinamici nell’interpretazione della PH-LHD (tabella 2) [3]. I principali cambiamenti nelle caratteristiche della PH sono la valutazione del gradiente di pressione diastolica (DPG), la differenza tra PAPd e PAWP invece di TPG, e/o la resistenza vascolare periferica per differenziare una PH post-capillare isolata (Ipc-PH) da una PH combinata post-capillare e pre-capillare (Cpc-PH) (tabella 2).
I pazienti che hanno una resistenza vascolare polmonare (PVR) superiore a cinque unità di legno (5 WU×80 = 400 dyn×sec×m2×cm-5) o indice PVR >6 WU hanno un rischio maggiore di insufficienza ventricolare destra post-operatoria dopo il trapianto di cuore [4]. Pertanto, per smascherare l’ipertensione arteriosa polmonare (PAH) irreversibilmente “fissa”, sono necessarie “sfide vasodilatatrici” farmacologiche direttamente rivolte alla vascolarizzazione arteriosa polmonare, come la prostaciclina, oppure, in caso di risposta inadeguata, cioè in caso di PAWP molto elevata, la riduzione del postcarico sul cuore sinistro con nitroprussiana o nitroglicerina.
I pazienti con resistenza vascolare periferica fissa ed elevata possono avere una malattia polmonare concomitante, un’apnea ostruttiva del sonno o una malattia tromboembolica polmonare cronica che devono essere considerate nella diagnosi differenziale ed escluse.
Trattamento medico
Esiste un’evidenza consolidata e crescente per quanto riguarda il trattamento medico della PAH, mentre mancano dati sulla PH-LHD. Tuttavia, i farmaci di provata efficacia nella PAH vengono sempre più utilizzati per altre forme di PH, compresa la PH-LHD, cioè gli inibitori della fosfodiesterasi 5 (PDE5i).
Si ritiene che gli effetti benefici della PDE5i nella PAH derivino da effetti vasodilatatori e antiproliferativi relativamente selettivi sulla vascolarizzazione polmonare e sull’emodinamica nell’insufficienza cardiaca [5]. La PH rappresenta il principale meccanismo fisiopatologico dell’insufficienza ventricolare destra [4]. Piccoli studi su pazienti con insufficienza cardiaca hanno dimostrato il maggior beneficio della PDE5is nei pazienti con PH-LHD e insufficienza ventricolare destra [5]. Si pensa che questo sia il risultato dell’effetto diretto della PDE5i sulla contrattilità miocardica del ventricolo destro, dove è stato dimostrato che l’espressione della PDE5 è regolata in alto nei ventricoli destri compromessi [6]. L’inibizione della PDE5 può quindi avere un ruolo nel miglioramento della funzione ventricolare destra nell’insufficienza cardiaca e può essere clinicamente giustificata in alcuni pazienti accuratamente selezionati, come ponte verso il trapianto di cuore o dopo il supporto di un dispositivo di assistenza ventricolare sinistra. Questo sarà discusso nel primo rapporto di caso.
Caso 1: Un giovane paziente con cardiomiopatia dilatativa
Paziente di 46 anni con cardiomiopatia dilatativa nota dal 2000 e frazione di eiezione ventricolare sinistra (LVEF) del 20%, dimensioni e funzione del ventricolo destro normali, leggero rigurgito mitralico e assenza di PH nel cateterismo del cuore destro (fig. 1).
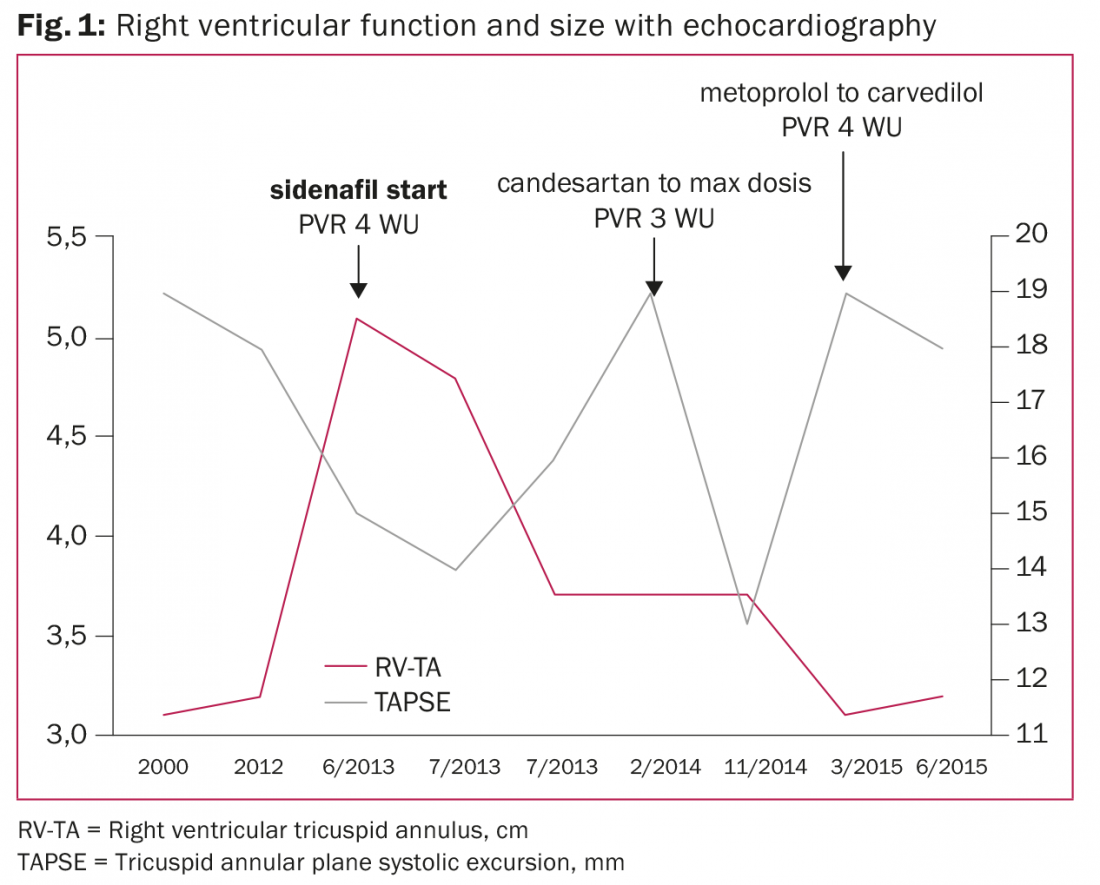
Nel 2012, è stata impiantata una terapia di risincronizzazione cardiaca con defibrillatore a causa di una sincope e di un nuovo blocco di branca sinistra. Nel 2013, il paziente è stato indirizzato al team di insufficienza cardiaca per una valutazione a causa di uno scompenso cardiaco biventricolare acuto, un ventricolo destro dilatato e una funzione ventricolare destra compromessa. Il TPG era di 12 mmHg ma il DPG era di -1 mmHg, indicando una PH post-capillare isolata e un PVR di 4,4 WU (352 dyn×sec×m2×cm-5) dopo il test di vasodilatazione con ilomedina. Non è stato eseguito alcun test farmacologico di vasodilatazione sistemica (ad esempio, nitroprussid o nitroglicerina) per escludere la Cpc-PH o la PAH irreversibile. Quindi, a causa della PH con insufficienza ventricolare destra, è stata iniziata la terapia con sildenafil. È stato avviato un work-up per il trapianto di cuore.
Le cateterizzazioni seriali del cuore destro sono state eseguite secondo le linee guida del 2006 della Società Internazionale per il Trapianto di Cuore e Polmone per determinare l’idoneità al trapianto di cuore, al fine di evitare il rischio elevato di insufficienza ventricolare destra e di mortalità dopo il trapianto di cuore [7]. L’aumento della PVR è stato notato nel 2014 (5,7 WU fino a 2,8 WU dopo il test di vasodilatazione sistemica) e nel 2015 (4,3 WU) e successivamente la PVR è diminuita a 1,3 WU (104 dyn×sec×m2×cm-5) dopo la continua ottimizzazione della terapia dell’insufficienza cardiaca.
Subito dopo l’inizio del sildenafil, le dimensioni del ventricolo destro si sono normalizzate e la funzione ventricolare destra è migliorata nel corso dei due anni, nonostante la progressione intermittente della PH. Il paziente è clinicamente stabile in classe NYHA III con un moderato rigurgito mitralico e in lista d’attesa per un trapianto di cuore.
Opzioni terapeutiche: Dirette alla patologia di base
Se la terapia medica e con il dispositivo non riesce a ridurre il PVR <3-5 WU, e il paziente rimane in classe NYHA III-IV, si può prendere in considerazione un dispositivo di assistenza ventricolare sinistra con una funzione ventricolare destra accettabile [7,8]. Secondo le linee guida 2013 sul supporto circolatorio meccanico (MCS), il PDE5i può essere preso in considerazione per la gestione della disfunzione ventricolare destra nel contesto della PH dopo MCS (Livello di evidenza IIb, C) [8]. Le opzioni terapeutiche della PH-LHD devono essere indirizzate alla patologia di base della LHD. Si sono accumulate nuove prove, le tecniche diagnostiche e le opzioni terapeutiche sono cambiate grazie all’ulteriore sviluppo della riparazione chirurgica della valvola e all’introduzione di tecniche interventistiche percutanee, principalmente l’impianto transcatetere della valvola aortica (TAVI) e la riparazione percutanea della valvola edge-to-edge. Questi cambiamenti sono principalmente legati alla stenosi aortica e al rigurgito mitralico.
Caso 2: Una donna di 44 anni con cardiomiopatia dilatativa
La paziente di 44 anni presenta una cardiomiopatia dilatativa (dopo abuso di alcol) dal 2010, LVEF 30%, dimensioni del ventricolo destro normali e funzione ventricolare destra moderatamente compromessa. PH nel cateterismo del cuore destro (PAPm 33 mmHg) con PH post-capillare isolata (DPG 4 mmHg). Il rigurgito mitralico era grave (area effettiva dell’orifizio di rigurgito 54 mm2 [reference ≥40], volume di rigurgito 66,1 ml/battito [reference ≥60], inversione del flusso venoso polmonare) con allargamento del diametro diastolico finale del ventricolo sinistro (61 mm) e dell’atrio sinistro (47 mm).
La valvola era morfologicamente intatta, quindi soddisfaceva i criteri ecocardiografici di un rigurgito mitralico funzionale [9]. È stata avviata una terapia per l’insufficienza cardiaca ed è stato impiantato un cardioverter-defibrillatore impiantabile (ICD). Il rigurgito mitralico è migliorato a un grado moderato.
Alla fine del 2011, il paziente è stato indirizzato al team di insufficienza cardiaca per un’ulteriore valutazione a causa di un edema polmonare acuto e di ripetuti shock dell’ICD dovuti a tachicardia ventricolare non sostenuta. Il rigurgito mitralico era grave. La terapia farmacologica raggiunta era submassimale a causa dell’ipotensione; il paziente ha ricevuto istruzioni per interrompere il consumo di alcol e attenersi a una rigorosa gestione dell’assunzione di volume/sale. Come mostrato nella figura 2, nel corso dell’anno successivo, il 2012, il paziente è stato ricoverato quattro volte a causa di uno scompenso LH, ottenendo una stabilizzazione tra l’uno e l’altro, ma con il persistere di un grave rigurgito mitralico. A causa della scarsa compliance, il trapianto di cuore o la terapia con dispositivo di assistenza ventricolare sinistra erano relativamente controindicati.
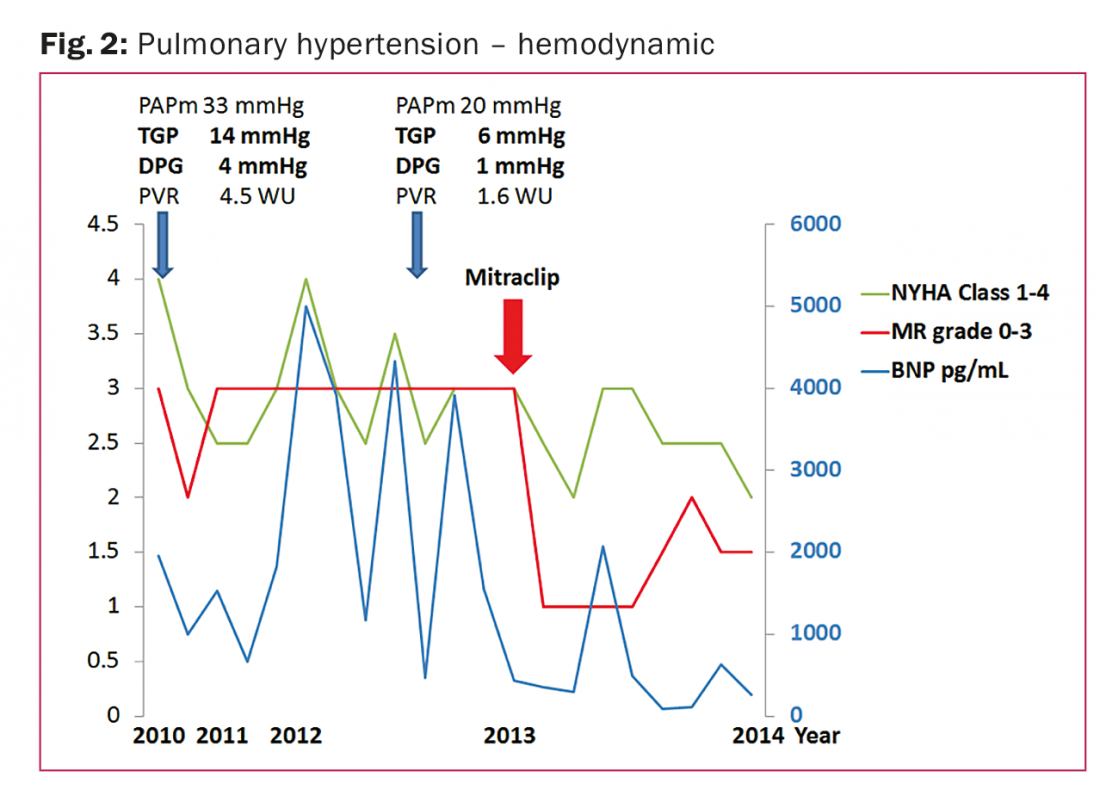
Nel 2013 è stata eseguita con successo una riparazione percutanea edge-to-edge utilizzando la Mitraclip, riducendo immediatamente il rigurgito mitralico a un grado leggero. Nell’anno successivo, non si sono verificati altri ricoveri per scompenso di LH. Il paziente è clinicamente stabile in classe NYHA II, con bassi livelli di BNP e leggero rigurgito mitralico.
Gestione del rigurgito mitralico
L’ecocardiografia è l’esame principale per la valutazione del rigurgito mitralico e deve includere un’attenta valutazione dell’anatomia della valvola, della gravità del rigurgito mitralico, dei suoi meccanismi (cioè rigurgito mitralico funzionale o degenerativo) e affrontare la questione della riparabilità della valvola. Le conseguenze del rigurgito mitralico vengono valutate misurando il diametro dell’atrio sinistro, il diametro del ventricolo sinistro, la LVEF e la pressione arteriosa polmonare sistolica. Le attuali linee guida ESC per la diagnosi e la terapia dell’insufficienza cardiaca cronica sottolineano l’importanza di rivalutare il rigurgito mitralico prima di tutto dopo alcuni mesi di terapia farmacologica stabile e massimamente tollerata [10]. La rivalutazione deve sempre essere eseguita in uno stato di compensazione cardiaca (stato di volume ottimale) del paziente.
Se il rigurgito mitralico è ancora da moderato a grave, in particolare nella gestione dei pazienti ad alto rischio, le opzioni di trattamento (riparazione chirurgica o transcatetere della valvola) devono essere valutate in un team cardiaco che comprende cardiologi, cardiochirurghi e specialisti di imaging [9]. La valutazione deve includere la stratificazione del rischio in base ai sintomi (legati alla malattia valvolare), alla fibrillazione atriale concomitante, all’età, alle co-morbilità rilevanti, alla funzione ventricolare sinistra, alla PH, alla necessità di un intervento chirurgico concomitante (ad esempio la rivascolarizzazione) e all’idoneità della riparazione valvolare, che sono i predittori più importanti dell’esito post-operatorio [10]. La mortalità operatoria può essere stimata da vari sistemi di punteggio, come STS o EuroSCORE II, che includono in particolare indici volti a valutare le capacità funzionali e cognitive e la fragilità negli anziani. La decisione finale sull’opzione terapeutica ottimale deve essere presa con il paziente e la famiglia.
Terapia con mitraclip
La terapia con mitraclip è stata utilizzata con successo per trattare il rigurgito mitralico funzionale o degenerativo. La Mitraclip è stata valutata nello studio multicentrico randomizzato e controllato EVEREST, che ha arruolato solo pazienti operabili [11]. La maggior parte dei pazienti inclusi in EVEREST aveva una forma degenerativa, ma ogni quarto paziente aveva un rigurgito mitralico funzionale. In questo contesto, sono importanti i risultati di ACCESS-EU, uno studio prospettico, multicentrico e non randomizzato in Europa, che include principalmente pazienti ad alto rischio chirurgico (NYHA III-IV e LVEF ≤40% nell’85%; EuroSCORE: 23±18,3), soprattutto a causa di un’eziologia funzionale (n=393/510) [12]. Il tasso di mortalità a 30 giorni è stato del 3,4% e il tasso di ictus dello 0,7%, senza casi di decessi intra-procedurali o di embolizzazione della clip.
Sommario
In sintesi, la PH è un segno importante di LHD avanzata con esito peggiore. L’approccio terapeutico principale deve essere diretto all’origine della LHD, dopo un’attenta valutazione. In casi altamente selezionati, la terapia approvata per la PAH, cioè la PDE5i, potrebbe essere indicata come ponte verso il trapianto di cuore e dopo il dispositivo di assistenza ventricolare sinistra in caso di grave compromissione della funzione ventricolare destra. Poiché mancano ancora prove di efficacia da studi su larga scala e a lungo termine controllati con placebo, l’uso di farmaci per la PAH per altre forme di PH al di fuori di centri esperti è sconsigliato.
Elenco di riferimento:
- Vachiery JL, et al…: Ipertensione polmonare dovuta a malattie del cuore sinistro. J Am Coll Cardiol 2013; 62(25 Suppl): D100-108.
- Galie N, et al: Linee guida per la diagnosi e il trattamento dell’ipertensione polmonare. La Task Force per la diagnosi e il trattamento dell’ipertensione polmonare della Società Europea di Cardiologia (ESC) e della Società Europea di Respirazione (ERS). Eur Heart J 2009; 30(20): 2493-2537.
- Galie N, et al.: Linee guida ESC/ERS 2015 per la diagnosi e il trattamento dell’ipertensione polmonare. La Task Force congiunta per la diagnosi e il trattamento dell’ipertensione polmonare della Società Europea di Cardiologia (ESC) e della Società Europea di Respirazione (ERS). Eur Heart J 2016; 37(1): 67-119.
- Ghio S, et al: Valore prognostico indipendente e additivo della funzione sistolica del ventricolo destro e della pressione dell’arteria polmonare nei pazienti con insufficienza cardiaca cronica. J Am Coll Cardiol 2001; 37(1): 183-188.
- Lewis GD, et al: Il sildenafil migliora la capacità di esercizio e la qualità di vita nei pazienti con insufficienza cardiaca sistolica e ipertensione polmonare secondaria. Circolazione 2007; 116(14): 1555-1562.
- Shan X, et al: Espressione differenziale della PDE5 nel miocardio umano in crisi e non in crisi. Circ Heart Fail 2012; 5(1): 79-86.
- Mehra MR, et al: Criteri di selezione per il trapianto di cuore: Linee guida della Società Internazionale per il Trapianto di Cuore e Polmone per la cura dei candidati al trapianto cardiaco–2006. J Heart Lung Transplant 2006; 25(9): 1024-1042.
- Feldman D, et al: Linee guida 2013 della Società Internazionale per il Trapianto di Cuore e Polmone per il supporto circolatorio meccanico. Sintesi. J Heart Lung Transplant 2013; 32(2): 157-187.
- Vahanian A, et al: Linee guida sulla gestione della cardiopatia valvolare (versione 2012). La Task Force congiunta sulla gestione della cardiopatia valvolare della Società Europea di Cardiologia (ESC) e dell’Associazione Europea di Chirurgia Cardio-Toracica (EACTS). Eur J Cardiothorac Surg 2012; 42(4): S1-44.
- McMurray JJ, et al…: Linee guida ESC per la diagnosi e il trattamento dell’insufficienza cardiaca acuta e cronica 2012. La Task Force per la diagnosi e il trattamento dello scompenso cardiaco acuto e cronico 2012 della Società Europea di Cardiologia. Eur J Heart Fail 2012; 14(8): 803-869.
- Feldman T, et al: Riparazione percutanea della mitrale con il sistema MitraClip. Sicurezza e durata a medio termine nella coorte iniziale di EVEREST (Endovascular Valve Edge-to-Edge REpair Study). J Am Coll Cardiol 2009; 54(8): 686-694.
- Maisano F, et al: Interventi percutanei della valvola mitrale nel mondo reale. Risultati precoci e a 1 anno di ACCESS-EU, uno studio prospettico, multicentrico e non randomizzato post-approvazione della terapia MitraClip in Europa. J Am Coll Cardiol 2013; 62(12): 1052-1061.
CARDIOVASC 2016; 15(2): 11-15