L’eziologia dell’IBS è multifattoriale. La modifica dello stile di vita è una componente importante della terapia di base. La scelta del metodo terapeutico deve essere fatta insieme al paziente. La psicoterapia deve essere offerta per i corsi gravi e le comorbidità psicologiche.
La sindrome dell’intestino irritabile è sintomatica in molti modi, con dolore addominale, irregolarità delle feci e flatulenza come sintomi principali [1,2]. I sintomi causano una restrizione soggettivamente molto sentita della qualità della vita e della quotidianità delle persone colpite, senza spiegare sufficientemente i correlati somatici (biochimici e/o strutturali) [3].
Definizioni
A livello nazionale e internazionale, possono essere applicate diverse definizioni di IBS. A livello globale, i criteri più comunemente utilizzati sono i criteri di Roma IV (2017) [4]. In Germania, la definizione è conforme alla linea guida S3 (attualmente in fase di revisione) [1]. Secondo questa linea guida, sono caratteristici i disturbi legati all’intestino, escluse le malattie organiche, che esistono da almeno tre mesi e che riducono la qualità di vita del paziente [1]. La sindrome dell’intestino irritabile post-infettiva è una forma speciale, probabilmente causata da cambiamenti nel microbioma, nell’asse intestino-cervello e nella risposta immunitaria [5]. I criteri di Roma IV si dividono in quattro sottotipi (classificazione con la Bristol Stool Form Scale [BSFS]) [4,6]:
- RDS-D (diarrea)
- >Il 25% delle feci è liquido o contiene grumi morbidi (tipo 6 e 7)
- RDS-C (costipazione)
- >25% delle feci globuli solidi o simili a salsicce, grumose (tipo 1 e 2)
- RDS-M (misto)
- >25% di sedie di tipo 1 e 2; >25% di sedie di tipo 6 e 7
- RDS-U (non sottomesso)
- Non è classificabile sulla base del BSFS.
Comorbilità: Le malattie concomitanti giocano un ruolo importante nel contesto dell’IBS. Una meta-analisi ha mostrato che fino al 94% di tutti i pazienti con IBS soffre di comorbidità psicologiche, che hanno un impatto sul decorso della malattia e sulla gravità dei sintomi [7]. I disturbi d’ansia e la depressione sono due comorbilità psicologiche che sono spesso associate all’IBS e, a loro volta, aumentano significativamente il rischio di genesi dell’IBS [8,9].
Aspetti epidemiologici: Gli studi attuali mostrano una prevalenza sempre più elevata di IBS (11,2% in tutto il mondo). Va notato che questa cifra supera le prevalenze totali della malattia infiammatoria intestinale e della celiachia [3,10]. Le donne sono più spesso colpite dalla malattia rispetto agli uomini (2:1) [11]. Data l’alta prevalenza, si può anche ipotizzare l’entità dei costi socio-economici sostenuti. Quindi, solo i costi diretti sono in media 572 EUR per paziente e anno [12].
Fisiopatologia
I fattori eziologici che influenzano l’IBS non sono ancora stati completamente studiati e compresi. Ciò che è certo, tuttavia, è la genesi multifattoriale, per cui il modello biopsicosociale della malattia offre il miglior approccio esplicativo [13]. Secondo questo, i fattori somatici, psicologici e sociali si intrecciano e, in combinazione, causano la sindrome dell’intestino irritabile (Fig. 1).
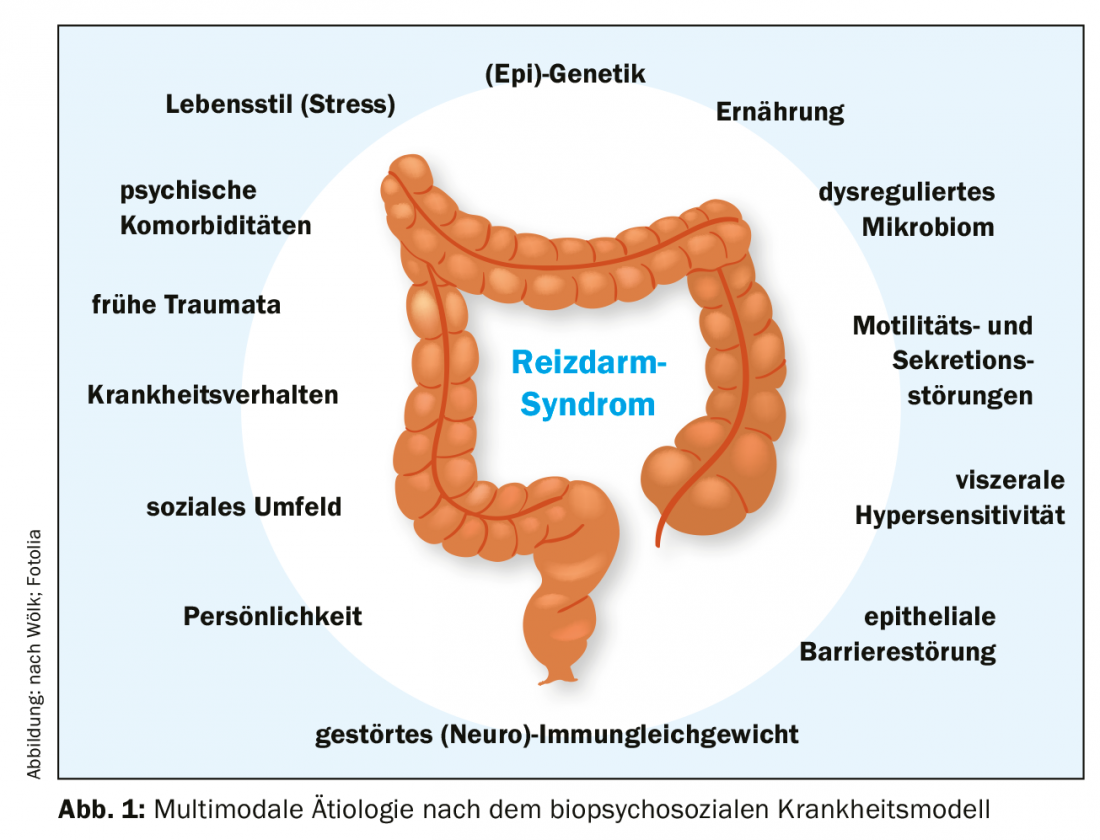
Aspetti biologici: I fattori d’influenza somatici sono attualmente al centro della ricerca. Anche il microbioma deve essere menzionato come un possibile punto di partenza terapeutico importante [14,15]. Nei pazienti si può rilevare una composizione alterata della flora intestinale rispetto ai soggetti sani di controllo [14], anche se i dati in merito non sono ancora uniformi. Il microbioma sembra anche influenzare l’asse intestino-cervello disfunzionale nell’IBS (asse microbioma-intestino-cervello) e spiegherebbe la forma post-infettiva dell’IBS, nonché l’aumento del rischio dopo l’uso di antibiotici [3,5,16].
Altri cambiamenti biologici includono un aumento della sensibilità viscerale [17] e una maggiore permeabilità della barriera epiteliale gastrointestinale [18], spesso associata ad alterazioni dell’equilibrio (neuro)immunitario con aumento delle cellule attive endocrine/paracrine nella mucosa [19]. Infine, ma non meno importante, ci sono gli aspetti genetici da menzionare [3].
Inoltre, la motilità e la secrezione del colon sono alterate e quindi un approccio terapeutico [20]. L’asse intestino-cervello svolge un ruolo importante in questi cambiamenti e molto probabilmente contribuisce anche all’associazione con la malattia mentale [21].
Aspetto psicosociale: le comorbilità psicologiche da un lato contribuiscono allo sviluppo dell’IBS e dall’altro aumentano il rischio di decorso grave e refrattario della malattia [7]. Al contrario, l’IBS è anche un fattore di rischio per i disturbi d’ansia, la depressione e altri disturbi somatoformi [8,9]. L’asse ipotalamo-ipofisi-surrene (asse HPA) svolge un ruolo importante in questo contesto [22,23]. La stimolazione cronica (ad esempio, lo stress prolungato) innesca cascate di segnalazione infiammatoria nel tratto gastrointestinale, che possono contribuire al mantenimento e/o all’esacerbazione dei sintomi. Il comportamento di malattia appreso, lo status socioeconomico e le esperienze traumatiche nella prima infanzia sono altri aspetti importanti che possono contribuire allo sviluppo e alla persistenza della IBS [10,24,25].
Diagnostica
A causa del gran numero di manifestazioni sintomatiche, un algoritmo diagnostico uniforme è di particolare importanza. La linea guida S3 fornisce uno schema chiaro a questo proposito, secondo il quale la diagnosi di esclusione di IBS deve essere assegnata dopo una diagnosi di base definita e l’esclusione individuale delle diagnosi differenziali rilevanti (Fig. 2) [1]. Esistono molte possibili diagnosi differenziali, per cui è necessario procedere in base alla costellazione e al decorso temporale dei sintomi [1].
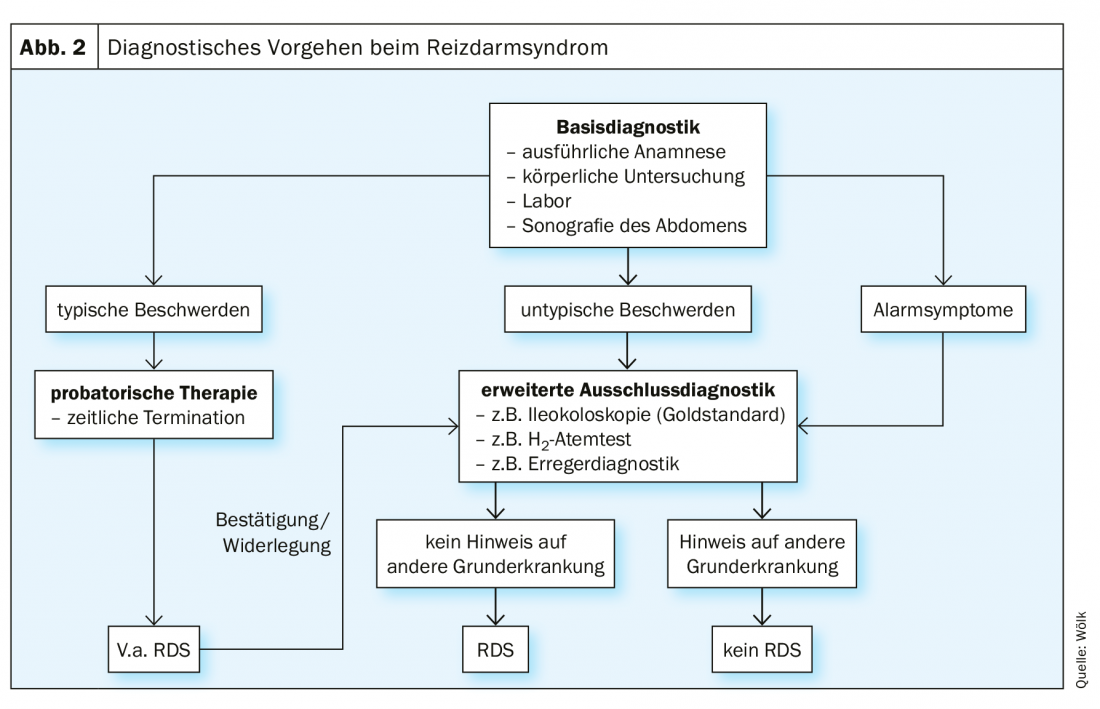
La prima fase della diagnostica di base è l’anamnesi, in cui occorre prestare particolare attenzione ai sintomi di allarme (ad esempio, perdita di peso, sangue nelle feci, ecc.) [1]. Questi forniscono indizi sulle correlazioni dei disturbi a livello somatico, che richiedono un chiarimento adeguato [1]. Seguono un esame fisico, la raccolta di un laboratorio di riferimento e un’ecografia dell’addome [1]. Tuttavia, una diagnosi definitiva può essere fatta solo dopo una diagnosi di esclusione individuale [1]. Questo include un’ileocolonscopia, soprattutto nei casi di diarrea [1]. Se sono presenti i sintomi tipici, si deve fare una diagnosi sospetta di sindrome dell’intestino irritabile e iniziare una terapia di prova [1].
Terapia
La patogenesi multifattoriale sopra descritta apre un’ampia gamma di opzioni terapeutiche, tra cui misure generali, farmacologiche e psicologiche. Tuttavia, questo rende anche difficile formulare raccomandazioni terapeutiche generali. Di particolare importanza nel trattamento dell’IBS è il rapporto di fiducia medico-paziente [1,26]. In questo modo, è possibile individuare la migliore strategia terapeutica, nel senso del processo decisionale condiviso [27]. Un colloquio psicoeducativo iniziale costituisce la base di questo [26]. Gli obiettivi del trattamento possono essere definiti come il sollievo dai sintomi e il miglioramento della qualità di vita, poiché solo il 10% dei pazienti raggiunge la completa libertà dai sintomi [28]. Le opzioni di trattamento sono suddivise in tre categorie.
Modifica dello stile di vita e della dieta
Stile di vita equilibrato: È necessario apportare modifiche individuali allo stile di vita. Le procedure di rilassamento e l’esercizio fisico regolare e moderato (3-5 volte alla settimana) per stimolare la motilità del colon hanno mostrato un effetto positivo sulla gravità dei sintomi in uno studio clinico randomizzato (RCT) [29].
Lo yoga può essere considerato un’efficace tecnica di rilassamento. Incorporare lo yoga nella vita quotidiana è un’opzione che una recente meta-analisi di sei RCT ha trovato per migliorare significativamente i sintomi, i livelli di ansia e la qualità della vita [30].
Inoltre, occorre garantire un sonno sufficiente, poiché i disturbi del sonno sono anche un fenomeno di accompagnamento frequente nella sindrome dell’intestino irritabile [31]. Il consumo di nicotina non è un fattore di rischio basato sull’evidenza, ma dovrebbe essere ridotto al minimo nell’ambito di uno stile di vita generalmente sano [31,32]. L’influenza dello stile di vita sull’asse HPA può influenzare la gravità dell’IBS [22,23].
Misure dietetiche: La dieta è uno dei principali fattori associati all’espressione soggettiva dei sintomi e alla riduzione della qualità di vita, ad esempio attraverso l’evitamento e la paura di determinati alimenti [33,34]. In caso di intolleranze alimentari note, in particolare di malassorbimento dei carboidrati, questi devono essere ridotti di conseguenza nella dieta [35,36]. Una dieta a ridotto contenuto di glutine può essere presa in considerazione perché può portare a un sollievo dai sintomi, soprattutto nei pazienti con livelli elevati di immunoglobuline G (IgG), come dimostrato da una meta-analisi [37,38]. Tuttavia, c’è ancora una notevole necessità di ulteriori ricerche sull’esatto pato-meccanismo. Va notato che i tentativi di terapia devono essere rivalutati al massimo dopo tre mesi [1].
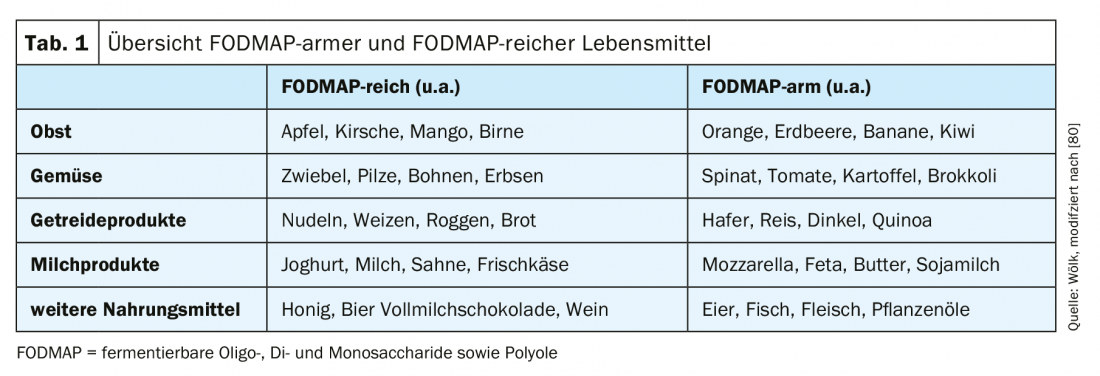
La cosiddetta “dieta a basso contenuto di FODMAP” (“oligo-, di- e monosaccaridi fermentabili e polioli”) è attualmente il fulcro della terapia per l’IBS (Tab. 1) . I FOPMAP vengono scomposti e fermentati nell’intestino dal microbioma. Di conseguenza, vengono prodotti gas e acidi grassi liberi, nonché un maggiore legame con l’acqua, che può portare a un aggravamento dei sintomi attraverso un aumento della secrezione [3,39,40]. Tuttavia, soprattutto con le diete a lungo termine e molto rigide, esiste il rischio di sintomi da carenza [41]. Le meta-analisi mostrano effetti positivi della dieta a basso contenuto di FODMAP, anche se questo è stato spesso valutato in modo acuto e gli studi a lungo termine sono in attesa [42,43]. In una recente meta-analisi con un totale di dodici studi (sei RCT e sei studi di coorte), è stato dimostrato che una riduzione dei FODMAP può ottenere un miglioramento dei sintomi, soprattutto del dolore addominale e del gonfiore [42]. Pertanto, la dieta a basso contenuto di FODMAP può essere una componente terapeutica ragionevole nel trattamento dell’IBS, ma con attenzione all’apporto di sufficienti micronutrienti, vitamine e oligoelementi.
Terapia pre, pro e antibiotica: Allo stato attuale, ci sono ancora poche prove del beneficio terapeutico di una terapia mirata al microbioma [44]. I prebiotici sono definiti come componenti alimentari indigeribili che stimolano la crescita di alcuni ceppi di batteri. I probiotici sono batteri vivi che hanno un’influenza positiva sul microbioma, mentre gli antibiotici mirano al microbioma, riducendo il più possibile le specie produttrici di gas [44].
Per un trattamento efficace dei sintomi a seconda del sottotipo, è essenziale conoscere le necessarie combinazioni di ceppi batterici e sostanze attive, che tuttavia sono attualmente ancora oggetto di ricerca [44]. La metodologia eterogenea dei singoli studi clinici randomizzati su diversi ceppi batterici (anche in combinazione, spesso in concentrazioni molto diverse) rende attualmente difficile una chiara raccomandazione di trattamento [44,45]. Tuttavia, i ceppi Bifidobacterium (B.) infantis e B. animalis ssp. lactis contro la flatulenza, il Lactobacillus casei Shirota anche contro la stitichezza (livello di evidenza B nella linea guida S3) [1]. L’antibiotico rifaximina riduce le specie batteriche che formano gas e può essere utilizzato in via sperimentale nel contesto dei disturbi di flatulenza [44,46].
Farmacoterapia orientata ai sintomi
Se le misure generali non sono sufficientemente efficaci, è necessario effettuare una terapia farmacologica sintomatica mirata ai disturbi del paziente (tab. 2) [1]. Questo varia a seconda del sottotipo.
Dolore: la prima classe di sostanze per il dolore addominale sono gli spasmolitici, come la butilscopolamina [1]. L’effetto anticolinergico del farmaco parasimpatico inibisce la muscolatura liscia e riduce gli spasmi e il dolore [47].
In alternativa o a complemento, si possono provare i fitoterapici, in particolare l’olio di menta piperita o l’olio di cumino, che hanno entrambi dimostrato di ridurre significativamente il dolore in un’ampia meta-analisi del 2008 e anche secondo le analisi attuali [1,48,49]. L’olio di menta piperita in una composizione speciale rilasciata nell’intestino tenue ha mostrato buoni effetti nella sindrome dell’intestino irritabile in un recente studio clinico randomizzato [50]. Se il dolore non è sufficientemente ridotto, c’è l’opzione degli antagonisti 5HT3 (ad esempio, ondansetron), che hanno un effetto antispasmodico e di inibizione della motilità attraverso un’azione antiserotoninergica.
Anche gli antidepressivi (antidepressivi triciclici [TZA] per il sottotipo IBS-D e inibitori selettivi della ricaptazione della serotonina [SSRI] per l’IBS-O) somministrati a basse dosi mostrano buoni effetti [1,3,51,52]. A dosi più elevate, gli antidepressivi sono efficaci anche contro le comorbidità mentali e vengono utilizzati di conseguenza [52].
Diarrea: le irregolarità delle feci, nel senso di una maggiore frequenza e di una consistenza liquida, possono essere trattate con farmaci che prolungano il passaggio del colon e inibiscono la secrezione [3]. Le classi di sostanze adatte sono quindi gli agonisti del recettore oppioide, come l’agonista del recettore μ-opioide loperamide (non mobile sulla barriera emato-encefalica) [1]. Secondo la ricerca attuale, l’eluxadolina può essere più vantaggiosa come agonista dei recettori μ e κ-opioidi e come antagonista dei recettori δ-opioidi, perché agisce anche sul dolore [53]. Tuttavia, la terapia con eluxadoline è molto costosa [54].
Inoltre, gli inibitori del riassorbimento degli acidi biliari (ad esempio, la colestiramina) rappresentano un’opzione terapeutica [1]. È stato dimostrato che il sottotipo RDS-D può essere associato a una maggiore perdita di acidi biliari [55]. La colestiramina riduce l’effetto lassativo degli acidi biliari liberi legandoli [55], motivo per cui i disturbi di una marcata perdita di acidi biliari sono stati alleviati con una percentuale di successo del 96% [55]. Gli spasmolitici, gli antagonisti 5HT3 e i TCA (soprattutto l’amitriptilina) possono essere utilizzati anche per il sottotipo IBS-D [1,51,52].
Costipazione: la costipazione viene trattata con i farmaci aumentando la secrezione e diminuendo il tempo di transito del colon [3]. I farmaci di scelta sono i lassativi di tipo osmotico (ad esempio il macrogol), che liquefanno le feci legando l’acqua e facilitano la defecazione [1,48,54]. Le fibre alimentari idrosolubili, come lo psillio, funzionano secondo lo stesso principio e dovrebbero essere prese in considerazione, garantendo al contempo un’adeguata assunzione di liquidi (da 1,5 a 2 l/d) [1,56].
Per indurre la secrezione nel colon e aumentare la motilità, il lubiprostone attiva i canali del cloruro, fornendo un’alternativa [57]. La prucalopride (agonista 5HT4) e gli SSRI stimolano la motilità del colon come farmaci proserotoninergici e possono essere provati nella stipsi grave refrattaria alla terapia [1,52,58]. I TCA spesso causano stitichezza come effetto collaterale, motivo per cui non dovrebbero essere usati qui [1,52]. Come fitoterapico, l’STW-5 ha un effetto benefico [59].
Flatulenza: I sintomi di flatulenza nel senso di meteorismo, distensione addominale e flatulenza derivano dall’aumento della produzione di gas da parte del microbioma e spesso accompagnano la stitichezza [1,3]. I leganti di gas (ad esempio il simeticone) possono essere un tentativo di terapia, ma spesso hanno un effetto limitato [1]. Soprattutto contro la flatulenza, è stato dimostrato che l’antibiotico rifaximina, che agisce riducendo le specie batteriche della flora intestinale che producono principalmente gas, ha ottenuto buoni effetti [46,60]. Tuttavia, l’effetto era rilevabile solo a breve termine (41% di miglioramento con il trattamento con rifaximina rispetto al 23% nel gruppo placebo) [46,60].
Psicoterapia
La psicoterapia è disponibile come terzo pilastro terapeutico, soprattutto per i casi gravi e refrattari. Questo è raccomandato nelle linee guida, in quanto affronta anche l’eziologia multimodale da parte degli aspetti psicologici e sociali [1]. L’asse intestino-cervello, che è già stato menzionato più volte, è bidirezionale, per cui i disturbi gastrointestinali da un lato hanno un effetto negativo, ad esempio, sull’ansia e sulla depressione (bottom-up); dall’altro lato, i tratti caratteriali, i modelli comportamentali e di pensiero, nonché il comportamento relazionale determinano la percezione e la gravità dei sintomi (top-down) [61]. L’approccio psicoterapeutico ha un impatto particolare sulla qualità di vita dei pazienti [62].
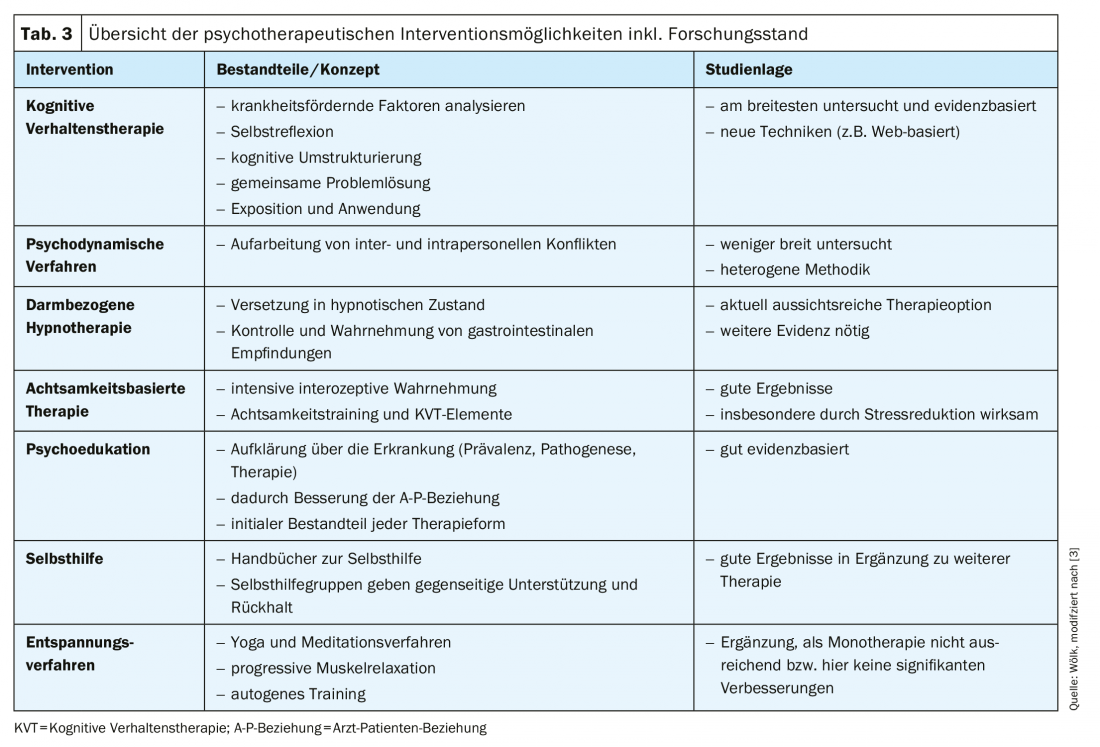
La forma di psicoterapia con le maggiori evidenze è la terapia cognitivo-comportamentale (CBT) [63], con una meta-analisi di 18 studi clinici randomizzati (n=1380) che mostra un numero necessario da trattare (NNT) di tre pazienti per la CBT [3,63]; questo è significativamente migliore rispetto ad esempio agli interventi farmacologici. Inoltre, i metodi psicodinamici, l’ipnoterapia legata all’intestino, la terapia basata sulla mindfulness e altri metodi (psicoeducazione, metodi di auto-aiuto e di rilassamento) rappresentano punti di partenza psicoterapeutici e sono presentati di seguito (Tab. 3) [3].
Terapia cognitivo-comportamentale: una base importante del successo della CBT è il rapporto di fiducia e di apertura tra il terapeuta e il paziente [64]. Già nel 1995, uno studio prospettico ha dimostrato che una relazione positiva tra medico e paziente riduce la necessità di consultazioni di follow-up [64].
Il terapeuta lavora in modo psicoeducativo informando prima il paziente sullo sfondo e sui collegamenti del quadro clinico [65]. Aiuta a riflettere sul proprio comportamento e sul proprio pensiero che aggrava i sintomi e, successivamente, a ristrutturarlo cognitivamente [65]. In seguito, la terapia prevede la ricerca congiunta di strategie risolutive e la loro applicazione attraverso l’esposizione a situazioni che provocano stress [65]. Questa procedura ha portato a un aumento significativo della qualità della vita (d=0,49) [66–68]. Tuttavia, non è stato riscontrato alcun vantaggio rispetto ad altre procedure psicoterapeutiche [3]. La disponibilità limitata di TC nell’assistenza primaria crea la necessità di ulteriori indagini, ad esempio, sui servizi di TC basati sul web [69].
Metodi psicodinamici: In alternativa alla CBT, nella terapia si possono utilizzare metodi psicodinamici. Il loro scopo è quello di affrontare i conflitti interpersonali e intrapersonali che possono essere coinvolti nello sviluppo dei sintomi della SII [70].
Tuttavia, gli studi su questa forma di terapia non sono così ampi come quelli sulla TAC. Anche il contenuto della terapia negli studi è più eterogeneo rispetto alla TAC [3]. Questo
L’eterogeneità riduce la comparabilità degli studi corrispondenti. Tuttavia, i metodi psicodinamici sono un’opzione relativamente poco costosa per il trattamento dei pazienti, soprattutto di quelli con gravi decorsi di malattia [71].
Tuttavia, uno studio clinico randomizzato (n=257) non ha dimostrato la superiorità della terapia psicodinamica rispetto al trattamento con la sola paroxetina (SSRI, 20 mg/d) per tre mesi. Entrambi i gruppi hanno mostrato un miglioramento significativo della qualità di vita rispetto alla terapia standard [1,71].
Ipnoterapia intestinale: come forma speciale di ipnoterapia, deve essere distinta dalle altre procedure elencate [3]. Lo scopo dello stato di coscienza alterato è quello di recuperare il controllo sulle percezioni gastrointestinali e quindi migliorare i sintomi [72].
L’ipnoterapia si presenta attualmente come un intervento psicoterapeutico promettente. In un’ampia coorte di 1000 pazienti con IBS, una riduzione significativa della gravità dei sintomi, definita come una riduzione di almeno 50 punti nel punteggio di gravità dei sintomi dell’IBS (IBS-SSS), è stata ottenuta nel 76% dei pazienti [73].
L’NNT è di quattro pazienti e si riferisce a 452 pazienti di sette studi clinici randomizzati [3]. Secondo una recente revisione, fino al 73% dei pazienti risponde positivamente all’ipnoterapia legata all’intestino [3,72]. Gli svantaggi dell’ipnoterapia intestinale sono la disponibilità attualmente ancora molto limitata e i costi relativamente elevati [3].
Terapia basata sulla mindfulness: l’ultimo metodo psicoterapeutico da considerare in modo più dettagliato è la terapia basata sulla mindfulness, in quanto riduce in modo particolare l’angoscia provata a causa della malattia [74]. Attraverso la combinazione di elementi legati alla mindfulness e cognitivi, si allenano la percezione e l’autoriflessione, riuscendo a trattare meglio i sintomi dopo un’intensa percezione interocettiva [3]. La terapia dura solitamente otto settimane [3,74].
Purtroppo, gli studi disponibili non sono molto completi. Uno studio clinico randomizzato su 75 donne ha dimostrato che la terapia ha ridotto significativamente i sintomi (26,4% vs. 6,2%) rispetto al gruppo di controllo e che il miglioramento è persistito dopo tre mesi, mentre un altro studio clinico ha descritto un’equalizzazione del miglioramento dei sintomi con la terapia rispetto al gruppo di controllo dopo sei mesi (n=90). [74,75]. Ciò suggerisce un effetto piuttosto a breve termine di questa forma di terapia. Tuttavia, le debolezze metodologiche riducono l’importanza degli studi, motivo per cui sono indicate ulteriori ricerche. Uno studio pilota di quest’anno ha mostrato risultati promettenti per la terapia basata sulla mindfulness (maggiore riduzione dello stress rispetto alla terapia comportamentale dialettica) [76].
Altre alternative: Gli interventi psicoterapeutici alternativi sono complementari alle forme di terapia elencate. Le linee guida raccomandano come opzioni la psicoeducazione, l’auto-aiuto e i metodi di rilassamento [1].
La psicoeducazione, nel senso di spiegare la genesi biopsicosociale come già descritto, è importante per la relazione funzionale medico-paziente e perché il paziente si senta percepito e compreso nella sua sofferenza [13,64].
L’auto-aiuto è fornito, ad esempio, dai manuali, che possono essere raccomandati secondo gli studi attuali (riduzione significativa, pari al 60%, delle consultazioni mediche quando si utilizza un manuale dopo un anno) [1,77]. Le tecniche di rilassamento possono essere utilizzate in combinazione; non ci sono prove convincenti per la monoterapia [1,78].
Prospettiva
La sindrome dell’intestino irritabile è un quadro clinico multifattoriale diffuso in tutto il mondo [12]. I possibili fattori patogenetici comportano una varietà di approcci terapeutici. I ruoli dell’alimentazione (ad esempio, il contenuto di FODMAP) e del microbioma devono essere considerati importanti in questo caso, poiché i pre-, i pro- e gli antibiotici e forse anche il trasferimento del microbioma fecale (FMT) possono influenzare la flora batterica. Tuttavia, la FMT deve essere considerata con cautela, poiché gli studi al riguardo sono ancora carenti e finora sono stati dimostrati solo lievi successi nell’ambito di uno studio clinico randomizzato [79]. Inoltre, sono disponibili diverse opzioni medicinali per la terapia sintomatica. Sebbene gli psicofarmaci non siano molto popolari tra i pazienti (e spesso anche tra i medici), le meta-analisi mostrano che sono opzioni terapeutiche molto favorevoli. La psicoterapia dovrebbe essere offerta soprattutto ai pazienti con corsi gravi e comorbidità mentali. La KVT, la psicoterapia psicodinamica, ma anche l’ipnoterapia intestinale e la terapia basata sulla mindfulness sono metodi adatti in questo caso.
Messaggi da portare a casa
- La genesi dell’IBS è multifattoriale e può essere spiegata attraverso il modello di malattia biopsicosociale.
- Le modifiche dello stile di vita (ad esempio, la riduzione dello stress) devono essere effettuate come terapia di base.
- L’ipnoterapia legata all’intestino è ancora difficile da realizzare a causa della disponibilità limitata.
- La scelta della forma di terapia deve essere fatta insieme al paziente.
- La psicoterapia deve essere offerta per i corsi gravi e le comorbidità mentali.
Letteratura:
- Layer P, et al.: Sindrome dell’intestino irritabile: linee guida di consenso tedesche su definizione, fisiopatologia e gestione. Z Gastroenterol, 2011. 49(2): 237-293.
- Mearin F, et al: Disturbi intestinali. Gastroenterologia, 2016.
- Enck P, et al: Sindrome dell’intestino irritabile. Nature Reviews Disease Primers, 2016, 2: 16014.
- Lacy BE, Patel NK: I criteri di Roma e un approccio diagnostico alla sindrome dell’intestino irritabile. J Clin Med, 2017. 6(11).
- Lee YY, Annamalai C,Rao SSC: Sindrome dell’intestino irritabile post-infettiva. Curr Gastroenterol Rep, 2017. 19(11): 56.
- Lewis SJ. Heaton KW: La scala di forma delle feci come guida utile al tempo di transito intestinale. Scand J Gastroenterol, 1997. 32(9): 920-924.
- Whitehead WE, Palsson O, Jones KR: Revisione sistematica della comorbilità della sindrome dell’intestino irritabile con altri disturbi: quali sono le cause e le implicazioni? Gastroenterologia, 2002. 122(4): 1140-1456.
- Ford AC, et al: Sindrome dell’intestino irritabile: una storia naturale di 10 anni di sintomi e fattori che influenzano il comportamento di consultazione. Am J Gastroenterol, 2008. 103(5): 1229-1239; quiz 1240.
- Sibelli A, et al: Una revisione sistematica con meta-analisi del ruolo dell’ansia e della depressione nell’insorgenza della sindrome dell’intestino irritabile. Psychol Med, 2016, 46(15): 3065-3080.
- Lovell RM, Ford AC: Prevalenza globale e fattori di rischio per la sindrome dell’intestino irritabile: una meta-analisi. Clin Gastroenterol Hepatol, 2012. 10(7): 712-721.e4.
- Lovell RM, Ford AC: Effetto del sesso sulla prevalenza della sindrome dell’intestino irritabile nella comunità: revisione sistematica e meta-analisi. Am J Gastroenterol, 2012. 107(7): 991-1000.
- Thomas G, Grobe SS, Szecsenyi J: BARMER-Arztreport 2019 in Schriftenreihe zur Gesundheitsanalyse. 2019.
- Tanaka Y, et al: Modello biopsicosociale della sindrome dell’intestino irritabile. J Neurogastroenterol Motil, 2011. 17(2): 131-139.
- Carroll IM, et al: Alterazioni nella composizione e nella diversità del microbiota intestinale nei pazienti con sindrome dell’intestino irritabile a predominanza di diarrea. Neurogastroenterol Motil, 2012. 24(6): 521-530, e248.
- Carroll IM, et al.: Analisi molecolare del microbiota intestinale associato alla mucosa e alla zona luminosa nella sindrome dell’intestino irritabile a predominanza di diarrea. Am J Physiol Gastrointest Liver Physiol, 2011. 301(5): G799-807.
- Moser G, Fournier C, Peter J: Asse microbioma intestinale-intestino-cervello e sindrome dell’intestino irritabile. Wien Med Wochenschr, 2018. 168(3-4): 62-66.
- Zhou Q, Zhang B, Verne GN: Permeabilità della membrana intestinale e ipersensibilità nella sindrome dell’intestino irritabile. Dolore, 2009. 146(1-2): 41-6.
- Piche T, et al.: compromissione dell’integrità della barriera intestinale nel colon dei pazienti con sindrome dell’intestino irritabile: coinvolgimento dei mediatori solubili. Gut, 2009. 58(2): 196-201.
- Barbara G, et al: Il sistema immunitario nella sindrome dell’intestino irritabile. J Neurogastroenterol Motil, 2011. 17(4): 349-359.
- Larsson MH, et al.: Elevata differenza di potenziale transmucoso legata alla motilità nella parte superiore dell’intestino tenue nella sindrome dell’intestino irritabile. Neurogastroenterol Motil, 2007. 19(10): 812-820.
- Elsenbruch S, et al.: I pazienti con sindrome dell’intestino irritabile presentano un’alterata modulazione emotiva delle risposte neurali agli stimoli viscerali. Gastroenterologia, 2010. 139(4): 1310-1319.
- Walter SA, et al.: Stress pre-sperimentale nei pazienti con sindrome dell’intestino irritabile: valori elevati di cortisolo già prima della provocazione dei sintomi con distensioni rettali. Neurogastroenterol Motil, 2006. 18(12): 1069-1077.
- FitzGerald LZ, Kehoe, Sinha K: Disregolazione dell’asse ipotalamo-ipofisi-surrene nelle donne con sindrome dell’intestino irritabile in risposta a uno stress fisico acuto. West J Nurs Res, 2009. 31(7): 818-836.
- O’Mahony SM, et al: La sindrome dell’intestino irritabile e le comorbilità psichiatriche legate allo stress: focus sullo stress precoce. Handb Exp Pharmacol, 2017. 239: 219-246.
- Whitehead WE, et al: Comportamento di malattia appreso nei pazienti con sindrome dell’intestino irritabile e ulcera peptica. Dig Dis Sci, 1982. 27(3): 202-208.
- Di Palma JA, Herrera JL: Il ruolo di una comunicazione efficace tra medico e paziente nella gestione della sindrome dell’intestino irritabile e della stipsi cronica. J Clin Gastroenterol, 2012. 46(9): 748-751.
- Towle A, Godolphin W: Quadro per l’insegnamento e l’apprendimento del processo decisionale condiviso informato. Bmj, 1999. 319(7212): 766-771.
- Hauser W, et al: Disturbi funzionali dell’intestino negli adulti. Dtsch Arztebl Int, 2012. 109(5): 83-94.
- Johannesson E, et al: L’attività fisica migliora i sintomi nella sindrome dell’intestino irritabile: uno studio controllato randomizzato. Am J Gastroenterol, 2011. 106(5): 915-922.
- Schumann D, et al: Effetto dello yoga nella terapia della sindrome dell’intestino irritabile: una revisione sistematica. Clin Gastroenterol Hepatol, 2016. 14(12): 1720-1731.
- Tu Q, et al: Disturbi del sonno nella sindrome dell’intestino irritabile: una revisione sistematica. Neurogastroenterol Motil, 2017. 29(3).
- Sirri L, Grandi S, Tossani E: Il fumo nella sindrome dell’intestino irritabile: una revisione sistematica. J Dual Diagn, 2017. 13(3): 184-200.
- Bohn L, Storsrud S, Simren M: Assunzione di nutrienti nei pazienti con sindrome dell’intestino irritabile rispetto alla popolazione generale. Neurogastroenterol Motil, 2013. 25(1): 23-30.e1.
- Bohn L, et al: I sintomi gastrointestinali auto-riferiti legati al cibo nell’IBS sono comuni e associati a sintomi più gravi e a una ridotta qualità di vita. Am J Gastroenterol, 2013. 108(5): 634-641.
- Goldstein R, Braverman D, Stankiewicz H: Il malassorbimento dei carboidrati e l’effetto della restrizione dietetica sui sintomi della sindrome dell’intestino irritabile e dei disturbi funzionali intestinali. Isr Med Assoc J, 2000. 2(8): 583-587.
- Shepherd SJ, et al: Fattori scatenanti dietetici dei sintomi addominali nei pazienti con sindrome dell’intestino irritabile: prove randomizzate controllate con placebo. Clin Gastroenterol Hepatol, 2008. 6(7): 765-771.
- Wahnschaffe U, et al.: Predittori della risposta clinica alla dieta senza glutine nei pazienti con diagnosi di sindrome dell’intestino irritabile a predominanza di diarrea. Clin Gastroenterol Hepatol, 2007. 5(7): 844-850; quiz 769.
- Atkinson W, et al: Eliminazione degli alimenti basata sugli anticorpi IgG nella sindrome dell’intestino irritabile: uno studio randomizzato controllato. Gut, 2004. 53(10): 1459-1464.
- Cummings JH, Macfarlane GT: Ruolo dei batteri intestinali nel metabolismo dei nutrienti. JPEN J Parenter Enteral Nutr, 1997. 21(6): 357-365.
- Gibson PR, Shepherd SJ: Gestione dietetica dei sintomi gastrointestinali funzionali basata sull’evidenza: l’approccio FODMAP. J Gastroenterol Hepatol, 2010. 25(2): 252-258.
- Catassi G, et al.: La dieta a basso contenuto di FODMAP: molti punti interrogativi per un acronimo accattivante. Nutrienti, 2017. 9(3).
- Altobelli E, et al: La dieta a basso contenuto di FODMAP migliora i sintomi della sindrome dell’intestino irritabile: una meta-analisi. Nutrienti, 2017. 9(9).
- Varju P, et al.: La dieta a basso contenuto di oligosaccaridi fermentabili, disaccaridi, monosaccaridi e polioli (FODMAP) migliora i sintomi negli adulti affetti da sindrome dell’intestino irritabile (IBS) rispetto alla dieta IBS standard: una meta-analisi di studi clinici. PLoS One, 2017. 12(8): e0182942.
- Ford AC, et al: Revisione sistematica con meta-analisi: l’efficacia di prebiotici, probiotici, sinbiotici e antibiotici nella sindrome dell’intestino irritabile. Aliment Pharmacol Ther, 2018. 48(10): 1044-1060.
- Didari T, et al: Efficacia dei probiotici nella sindrome dell’intestino irritabile: revisione sistematica aggiornata con meta-analisi. World J Gastroenterol, 2015. 21(10): 3072-3084.
- Pimentel M, et al: Terapia con rifaximina per i pazienti con sindrome dell’intestino irritabile senza costipazione. N Engl J Med, 2011. 364(1): 22-32.
- Krueger D, et al.: Effetto della ioscina butilbromuro (Buscopan(R)) sulle vie colinergiche nell’intestino umano. Neurogastroenterol Motil, 2013. 25(8): e530-539.
- Ford AC, Lacy BE, Talley NJ: Sindrome dell’intestino irritabile. N Engl J Med, 2017. 376(26): 2566-2578.
- Ford AC, et al: Effetto delle fibre, degli antispastici e dell’olio di menta piperita nel trattamento della sindrome dell’intestino irritabile: revisione sistematica e meta-analisi. Bmj, 2008. 337: a2313.
- Cash BD, Epstein MS, Shah SM: Un nuovo sistema di somministrazione dell’olio di menta piperita è una terapia efficace per i sintomi della sindrome dell’intestino irritabile. Dig Dis Sci, 2016. 61(2): 560-571.
- Garsed K, et al: Uno studio randomizzato sull’ondansetron per il trattamento della sindrome dell’intestino irritabile con diarrea. Gut, 2014. 63(10): 1617-1625.
- Moret C, Briley M: Antidepressivi nel trattamento della fibromialgia. Neuropsychiatr Dis Treat, 2006. 2(4): 537-548.
- Lacy BE, et al: Efficacia di Eluxadoline nei pazienti con IBS-D che riferiscono un precedente uso di Loperamide. Am J Gastroenterol, 2017. 112(6): 924-932.
- Defrees DN, Bailey J: Sindrome dell’intestino irritabile: epidemiologia, fisiopatologia, diagnosi e trattamento. Prim Care, 2017. 44(4): 655-671.
- Wedlake L, et al.: Revisione sistematica: la prevalenza del malassorbimento idiopatico degli acidi biliari diagnosticato dalla scansione SeHCAT nei pazienti con sindrome dell’intestino irritabile a predominanza di diarrea. Aliment Pharmacol Ther, 2009. 30(7): 707-717.
- Zuckerman MJ: Il ruolo delle fibre nel trattamento della sindrome dell’intestino irritabile: raccomandazioni terapeutiche. J Clin Gastroenterol, 2006. 40(2): 104-108.
- Li F, et al: Il lubiprostone è efficace nel trattamento della stipsi cronica idiopatica e della sindrome dell’intestino irritabile: una revisione sistematica e una meta-analisi di studi controllati randomizzati. Mayo Clin Proc, 2016. 91(4): 456-68.
- Corsetti M, Tack J: Nuove opzioni di trattamento farmacologico per la stipsi cronica. Expert Opin Pharmacother, 2014. 15(7): 927-941.
- Madisch A, et al: Trattamento della sindrome dell’intestino irritabile con preparati a base di erbe: risultati di uno studio multicentrico in doppio cieco, randomizzato, controllato con placebo. Aliment Pharmacol Ther, 2004. 19(3): 271-279.
- Pimentel M: Articolo di revisione: potenziali meccanismi d’azione della rifaximina nella gestione della sindrome dell’intestino irritabile con diarrea. Aliment Pharmacol Ther, 2016. 43 Suppl 1: 37-49.
- Fond G, et al: Comorbilità di ansia e depressione nella sindrome dell’intestino irritabile (IBS): una revisione sistematica e una meta-analisi. Eur Arch Psychiatry Clin Neurosci, 2014. 264(8): 651-660.
- Guthrie E, et al: Uno studio controllato randomizzato sulla psicoterapia nei pazienti con sindrome dell’intestino irritabile refrattaria. Br J Psychiatry, 1993. 163: 315-321.
- Laird KT, et al: Efficacia a breve e lungo termine delle terapie psicologiche per la sindrome dell’intestino irritabile: revisione sistematica e meta-analisi. Clin Gastroenterol Hepatol, 2016. 14(7): 937-947.e4.
- Owens DM, Nelson DK, Talley NJ: La sindrome dell’intestino irritabile: prognosi a lungo termine e interazione medico-paziente. Ann Intern Med, 1995. 122(2): 107-112.
- Kinsinger SW: La terapia cognitivo-comportamentale per i pazienti con la sindrome dell’intestino irritabile: intuizioni attuali. Ricerca psicologica e gestione del comportamento, 2017. 10: 231-237.
- Laird KT, et al: Efficacia comparativa delle terapie psicologiche per migliorare la salute mentale e il funzionamento quotidiano nella sindrome dell’intestino irritabile: revisione sistematica e meta-analisi. Rivista di psicologia clinica, 2017, 51: 142-152.
- Radziwon CD, Lackner JM: Terapia cognitivo-comportamentale per l’IBS: quanto è utile, quanto spesso e come funziona? Current Gastroenterology Reports, 2017. 19(10): 49.
- Li L, et al.: Terapia cognitivo-comportamentale per la sindrome dell’intestino irritabile: una meta-analisi. J Psychosom Res, 2014. 77(1): 1-12.
- Kawanishi H, et al: Terapia cognitivo-comportamentale con esposizione interocettiva e materiali video complementari per la sindrome dell’intestino irritabile (IBS): protocollo per uno studio multicentrico randomizzato e controllato in Giappone. Biopsychosoc Med, 2019. 13: 14.
- Palsson OS, Whitehead WE: Trattamenti psicologici nei disturbi funzionali gastrointestinali: un primo passo per il gastroenterologo. Gastroenterologia clinica ed epatologia, 2013. 11(3): 208-216.
- Creed F, et al: Il rapporto costo-efficacia della psicoterapia e della paroxetina per la sindrome dell’intestino irritabile grave. Gastroenterologia, 2003. 124(2): 303-317.
- Peters SL, Muir JG, Gibson PR: Articolo di revisione: ipnoterapia diretta all’intestino nella gestione della sindrome dell’intestino irritabile e della malattia infiammatoria intestinale. Aliment Pharmacol Ther, 2015. 41(11): 1104-1115.
- Miller V, et al: Ipnoterapia per la sindrome dell’intestino irritabile: un audit su mille pazienti adulti. Aliment Pharmacol Ther, 2015. 41(9): 844-855.
- Gaylord SA, et al: Il training Mindfulness riduce la gravità della sindrome dell’intestino irritabile nelle donne: risultati di uno studio controllato randomizzato. Am J Gastroenterol, 2011. 106(9): 1678-1688.
- Zernicke KA, et al: Riduzione dello stress basata sulla mindfulness per il trattamento dei sintomi della sindrome dell’intestino irritabile: uno studio randomizzato controllato in lista d’attesa. Int J Behav Med, 2013. 20(3): 385-396.
- Mohamadi J, Ghazanfari F, Drikvand FM: Confronto dell’effetto della Terapia Dialettica Comportamentale, della Terapia Cognitiva Basata sulla Mindfulness e della Psicoterapia Positiva sullo stress percepito e sulla qualità della vita nei pazienti con Sindrome dell’Intestino Irritabile: uno Studio Pilota Randomizzato Controllato. Psychiatr Q, 2019. 90(3): 565-578.
- Robinson A, et al: Uno studio controllato randomizzato di interventi di auto-aiuto in pazienti con diagnosi di sindrome dell’intestino irritabile nell’assistenza primaria. Gut, 2006. 55(5): 643-648.
- Ford AC, et al: Efficacia degli antidepressivi e delle terapie psicologiche nella sindrome dell’intestino irritabile: revisione sistematica e meta-analisi. Gut, 2009. 58(3): 367-378.
- Johnsen PH, et al: Trapianto di microbiota fecale contro placebo per la sindrome dell’intestino irritabile da moderata a grave: uno studio in doppio cieco, randomizzato, controllato con placebo, a gruppi paralleli, monocentrico. Lancet Gastroenterol Hepatol, 2018. 3(1): 17-24.
- Storr M: La guida nutrizionale alla dieta FODMAP: la dieta un po’ diversa per la sindrome dell’intestino irritabile, l’intolleranza al grano e altri disturbi digestivi. 2017: W. Zuckschwerdt Verlag.
GPS 2019; 14(9): 9-15