O Gabinete Federal de Saúde Pública (FOPH) e a Comissão Federal de Assuntos de Vacinação (ECIF) recomendam a vacinação contra o herpes zoster com a nova vacina recombinante inactivada composta pelos dois componentes activos glicoproteína E (subinit do vírus) e AS01B (adjuvante) para pessoas saudáveis com 65 anos ou mais e para doentes com imunodeficiência com 50 anos ou mais ou imunodeficiência grave com 18 anos ou mais. Este está agora aprovado para utilização por companhias de seguros de saúde e está disponível na Suíça.
Com o aumento da idade, o número e a funcionalidade das células imunitárias que impedem a reactivação do vírus da varicela zoster (VZV) diminuem [2,6,7,9,10]. Isto leva a um aumento da incidência e gravidade das telhas. Existem entre 17.000 e 30.000 casos de herpes zoster na Suíça todos os anos [2]. Cerca de 99% dos adultos com 50 ou mais anos estão infectados com o vírus que causa herpes zóster, e numa em cada três pessoas o VZV latente reativa e causa herpes zóster [2,3]. Certas condições pré-existentes, tais como artrite reumatóide, doença inflamatória intestinal crónica, diabetes, DPOC, asma, lúpus eritematoso sistémico ou depressão também levam a um risco acrescido de herpes zoster. O risco de herpes zoster é maior nas doenças que levam a imunodeficiências graves, como o linfoma ou mieloma, e o risco é até 13 vezes maior durante a quimioterapia [2,5,6,11,12].
Shingles e as potenciais complicações graves
O herpes zoster ophthalmicus [2] é uma doença dolorosa que pode ser associada a complicações graves e duradouras, que incluem neuralgia pós-herpética (PHN) e zoster ophthalmicus [3]. O PHN afecta até 30% dos doentes com herpes zóster e caracteriza-se por dores nos nervos, por vezes com duração de anos [2,4]. Zoster ophthalmicus afecta cerca de 20% dos doentes com herpes zoster. Isto pode levar a complicações oftalmológicas e, em casos raros, à cegueira [2,13]. A taxa de recorrência do herpes zoster após oito anos é estimada em 6,2% de acordo com Yawn et al. As recidivas foram mais frequentes em indivíduos com dores que duraram >30 d e em indivíduos imunossuprimidos. Devido às taxas relativamente elevadas de recorrência, a vacinação também deve ser oferecida aos doentes que já sofreram de herpes zoster [14].
Prevenção através de nova vacina recombinante inactivada
SHINGRIX® é a primeira e única vacina contra a telha a induzir uma resposta imunitária forte e sustentada com uma combinação de um antigénio recombinante e um sistema adjuvante [1,15–19]. O antigénio (glicoproteína E [gE]) desencadeia uma resposta imunitária específica contra o VZV. gE é expresso na superfície das células infectadas com VZV e é crucial para a replicação do vírus. O sistema adjuvante (AS01B) causa um aumento da resposta imunitária ao antigénio da vacina. Induz uma resposta imunitária antigE forte e sustentada. A combinação única de MPL e QS-21 melhora tanto a resposta imunitária humoral como celular contra o gE* [1,17–22]. Esta propriedade também a torna adequada para doentes imunodeficientes ou imunossuprimidos [1].
* VZV = Varicella-zoster virus; MPL: 3-O-desacyl-4′-monophosporyl lipid A de Salmonella minnesota; QS-21: Saponin fraction QS-21 da árvore da casca do sabão.
Eficácia e perfil de segurança
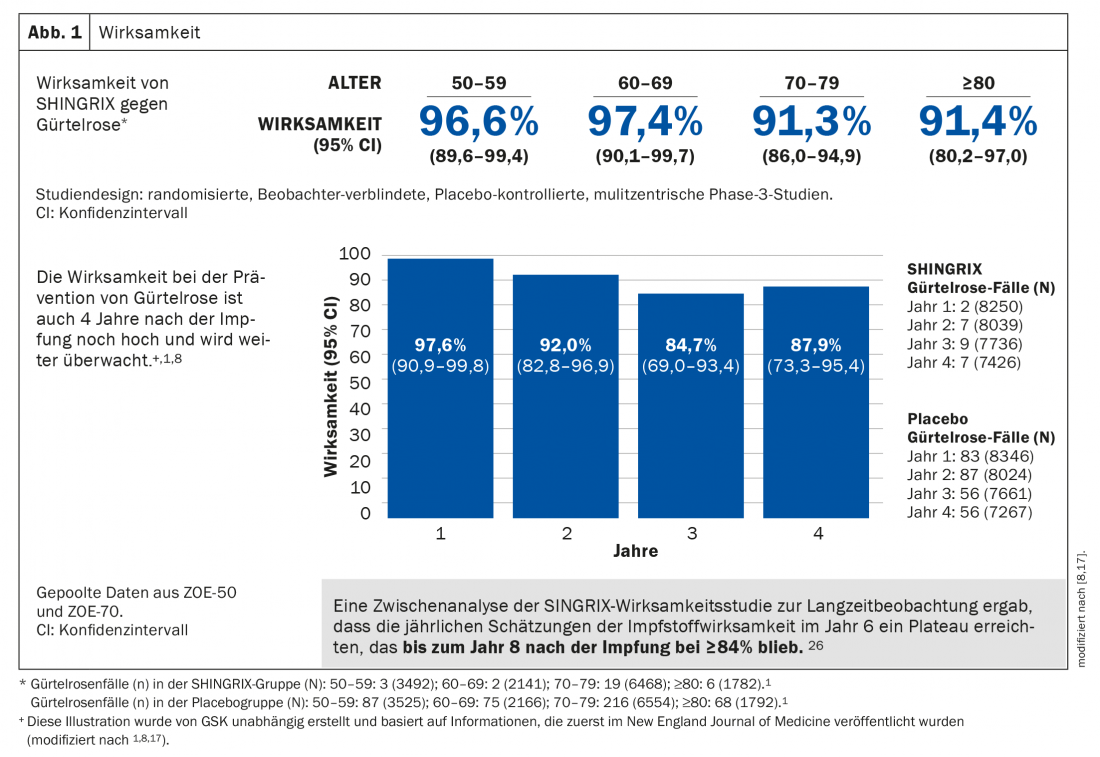
A vacina adjuvante da subunidade mostrou mais de 90% de eficácia na prevenção da herpes zóster em todos os grupos etários com 50 anos ou mais, permanecendo a um nível muito elevado mesmo após mais de sete anos. Do mesmo modo, o risco de desenvolver PHN é significativamente reduzido (Fig. 1) [1]. A segurança tem sido exaustivamente investigada em dois ensaios clínicos em grande escala da fase 3. A maioria dos eventos adversos foram de gravidade ligeira a moderada e incluíram dor, vermelhidão e inchaço no local da injecção. Os pacientes também podem sofrer de dores musculares, fadiga, dores de cabeça, calafrios, febre ou perturbação do estômago. Em ensaios clínicos, estes efeitos adversos duraram uma mediana de 2 a 3 dias [1,8,17].
Recomendação de vacinação BAG e EKIF
A vacinação contra o herpes zoster com duas doses e um intervalo mínimo de 1-2 meses é dada em duas categorias de recomendação [25]: Uma recomendação suplementar de vacinação: A vacinação é recomendada para todas as pessoas imunocompetentes com idade de ≥65 anos, independentemente da sua história individual de varicela e herpes zoster. São recomendadas duas doses com um intervalo mínimo de dois meses.
B Recomendação de vacinação para dois grupos de risco definidos:
B1: A vacinação é recomendada para todos os doentes com ≥50 anos com imunodeficiência actual ou futura (especialmente celular) associada a um risco acrescido de herpes zoster. São recomendadas duas doses com um intervalo mínimo de dois meses.
B2: A vacinação é recomendada para pacientes com idades compreendidas entre ≥18 anos que sofrem actualmente de imunodeficiência grave ou que estão actualmente a receber tratamento imunossupressor ou que estarão num futuro previsível. A primeira dose deve idealmente ser administrada ≥4 semanas antes de um início presumido, esperado ou planeado de imunossupressão severa. A segunda dose com um intervalo mínimo de um a dois meses após a primeira dose ou o mais cedo possível num momento medicamente favorável posterior durante ou após a terapia.
SHINGRIX® destina-se exclusivamente à injecção intramuscular e apenas para uso profiláctico e não para o tratamento de doenças clínicas confirmadas. A vacina pode ser administrada ao mesmo tempo que uma vacina contra a gripe sazonal não-adjuvante, uma vacina contra o polissacarídeo pneumocócico de 23-valentes (PPV23) ou uma vacina contra a tosse convulsa acelular de difteria-tetano com teor reduzido de antigénio (dTpa) (local de injecção diferente). A resposta imunitária (2 doses) não foi afectada pela vacinação anterior com uma vacina viva atenuada HZ [1]. Não é necessário um intervalo mínimo entre a vacinação COVID mRNA e a administração de outras vacinas, como acontece com todas as outras vacinas não vivas [24].
Fonte: GlaxoSmithKline AG
Literatura:
- Folheto Shingrix. www.swissmedicinfo.ch, acedido em Outubro de 2021.
- Comissão Federal para Questões de Imunização (EKIF). Avaliação da vacinação contra o herpes zoster de acordo com os critérios de análise das recomendações nacionais de vacinação na Suíça. 14 de Dezembro de 2015; 1-34.
- Hillebrand K, Bricout H, Schulze-Rath R, et al: Incidence of herpes zoster and its complications in Germany 2005-2009. Journal of Infection 2015 Fev; Vol 70: 178-186.
- Kawai K, Gebremeskel BG, Acosta CJ: Revisão sistemática da incidência e complicações do herpes zoster: rumo a uma perspectiva global. BMJ Open 2014 Jun;4(6): e004833.
- Mahalingam R, Wellish M, Wolf W, et al: ADN viral varicela-zoster latente no trigémeo e gânglios torácicos humanos. N Engl J Med 1990 Set; 323(10): 627-631.
- Weinberg A, Lazar AA, Zerbe GO, et al: Influência da idade e da natureza da infecção primária nas respostas imunitárias mediadas por células específicas do vírus da varicela-zoster. J Infect Dis. 2010; 201(7): 1024-1030.
- Kimberlin DW, Whitley RJ: vacina contra Varicella-zoster para a prevenção do herpes zoster. N Engl J Med. 2007 Mar;356(13): 1338-1343.
- Cunningham AL, Lal H, Kovac M, et al: Eficácia da vacina da subunidade herpes zoster em adultos com 70 anos de idade ou mais. N Engl J Med 2016 Set; 375(11): 1019-1032.
- Levin MJ: Imune senescência e vacinas para prevenir o herpes zoster em pessoas idosas. Curr Opinião Immunol 2012 Ago; 24(4): 494-500.
- Patterson-Bartlett J, Levin MJ, Lang N, et al: Caracterização fenotípica e funcional das respostas ex vivo das células T à vacina viva atenuada contra o herpes zoster. Vacina 2007 Oct; 25(41): 7087-7093.
- Lungu O, Annunziato PW, Gershon A, et al: Vírus de varicela-zoster reactivado e latente nos gânglios radiculares dorsais humanos. Proc Natl Acad Sci USA 1995 Nov; 92(24): 10980-10984.
- Furuta Y, Takasu T, Fukuda S, et al: Detecção do ADN do vírus da varicela-zoster em gânglios geniculados humanos por reacção em cadeia da polimerase. J Infect Dis 1992 Nov; 166(5): 1157-1159.
- Volpi A: Complicações graves do herpes zoster. Herpes 2007 Set; 14 Suppl 2: 35-39.
- Yawn BP, Wollan P, Kurland MJ, et al: Herpes Zoster Recurrence More Frequent than Previously Reported. Mayo Clin Proc. Fevereiro 2011;86(2): 88-93.
- Chlibek R, Smetana J, Pauksens K, et al: Segurança e imunogenicidade de três formulações diferentes de uma vacina candidata a vacina adjuvante contra o vírus da varicela-zoster em adultos mais velhos: um estudo fase II, aleatório e controlado. Vacina 2014 Mar; 32(15): 1745-1753.
- Bharucha T, Ming D, Breuer J: Uma avaliação crítica de ‘Shingrix’, uma nova vacina de herpes zoster subunidade (HZ/Su ou GSK1437173A) para o vírus da varicela zoster. Vacina Hum Vaccin Immunother. 2017 Ago;13(8): 1789-1797.
- Lal H, Cunningham AL, Godeaux O, et al: Eficácia de uma vacina adjuvante da subunidade de herpes zoster em adultos mais velhos. N Engl J Med 2015 Maio; 372(22): 2087-2096.
- Schwarz TF, Volpe S, Catteau G, et al: Persistência da resposta imunitária a uma vacina adjuvante contra o vírus da varicela e do zoster até ao nono ano em adultos mais velhos. Hum Vaccin Immunother 2018 Jun; 14(6): 1370-1377.
- Merck Sharp & Dohme. Zostavax relatório de avaliação pública europeia, Anexo I: Resumo das características do produto: EMA; [actualizado em Janeiro de 2019; acedido em Dezembro de 2020]. Disponível em: www.ema.europa.eu/en/documents/product-information/zostavaxepar-product-information_en.pdf.
- Lecrenier N, Beukelaers P, Colindres R, et al: Desenvolvimento da vacina zoster recombinante adjuvante e suas implicações para a prevenção da herpes zoster. Revisão especializada das Vacinas 2018; 17(7): 619-634.
- Dendouga N, Fochesato M, Lockman L, et al.: Respostas imunitárias mediadas por células a uma vacina contra o vírus da varicela-zoster glicoproteína E usando tanto um agonista TLR como a QS21 em ratos. Vacina. 2012 Abr;30(20): 3126-3135.
- Leroux-Roels G, Marchant A, Levy J, et al: Impact of adjuvants on CD4(+) T cell and B cell responses to a protein antigen vaccine: results from a phase II, randomized, multicenter trial. Clin Immunol 2016 Ago; 169: 16-27.
- US Food and Drug Administration; Comité Consultivo de Vacinas e Produtos Biológicos Relacionados. Briefing document: Shingrix (Zoster Vaccine Recombinant, Adjuvanted). 2017 [accessed December 2020]. Disponível a partir de: www.fda.gov/media/107553/download.
- BAG: Recomendação de vacinação para vacinas mRNA contra Covid-19 (a partir de 14.09.2021), acedida em%20gegen%em Setembro. 2021.
- FOPH: Novas recomendações de vacinação contra o herpes zoster: vacina SHINGRIX. Boletim BAG 47/2021;22: 9-15.
- Boutry C, et al.: A vacina de zoster recombinante adjuvante confere protecção a longo prazo contra o herpes zoster: Resultados provisórios de um estudo de extensão dos ensaios clínicos de fase III pivotal (ZOE-50 e ZOE-70). Clin Inf Dis 2021: 1-30.
PRÁTICA DO GP 2022; 17(3): 32-33