Para a maioria dos doentes com melanoma, existem hoje terapias muito mais eficazes do que há alguns anos atrás. Isto também se aplica ao tratamento do melanoma adjuvante. Foram estabelecidas muitas novas abordagens terapêuticas, que estão a ser sucessivamente investigadas no âmbito de estudos maiores e menores. Isto inclui a análise intercalar apresentada na Reunião Anual da ADF deste ano.
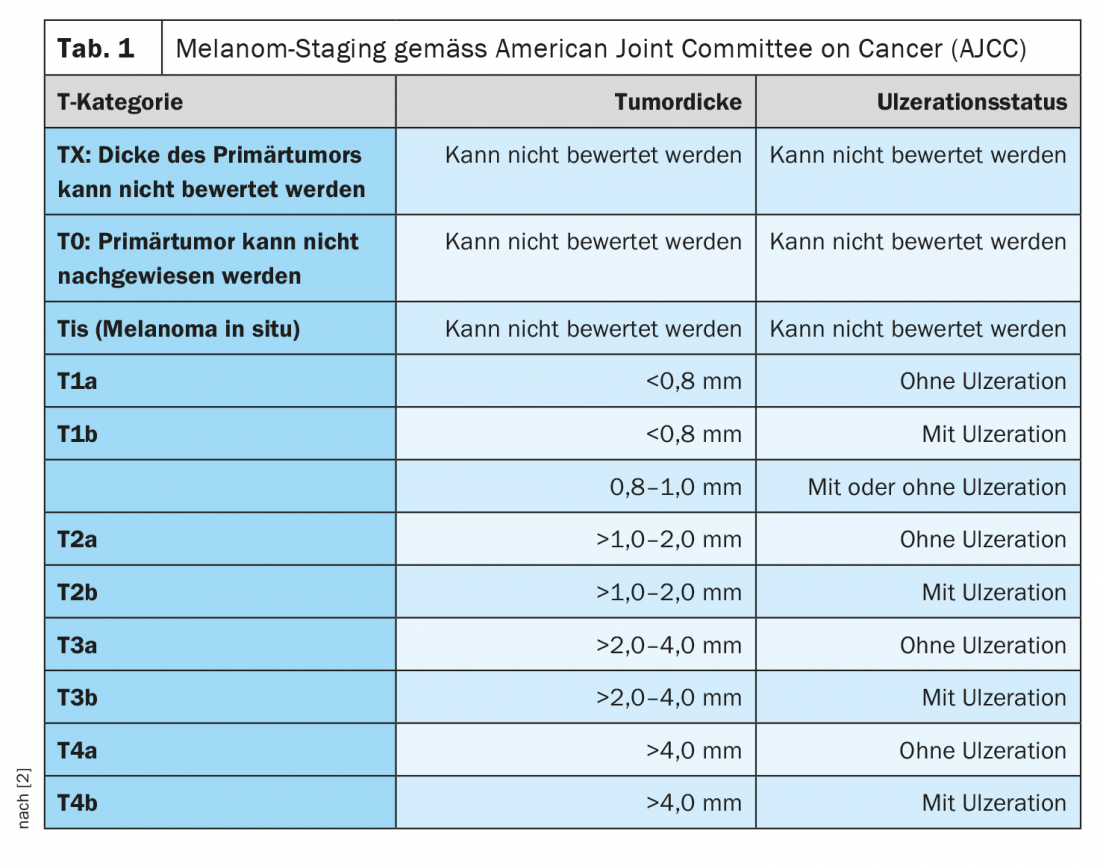
Todos os anos, estima-se que cerca de 200.000 pessoas em todo o mundo desenvolvem melanoma maligno [1]. A incidência tem aumentado de forma constante nas últimas décadas. A idade média de início é de cerca de 60 anos para as mulheres e 64 anos para os homens. A classificação e encenação do melanoma maligno é actualmente baseada na oitava edição da classificação AJCC (Tab. 1) [2]. Para além da espessura do tumor segundo Breslow, a presença de ulcerações e o envolvimento de gânglios linfáticos são considerados critérios prognósticos importantes no diagnóstico inicial [1]. Até alguns anos atrás, o padrão de cuidados para o melanoma avançado e metastático era paliativo com um tempo médio de sobrevivência de 6 a 12 meses. A quimioterapia era o tratamento padrão. O lançamento de opções de tratamento altamente eficazes do campo dos inibidores de pontos de controlo, bem como inibidores de cinase direccionados, tais como inibidores de BRAF e MEK, melhorou significativamente a esperança de vida dos pacientes com melanoma completamente ressecado.
Os inibidores Checkpoint foram os pioneiros – e hoje em dia?
Desde o lançamento do ipilimumab em 2011, foram feitos mais progressos no campo da imunoterapia para doentes com melanoma. No que diz respeito ao tratamento adjuvante, isto é documentado, entre outras coisas, pelo estudo KEYNOTE-054 [3], no qual o nivolumab mostrou uma vantagem significativa para a sobrevivência sem recorrência em comparação com o ipilimumab. E no ensaio Checkmate-238, pembrolizumab provou ser superior ao placebo em termos de sobrevivência sem recaídas [4]. A redução do risco foi de 35% para nivolumab vs. ipilimumab e 43% para pembrolizumab vs. placebo, respectivamente. O ensaio randomizado de nivolumab versus ipilimumab também mostrou uma melhoria significativa na sobrevivência sem metástases à distância (HR 0,73, 95% CI: 0,55-0,95]. No que diz respeito ao perfil de risco-benefício, a avaliação na actual directriz AWMF é que, apesar de um risco latente de efeitos secundários potencialmente graves, o benefício de uma redução do risco fala a favor da utilização desta opção terapêutica. [5].
Os inibidores BRAF e MEK expandem o espectro de substâncias altamente eficazes
Para terapia adjuvante com inibidores BRAF e MEK , a actual directriz S3 menciona, entre outras coisas, um ensaio de fase III dabrafenibe/trametinibe controlado aleatoriamente e duplo-cego chamado. Pacientes nas fases IIIA (diâmetro mínimo no gânglio linfático afectado >1 mm) a IIIC com um BRAFV600E ou V600K mutação recebeu dabrafenib 150 mg 2× diariamente e trametinib 2 mg 1× diariamente, ou tratamento placebo comparável, durante um total de 12 meses [6]. Após um seguimento médio de 2,8 anos, a probabilidade de sobrevivência livre de recaída de 3 anos era de 58% para o braço de tratamento e 39% para o braço de placebo (HR para recaída ou morte 0,47; 95% CI: 0,39-0,58; p<0,001). De acordo com a avaliação da actual directriz S3, a utilização destas opções terapêuticas deve ser defendida apesar de uma taxa de descontinuação relativamente elevada relacionada com o efeito secundário, tendo em conta o benefício comprovado: redução do risco de 53% para sobrevivência sem recorrência e de 43% para morte relacionada com melanoma.
Resultados provisórios de um conjunto de dados supra-regionais da região DACH
Na Reunião Anual da ADF deste ano, foram apresentados dados de uma análise intercalar de um estudo retrospectivo no qual doentes com melanoma da Alemanha, Áustria e Suíça (DACH) receberam pembrolizumab e nivolumab (anti PD-1) ou dabrafenib/trametinib (inibição BRAF/MEK) como terapia adjuvante entre 1/2017 e 2/2020 [7]. Em Setembro de 2020, foram analisados dados de 524 pacientes de um total de 1039 participantes no estudo. As duas opções de tratamento adjuvantes foram comparadas em termos de PFS de 12 meses e outros parâmetros de resultados relevantes.
As características dos doentes das subpopulações tratadas com inibição de BRAF/MEK versus terapia anti PD1 eram comparáveis em termos de variáveis demográficas e características tumorais. A maioria dos pacientes recebeu terapia PD1 adjuvante (n=439; 83,8%; Nivo=69,2%; Pembro=30,8%). O período médio de acompanhamento foi de 13,1 meses. O intervalo de tempo desde a ressecção completa até ao início do tratamento adjuvante foi de 2,5 meses (SD=1,55) para a inibição de BRAF/MEK e 2,7 meses (SD=2,62) para a terapia anti-PD1. A duração média da terapia foi de 7,4 meses (SD=4,4) para ambos os regimes de tratamento. As análises estatísticas mostraram um PFS de 12 meses de 81,2% para o subgrupo anti-PD1 e 90,4% para os tratados com inibição de BRAF/MEK (OU 2,001; 95% CI: 1,045-3,830; p=0,036). Não houve diferença no PFS entre pacientes que receberam nivolumab vs. pembrolizumab.
Tanto no grupo de inibição BRAF/MEK como no grupo de tratamento anti-PD1, a ulceração, maior espessura do tumor e maior envolvimento dos gânglios linfáticos metastáticos foram preditores negativos de PFS. Os preditores positivos para um PFS mais favorável foram um IMC mais elevado (25-30) e o sexo masculino nos doentes que receberam terapia inibidora do BRAF/MEK. A PFS não diferiu dependendo da dissecção completa dos gânglios linfáticos versus biopsia dos gânglios linfáticos sentinela.

O perfil de segurança de todas as substâncias activas investigadas provou ser comparável a estudos anteriores. A taxa de eventos adversos associados a drogas (drAE) e de EA imunológicos foi semelhante com o nivolumab em comparação com o pembrolizumab (64,2-63,7% e 33,3-33,8%, respectivamente). Entre os pacientes tratados com inibição de BRAF/MEK, a proporção de drAE foi de 87% neste estudo. Os autores não fornecem qualquer outra informação sobre o tipo de efeitos secundários. Estão previstas mais análises para saber mais sobre as características do doente e as características tumorais que se correlacionam com uma resposta favorável à inibição anti-PD1 vs BRAF/MEK como regimes terapêuticos adjuvantes.
Congresso: Grupo de Trabalho sobre Investigação Dermatológica 2021
Literatura:
- Lamos C, Hunger RE: Checkpoint inhibitors – indicação e utilização em doentes com melanoma [Checkpoint inhibitors-indications and application in melanoma patients]. Z Rheumatol 2020;79(8): 818-825.
- Gershenwald JE, et al; para membros do Comité Misto Americano sobre Melanoma Cancro Painel de Peritos e da Base de Dados Internacional de Melanoma e Plataforma de Descoberta. Encenação do melanoma: alterações baseadas em provas no manual de encenação do cancro da oitava edição do Comité Conjunto Americano contra o Cancro. CA Cancer J Clin 2017; 67(6): 472-492.
- Weber J, et al: Adjuvant nivolumab versus ipilimumab na fase III ou IV de melanoma ressecado. N Engl J Med 2017; 377(19): 1824-1835.
- Eggermont AMM, et al: Adjuvant pembrolizumab versus placebo na fase III melanoma ressecado. N Engl J Med 2018; 378(19): 1789-1801.
- AWMF: Directriz S3 sobre o diagnóstico, tratamento e acompanhamento do melanoma Versão 3.3 – Julho 2020 AWMF número de registo: 032/024OL
- Long GV, et al: Adjuvant dabrafenib mais trametinib na fase III melanoma modificado por BRAF. N Engl J Med 2017; 377(19): 1813-1823.
- Schumann K, et al.: P048 Adjuvant melanoma treatment: real-world data from the DACH region, 47th Annual Meeting of the Arbeitsgemeinschaft Dermatologische Forschung (ADF) Virtual, 04.03.-06.03.2021
- Schadendorf D, et al: Melanoma. Lancet 2018; 392: 971-984.
- Arozarena I, Wellbrock C: Superando a resistência aos inibidores de BRAF. Ann Transl Med 2017; 5: 387
DERMATOLOGIE PRAXIS 2021; 31(4): 44-45 (publicado 18.8.21; antes da impressão).