Embora as terapias direccionadas para o cancro do pulmão de células não pequenas (NSCLC) tenham vindo a aumentar há anos, tal opção para os tumores com mutações KRASainda está em falta. O pequeno inibidor de moléculas Sotorasib, que visa o KRASG12C, poderá em breve colmatar esta lacuna. Há também algo a acontecer na calha para o cancro do pulmão de pequenas células (SCLC). Aqui, o foco está na imunoterapia com os chamados “engagers de células T bisespecíficas” (BiTEs), entre outras coisas.
Mais de 10% de todos os casos de cancro e uns bons 20% de todas as mortes associadas à malignidade são devidas ao cancro do pulmão. Ou, para o dizer de forma mais viva: a cada 18 segundos, uma pessoa morre desta doença em todo o mundo, 1.200 delas todos os dias na Europa. Mesmo que alguns sucessos terapêuticos tenham sido alcançados nos últimos anos, ainda há muito espaço para a inovação. Não só há uma grande necessidade de novas abordagens diagnósticas e terapêuticas, como também a sua implementação na prática necessita urgentemente de melhorias.
KRAS como um alvo terapêutico
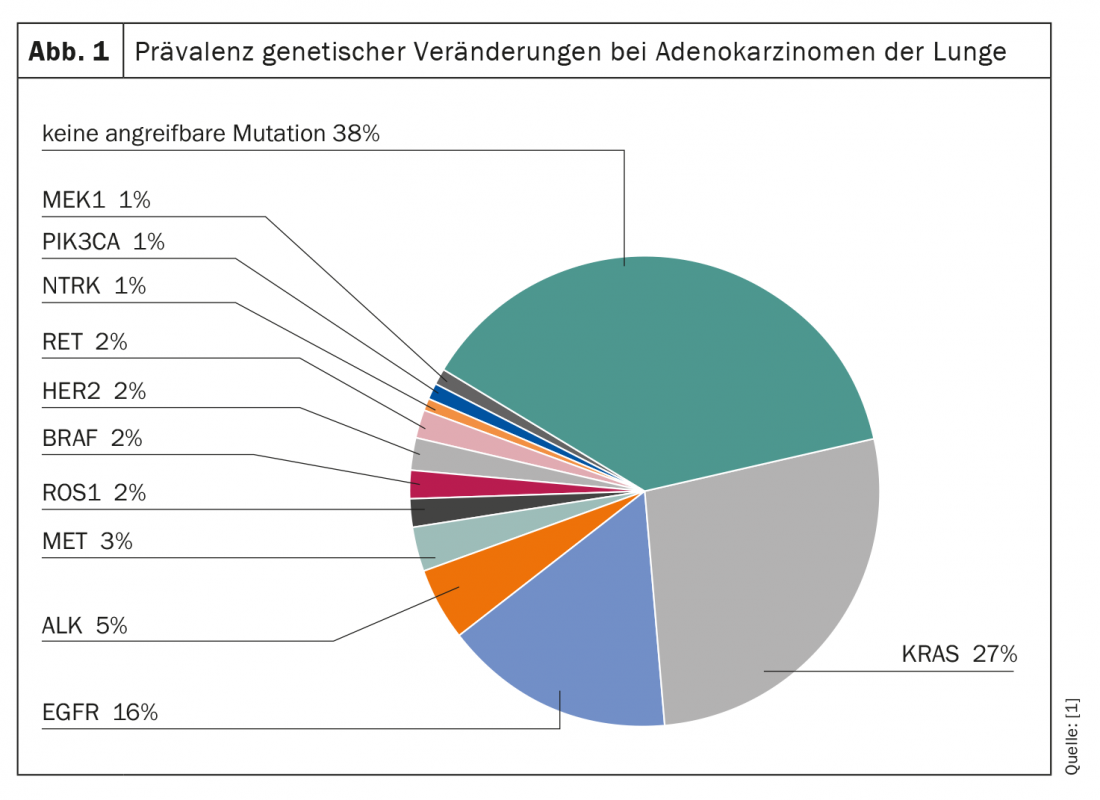
As alterações genéticas são generalizadas no cancro do pulmão (Fig. 1) . Em todos os subtipos, a proteína G KRAS representa a molécula mais frequentemente mutante e potencialmente atacável. Por exemplo, cerca de 27% de todos os adenocarcinomas do pulmão têm uma mutação do gene KRAS. No entanto, enquanto outras mutações, tais como as dos genes EGFR e ALK, já estão a ser alvo terapêutico, o KRAS tem sido considerado desde há muito um “alvo não combatível”. Em particular, o pequeno tamanho, a superfície lisa e a ausência de bolsas de ligação adequadas tornam difícil o ataque selectivo.
Com o desenvolvimento do pequeno inibidor de moléculas Sotorasib, foi conseguido pela primeira vez um bloqueio clinicamente aplicável das proteínas KRAS modificadas por G12C. Cerca de 50% dos NSCLC com mutação KRAS transportam este subtipo da mutação. O novo composto liga-se selectiva e irreversivelmente ao alvo anteriormente pensado impossível e iniciou assim, em certa medida, uma mudança de paradigma na terapia orientada – não apenas no cancro do pulmão. Desde que a primeira dose foi administrada em 2018, já foram publicados alguns resultados promissores de ensaios clínicos. Por exemplo, no ensaio da fase II CodeBreaK 100, que incluiu 126 pacientes com pelo menos uma terapia prévia, o controlo da doença foi visto em mais de 80% dos casos em que a monoterapia foi administrada com soterasib, e três pacientes tiveram mesmo uma resposta completa. Em 43 pacientes, o volume do tumor diminuiu em pelo menos 30%. A resposta mediana durou dez meses e foi detectável após 1,4 meses. Na altura do corte dos dados, 43% dos inquiridos ainda estavam em tratamento com soterasib. A sobrevivência sem progressão mediana (PFS) também foi convincente na análise dos dados. Foram 6,8 meses sob tratamento Sotorasib.
Em comparação com as opções anteriores na terapia de segunda linha para esta população de pacientes, a nova substância representa uma alternativa significativamente melhor com base nos dados actuais. Sob os actuais regimes de tratamento, a sobrevivência sem progressão após falha da terapia de primeira linha é de cerca de 4,5 meses, com taxas de resposta de um máximo de 20% para a segunda linha de terapia. Não só na área da eficácia o sororasib tem sido capaz de levantar alguma esperança até agora, mas também na segurança e tolerância. As reacções adversas relatadas foram geralmente leves e não se registaram mortes devido à medicação. Apenas 7,1% dos pacientes tiveram de interromper o tratamento devido aos efeitos secundários. Aqui, o foco principal foi a diarreia e as náuseas. Além disso, em alguns casos houve aumentos de enzimas hepáticas e fadiga.
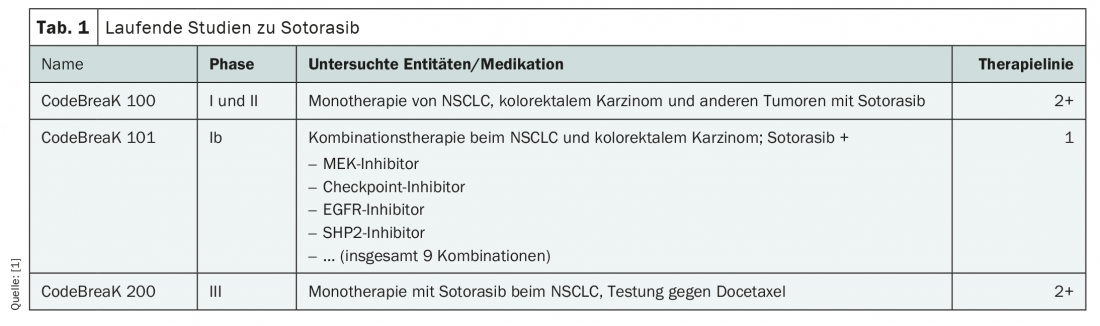
Estão actualmente em curso numerosos ensaios clínicos para a aplicação do novo agente, tanto nas linhas avançadas de terapia como na primeira linha (Tab. 1). Até agora, o soterasib é o inibidor KRASG12C mais estudado. Esperam-se novos dados já este ano, em particular do ensaio CodeBreaK 101 fase Ib para utilização como terapia de combinação de primeira linha em NSCLC e cancro colorrectal. Um pedido de aprovação para tratamento de segunda linha de NSCLC avançado com mutação KRASG12C já foi submetido à Agência Europeia de Medicamentos (EMA).
Esperança silenciosa também para a pequena célula
Tal como na ausência de mutações de carga no NSCLC, os medicamentos oncológicos alvo não desempenham actualmente um papel no cancro do pulmão de pequenas células (SCLC). Este tipo de cancro do pulmão é responsável por cerca de 13% de todos os casos e ainda tem um prognóstico desfavorável. Durante mais de quarenta anos, a quimioterapia tem sido o foco do tratamento; as abordagens imunoterapêuticas não têm sido convincentes até agora. No entanto, isto poderá mudar em breve com o desenvolvimento de anticorpos bi-específicos, os chamados “bi-specific T-cell engagers” (BiTEs).
A imunoterapia usando BiTEs baseia-se na activação do potencial citotóxico das próprias células T do organismo. Para este fim, os engenhadores de células T têm dois domínios de anticorpos variáveis: um é dirigido contra um antigénio tumoral e difere dependendo da entidade, o outro liga o CD3 na superfície das células T citotóxicas. Até agora, mais de 3000 pacientes já foram tratados com esta tecnologia. Isto está a ser investigado a toda a velocidade no campo das doenças hematológicas e malignas sólidas. Actualmente, o foco de interesse é a utilização no carcinoma da próstata, carcinoma do pulmão de pequenas células, mieloma múltiplo e carcinoma gástrico. Vários tratamentos combinados e sequenciais estão também a ser testados para prevenir uma potencial resistência. Actualmente, apenas uma terapia BiTE é aprovada a nível mundial e na Suíça para o tratamento da leucemia linfoblástica aguda: Blinatumomab (Blincyto®).
No carcinoma pulmonar de pequenas células, o domínio variável de BiTEs chamado AMG 757 visa a molécula de superfície DLL3, que é upregulada em células malignas. Os ensaios da Fase I estão actualmente em curso. Os dados iniciais mostram uma taxa de controlo de doenças de 37% após um seguimento de onze meses. Dados a mais longo prazo continuam por ver, mas poderá haver aqui algum movimento num futuro próximo numa área que tem estado sossegada há muito tempo.
Verificação do mundo real: padrões desiguais, disponibilidade não garantida
Por mais inovadoras, avançadas e eficazes que as novas terapias possam ser, é muitas vezes difícil implementá-las na prática clínica diária. Com abordagens terapêuticas mais complexas, uma multiplicidade de ensaios clínicos e diversos biomarcadores, as exigências sobre a gestão de doentes com cancro do pulmão estão a aumentar. A doença, que ainda é tratada em muitos lugares sem testes genéticos mais precisos, está cada vez mais a assumir diferentes rostos através da identificação de cada vez mais alvos que podem ser utilizados em terapia. Devido à percepção do cancro do pulmão como um padrão de doença histológico, geneticamente e fenotípico heterogéneo, novas opções terapêuticas estão a emergir a um ritmo acelerado. É frequentemente difícil integrá-los na rotina clínica, explica a Dra. Anne-Marie Baird, presidente da organização de doentes Lung Cancer Europe (LUCE). A medicina personalizada ainda não corresponde à realidade em grandes partes da Europa. Assim, os desenvolvimentos positivos no campo das substâncias disponíveis hoje em dia infelizmente não servem todos os afectados de longe. De acordo com isto, 31-50% dos doentes na Europa não sabem se tiveram testes de biomarcadores. Segundo Baird, existem diferenças regionais significativas não só na área do diagnóstico padrão, mas também na disponibilidade de medicamentos eficazes.
As rápidas mudanças no panorama terapêutico do cancro do pulmão levam à desigualdade na gestão e levantam muitas questões sobre o procedimento ideal na prática clínica. Muitas vezes não é claro quem deve ser testado para quê e quando. Além disso, escolher a droga certa e a melhor sequência pode ser hoje em dia um grande desafio. Além de expandir o acesso ao diagnóstico e à terapia, Baird cita como objectivos para os próximos anos a investigação sobre marcadores preditivos robustos e o desenvolvimento de directrizes claras relativamente aos testes genéticos. Se estes puderem ser implementados, os doentes com cancro do pulmão poderão em breve beneficiar de terapias ainda mais potentes – idealmente independentemente do local onde vivem. É bem possível que o soterasib e o BiTEs também desempenhem um papel neste contexto.
Amgen Europa
Fonte:
- Media briefing “Transforming targeted lung cancer care”, 01.02.2021, Amgen Europe Corporate Affairs
InFo ONCOLOGy & HEMATOLOGy 2021; 9(2): 30-31