A pleura é uma camada serosa que cobre os órgãos torácicos e o lado interno do esqueleto da cavidade torácica. A pequena quantidade normal de líquido pleural responsável pelo deslizamento pleural não irritante é produzida e reabsorvida através de vias linfáticas, principalmente na pleura parietal.
A pleura é uma camada serosa que cobre os órgãos torácicos e o lado interno do esqueleto da cavidade torácica. A pressão fisiológica negativa no espaço pleural para manter uma pressão transpulmonar positiva é de -3-5 cm H2O. A pequena quantidade normal de líquido pleural responsável pelo deslizamento pleural não irritante é produzida e reabsorvida através de vias linfáticas, principalmente na pleura parietal. Esta capacidade pode aumentar por um factor de até 20 dependendo da procura, pelo que uma derrame pleural relevante só ocorre com um aumento significativo da quantidade de fluido produzido ou com uma capacidade de reabsorção reduzida. O diafragma tem a função de bomba para isso, o que também contribui para a homeostase pleural.
O exame ultra-sonográfico do tórax e pleura deve, idealmente, ser realizado numa posição sentada. Sonograficamente, cerca de 70% da pleura pode então ser vista, e as partes da pleura cobertas por costelas ainda podem muitas vezes ser vistas inclinando o transdutor. Para obter uma visão geral, o exame deve ser iniciado com um transdutor convexo (3-5 MHz); para uma avaliação mais detalhada das estruturas próximas do transdutor na parede torácica, a utilização adicional de um transdutor linear de maior frequência pode então ser útil. As ondas sonoras são reflectidas a partir de interfaces com uma elevada diferença de impedância, pelo que a superfície das costelas, bem como a pleura visceral, são uma barreira natural à imagem ultra-sónica.
Pleurasono como o método de detecção mais sensível
A detecção de fluido na cavidade pleural foi uma das primeiras e continua a ser uma das questões mais importantes no diagnóstico clínico por ultra-sons. Mesmo as menores quantidades de líquido podem ser detectadas por sonografia – muito antes do que na tomografia computorizada ou mesmo em raios X. Existem várias fórmulas simples para quantificar a quantidade de efluentes, que podem ser particularmente importantes para o controlo do progresso. A reprodutibilidade do exame e da posição do transdutor é importante para isso. Na prática clínica diária, por exemplo, uma medida simples da altura do derrame subpulmonar, ou seja, a distância entre o bordo inferior do pulmão e o diafragma, é muito prática: assim é possível distinguir entre derrame baixo (<2 cm), moderado (2-5 cm) e grande (>5 cm). Com a crescente experiência de exame, este é um procedimento suficiente para a rotina clínica, uma vez que a quantidade absoluta de efusão não é normalmente importante. Todas as fórmulas de estimativa de volume só podem ser utilizadas para drenagem livre e não para efusões pleurais encapsuladas ou septadas.
Os derrames pleurais podem ter uma variedade de causas. A imagem ultra-sonográfica do derrame por si só muitas vezes não fornece informação suficiente para determinar a causa do derrame. No entanto, a sonografia oferece vantagens consideráveis, especialmente em comparação com a tomografia computorizada:
- Sem radiações,
- uma representação significativamente melhor das estruturas sólidas delicadas na efusão,
- como procedimento em tempo real, além disso, proporciona uma avaliação dinâmica do deslizamento pulmonar, bem como da ventilação e do fluxo sanguíneo.
A causa da atelectasia pode muitas vezes ser diferenciada sonograficamente
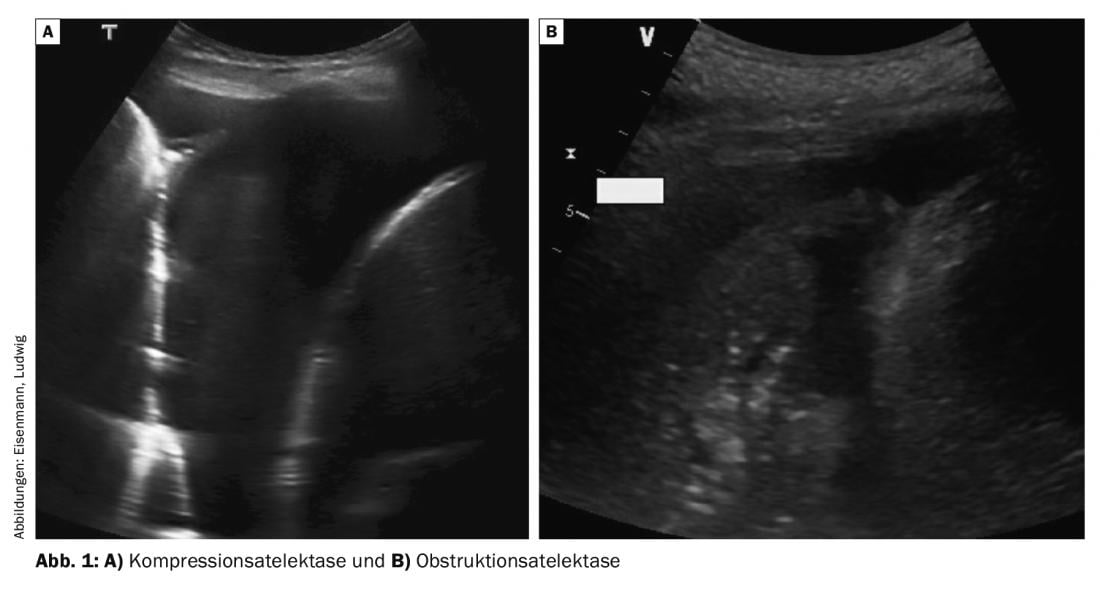
As efusões maiores causam o deslocamento caudal do diafragma e o pulmão adjacente – inicialmente o lóbulo inferior – é comprimido. Esta atelectasia de compressão homogénea move-se em sincronia com a respiração e o pulso na efusão (o chamado “dedo ondulante”) e pode frequentemente ser parcialmente re-ventilada durante a inspiração profunda (fig. 1A) . Na dispneia, a toracocentese terapêutica pode alcançar rápida expansão e assim alívio sintomático nesta situação. Em contraste, no caso de obstrução central das vias aéreas (por exemplo, devido a tumor, secreção ou corpo estranho), existe atelectasia obstrutiva, que se apresenta como menos comprimida e pouco móvel (Fig. 1B). Muitas vezes, os brônquios cheios de fluido devido à retenção de secreções também podem ser visualizados (fluidobronchogram). A quantidade de derrame pleural é normalmente menor nas atelectasias obstrutivas; a punção terapêutica do derrame para aliviar a dispneia não é eficaz a menos que a causa brônquica seja também corrigida.
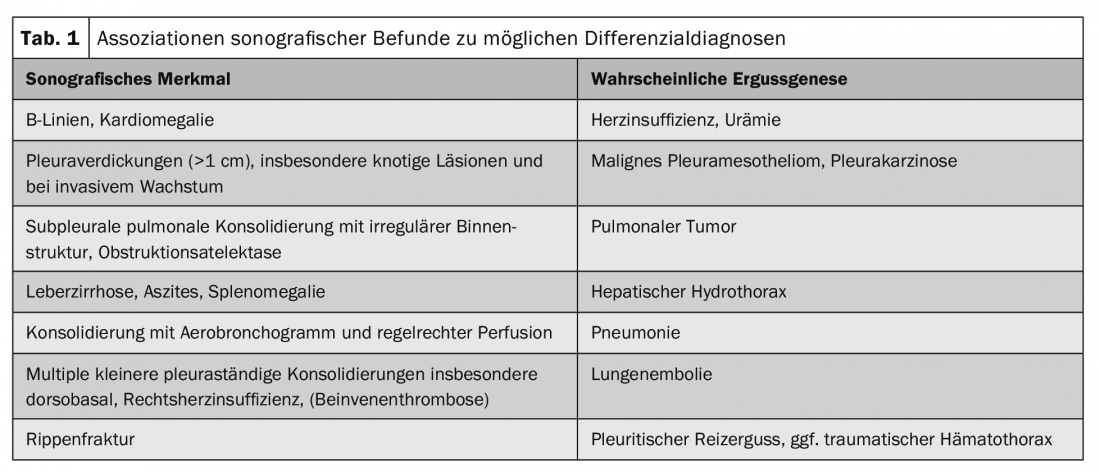
Indicações sonográficas adicionais da génese do derrame podem ser obtidas a partir de descobertas concomitantes em estruturas adjacentes (Quadro 1).
Punção pleural sob visão ultra-sonográfica
Cada derrame pleural deve ser perfurado uma vez diagnosticado. No caso de efusões bilaterais, isto deve ser feito separadamente e, se necessário, em dois lados, uma vez que pode haver causas diferentes. Os furos de efusão e os sistemas de drenagem são realizados na margem superior das costelas. Qualquer curso vascular aberrante deve ser excluído por sonografia antes da punção. Isto evita geralmente de forma fiável lesões nos vasos intercostais e nos cordões nervosos.
A monitorização da punção pode ser realizada – análoga à punção vascular, por exemplo – através da visualização contínua do instrumento de punção inserido; em caso de possível contacto do instrumento de punção com o transdutor, deve ter-se o cuidado de garantir uma esterilidade absoluta. Para grandes quantidades de fluido, por outro lado, a marcação sonográfica do local da punção também é suficiente.
Para a avaliação da efusão, é feita uma distinção entre um transudado e um exsudado com base no perfil paraclínico da efusão, utilizando os critérios de Luz. Os parâmetros essenciais aqui são os rácios soro/saída de proteínas, glucose e LDH. Uma efusão pleural pouco clara deve também ser examinada microbiologicamente, mas isto muitas vezes não permite uma determinação fiável do agente patogénico. A sensibilidade é frequentemente melhorada através de uma biopsia adicional da pleura parietal para observação de material microbiológico.
Para evitar edemas de reexpansão clinicamente significativos, é comum limitar a quantidade que pode ser perfurada numa sessão a 1-1,5 litros, embora os dados não forneçam provas convincentes. Para efusões maiores, a drenagem fraccionada através de um cateter de lúmen fino é, portanto, uma opção, de modo a evitar traumas de perfuração repetidos. Isto pode ser colocado utilizando a técnica de Seldinger, por exemplo.
Após a punção, é sempre necessário um controlo por imagem para excluir um pneumotórax. O uso da sonografia também deve ser aprendido para isto e as imagens de raios X devem ser evitadas. Em particular, a exclusão de um pneumotórax é, com um pouco de prática, mais fiávelmente possível com a sonografia do que com um raio-X.
A sonografia detalhada é útil para questões especiais
Uma sonografia detalhada pode fornecer informações adicionais para as seguintes questões:
Efusão parapneumónica, empiema: efusões pleurais parapneumónicas desenvolvem-se em cerca de metade de todos os doentes com pneumonia. Clinicamente, isto pode ser suspeito assim que uma dor pleurítica inicial é suspensa na pneumonia. Na maioria das vezes, é uma efusão passiva, estreita e descomplicada. Em 10% dos casos, porém, segue-se um derrame pleural maior e mais complicado ou um empiema pleural. Por conseguinte, a pleuropneumonia grave, em particular, deve ser monitorizada por imagens durante o tratamento; idealmente, uma imagem de ultra-som pode então ser utilizada como um achado de base para comparação.
Sonograficamente, as diferentes fases de derrame parapneumónico e empiema pleural podem ser bem distinguidas umas das outras e também melhor do que por tomografia computorizada (tab. 2).

Tumores pleurais: É feita uma distinção entre alterações pleurais benignas e malignas. As alterações malignas clinicamente muito mais frequentes dividem-se em alterações primárias e secundárias.
Sonograficamente, é reconhecível um alargamento da pleura parietal, que pode ser claramente >1 cm em achados malignos, tem uma superfície irregular, ocasionalmente também causa alterações nodulares e pode crescer para a parede torácica. A sonografia duplex ou a utilização de meios de contraste de ultra-sons pode detectar a neovascularização patológica. O exame deve ser realizado com um scanner linear e uma frequência sonora elevada, uma vez que isto proporciona uma óptima resolução de distância de grande plano.
Mesotelioma pleural: Na malignidade pleural primária, o mesotelioma pleural é uma doença rara. Ocorre ocasionalmente de forma esporádica e muito mais frequente em relação a uma história de exposição ao amianto. Os sintomas clínicos desenvolvem-se lentamente e são inicialmente incaracterísticos. As indicações ultra-sonográficas de mesotelioma são grandes massas tumorais e infiltração na parede torácica (e dor associada).
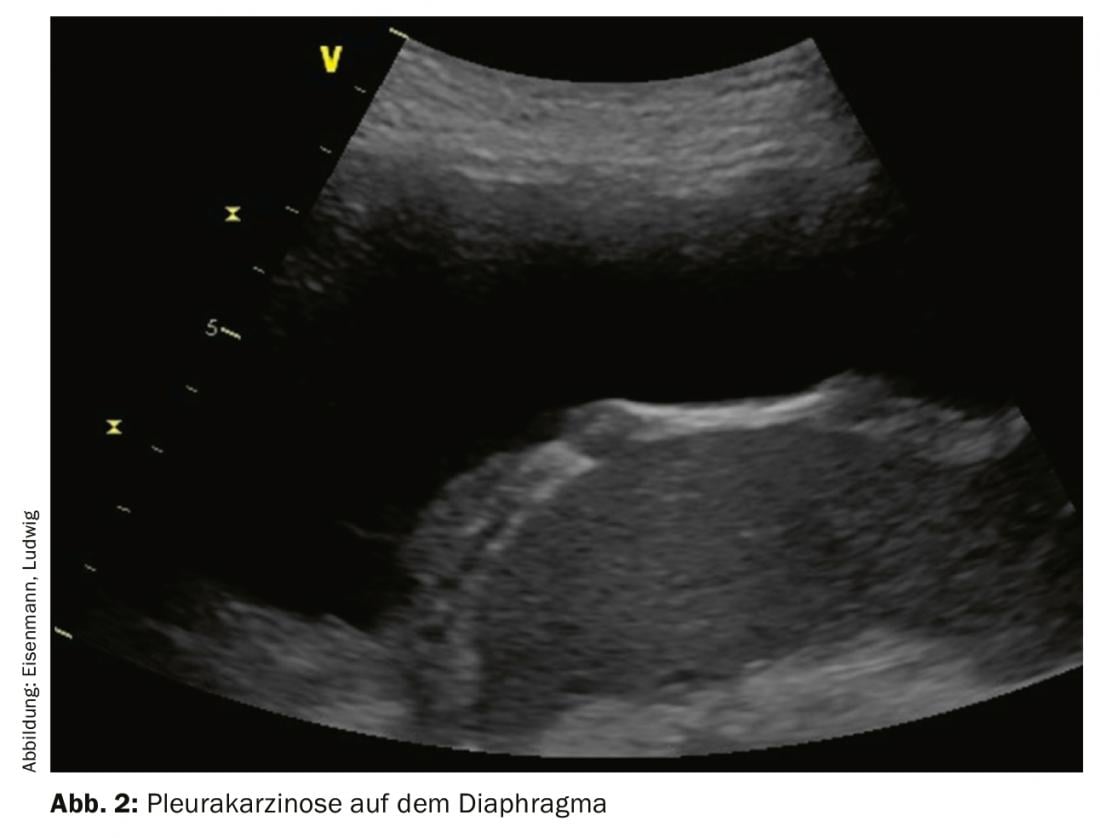
As efusões pleurais malignas ocorrem em até 15% de todos os pacientes com tumores, estão associadas a um aumento da morbilidade e mortalidade e marcam frequentemente a transição para uma fase de tumor paliativo. Causas extratorácicas comuns são o carcinoma da mama, o carcinoma gástrico e o linfoma. A malignidade não pode muitas vezes ser detectada por perfuração: A sensibilidade e a especificidade da citologia do derrame são apenas 58% e 97%, respectivamente, em todas as entidades tumorais. Um achado sonográfico típico da pleura parietal pode ajudar a questionar falsos achados citológicos negativos e indicar a toracoscopia. A pleura mostra mais frequentemente espessamento nodular e não homogéneo, de preferência dorsobasal e também na parte diafragmática (Fig. 2). Um alargamento de mais de 10 mm, em particular, é suspeito de malignidade, até prova em contrário. Em particular, grandes volumes inexplicáveis e efusões unilaterais devem sugerir malignidade.
O primeiro passo deve, portanto, ser uma punção de efusão de diagnóstico. Particularmente no caso da anamnese do amianto, contudo, devem ser procurados prontamente ou já principalmente procedimentos alternativos para a recolha de tecidos histológicos, a fim de aumentar o rendimento e a segurança dos espessantes pleurais malignos e suspeitosos. Em caso de dúvida, contudo, é indicada a toracoscopia, durante a qual a pleurodese pode ser realizada, para além da confirmação do diagnóstico. Antes da toracoscopia, a posição dos trocartes também deve ser assegurada sonograficamente imediatamente antes da sua colocação.
Capacidade de expansão antes da toracocentese
Há frequentemente dispneia com grandes volumes e efusões pleurais de rápida recorrência. Antes de uma toracocentese terapêutica fazer aqui sentido, é necessário esclarecer primeiro, especialmente no caso de génese de derrame maligno, se o derrame e o pulmão ainda podem ser suficientemente mobilizados. Caso contrário, se o pulmão estiver amarrado, existe o risco de um seropneumotórax, que se voltaria a encher consecutivamente de líquido. Esta constelação é chamada de “pulmão encurralado “. As indicações para tal podem já ser a falta de inflação inspiratória ou a redução antecipada da motilidade pulsante-síncrona, que pode ser documentada através da utilização do modo M. Outra opção, embora muito mais complexa, é a de medir a pressão intrapleural. Caso contrário, se a perfuração não for crítica, um pneumotórax formará um ex vacuo, que se encherá rapidamente de líquido novamente, devido à falta de expansão. A pleurodese química primária também não tem qualquer hipótese de sucesso aqui, pelo que deve ser inserido um cateter pleural tunelado ou, dependendo do estado geral, deve ser tentada a decorticação cirúrgica torácica das massas tumorais viscerais.
Pneumotórax: A sonografia torácica é pelo menos um método equivalente ao tórax de raios X, especialmente para a exclusão do pneumotórax, e faz parte da Directriz Alemã de Pneumotórax actualizada em 2018. A situação do estudo é clara, mostra uma maior sensibilidade e uma especificidade comparável. Especialmente na posição supina, por exemplo com pacientes em cuidados intensivos ou após intervenções como a amostragem de tecido broncoscópico ou cateterização venosa central (porto, CVC), a ecografia à beira do leito deve ser utilizada como método de primeira escolha para excluir o pneumotórax. A escolha do transdutor é geralmente secundária, uma vez que as características listadas abaixo são reconhecíveis com todas as variantes de transdutores. Espera-se que os dispositivos de bolso, que podem ser ligados a comprimidos ou telemóveis, tornem as coisas ainda mais fáceis.
Características simples do pneumotórax
Utilizando um procedimento de exame esquemático, devem ser trabalhados os seguintes critérios:
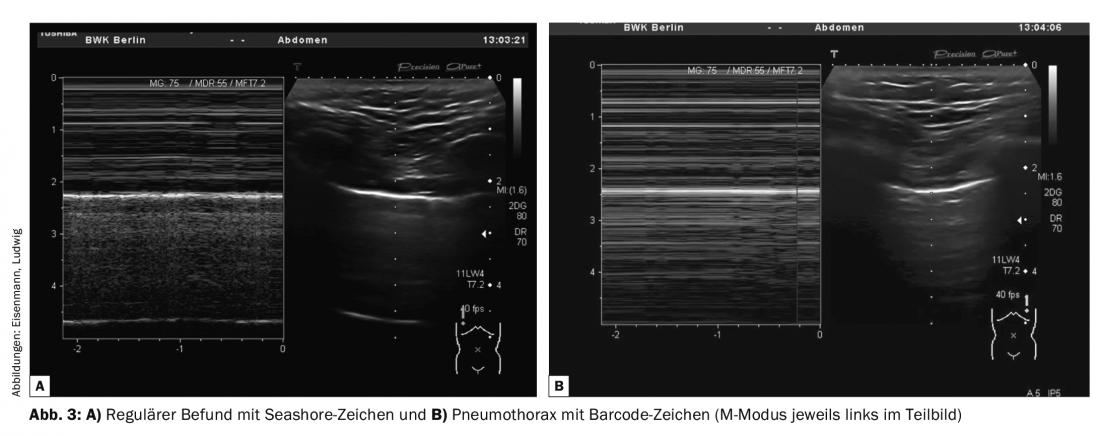
- Deslizamento pleural – Deslizamento respiratório-síncrono das folhas pleurais, possivelmente com evidência de linhas B ou estruturas pleurais. Utilização aditiva do modo M possível com detecção do sinal Seashore em caso de descobertas normais ou sinal de código de barras em caso de pneumotórax (Fig. 3).
- Pulso pulmonar – pulsação síncrona da pleura visceral, detectável directamente ou com a ajuda de Doppler de cor.
- Ponto pulmonar – ponto de transição síncrono respiratório entre o pneumotórax e a pleura visceral adjacente, visível apenas no pneumotórax parcial.
A sonda de ultra-sons é colocada no ponto mais alto do tórax (dependente da posição! Em posição supina: ventral na posição Monaldi). Se um deslizamento pleural e/ou um pulso pulmonar puder ser detectado aqui através dos espaços intercostais adjacentes, um pneumotórax é praticamente excluído. No entanto, a ausência destes critérios não é uma prova definitiva de um pneumotórax. Em particular, o deslizamento pleural pode ser severamente limitado ou abolido em casos de hiperinflação pulmonar, grandes bolhas, sob ventilação invasiva (especialmente ventilação por jacto) e aderências pleurais (após empiema ou cirurgia anterior). Na ausência de evidência de deslizamento pleural e pulso pulmonar, procura-se então um ponto pulmonar por deslocamento lateral no respectivo espaço intercostal. Se isto for detectável, prova a presença de um pneumotórax.
Devido às fontes de erro descritas, a apresentação pré-intervencional dos resultados iniciais é útil, e deve ser sempre feita uma comparação lado a lado. Devem ser realizadas imagens alternativas se os resultados não forem claros.
No entanto, não é possível estimar de forma fiável o tamanho do pneumotórax por ultra-sons. A decisão de terapia deve ser tomada no contexto da condição clínica e da génese do pneumotórax. Um pneumotórax pós-intervencional, por exemplo, pode ser tratado de forma conservadora se for detectado um ponto pulmonar e o paciente estiver assintomático, se o controlo clínico e sonográfico puder ser possibilitado a curto prazo. A localização do ponto pulmonar é marcada na pele para este fim e brevemente verificada de novo. Desta forma, a dinâmica do pneumotórax pode ser reconhecida. O sucesso do tratamento através de drenagem ou sucção única também pode ser rastreado por ultra-sons e não requer necessariamente um raio-X.
Mensagens Take-Home
- A sonografia é o principal método de imagem para detectar e quantificar efusões pleurais.
- As características sonográficas no derrame, pleura parietal ou pulmões são úteis para a diferenciação etiológica.
- A localização do local da punção de efusão pleural é necessária por via sonográfica para evitar lesões acidentais nas estruturas vasculares e no tecido pulmonar.
- O pneumotórax pós-intervencional deve ser descartado por ultra-sons à beira do leito. Isto torna frequentemente desnecessário um raio-x.
- Deve ser realizada uma única sonografia para cada pneumonia. As efusões parapneumónicas maiores devem ser perfuradas para aliviar a pressão; pequenas efusões devem ser verificadas ultra-sonograficamente.
- Dor torácica após perfuração pleural que se pensa ser aliviante indica falta de capacidade de expansão na ausência de pneumotórax.
- Um pneumotórax pode ser excluído com certeza por via sonográfica, mas ocasionalmente não provado. A extensão do pneumotórax não pode ser avaliada com certeza por sonografia.
Literatura:
- Beckh S, Blank W, Kubale R et al. Norma de exame para ultra-sonografia transtorácica em medicina – European Journal of Ultrasound 2006; 27(03): 287-288.
- Volpicelli G, Elbarbary M, Blaivas M et al. Recomendações internacionais baseadas em provas para ultra-sons pulmonares de ponto de tratamento. Intensive Care Med 2012; 38: 577-591.
- Sociedade Alemã de Pneumologia e Medicina Respiratória (DGP), Sociedade Alemã de Infecciologia (DGI), (PEG) P-E-GfCeV. Orientação S3 “Tratamento de doentes adultos com pneumonia adquirida na comunidade e prevenção – Actualização 2016”. In: (AWMF) AdWMF ed. www.awmf.org/leitlinien/detail/ll/020-020.html; 2016
- Schnell J, Beer M, Eggeling S, et al: Gestão de Pneumotórax Espontâneo e Pneumotórax Pós-intervencional: S3-Guideline alemã. Zentralblatt fur Chirurgie 2018; 143: S12-s43.
- Joyner Jr. CR, Herman JR, Reid JM: Ultra-som reflectido na detecção e localização de efusão pleural. JAMA 1967; 200: 399-402.
- Light RW, Macgregor MI, Luchsinger PC, et al: efusões pleurais: a separação diagnóstica de transudados e exudados. Anais de medicina interna de 1972; 77: 507-513.
- Tasci S, Ewig S, Lüderitz B: Diagnóstico e terapia de efusões pleurais parapneumónicas e empiema. Dtsch Arztebl 2004; 101: A 638-648.
- Bibby AC, Dorn P, Psallidas I, et al: Declaração do ERS/EACTS sobre a gestão de efusões pleurais malignas. Jornal Respiratório Europeu 2018; 52.
- Feller-Kopman DJ, Reddy CB, DeCamp MM, et al: Gestão de Efeitos Pleurais Malignos. Uma Directriz Oficial de Prática Clínica ATS/STS/STR. American journal of respirator y and critical care medicine 2018; 198: 839-849.
- Mathis G: Atlas de imagem da sonografia pulmonar. 6ª edição. ed: Springer-Verlag Berlin Heidelberg; 2016.
InFo PNEUMOLOGIA & ALERGOLOGIA 2019; 1(3): 18-22.