Uma abordagem promissora para a terapia da esclerose múltipla reside no tratamento específico de antigénios. Destina-se a inibir especificamente a resposta imunológica auto-reactiva, a fim de evitar os riscos de imunossupressão global.
As doenças imuno-mediáticas, tais como as doenças auto-imunes, têm sido até agora tratadas por terapias imunossupressoras não específicas e globais. Isto resulta frequentemente em efeitos secundários e riscos acrescidos de complicações. A esclerose múltipla (EM) é uma doença auto-imune paradigmática do sistema nervoso central. O desenvolvimento de novas terapias para a EM tem sido muito bem sucedido ao longo da última década, e temos agora uma variedade de medicamentos novos e altamente eficazes à nossa disposição. No entanto, todas estas imunoterapias têm um efeito não específico e conduzem a uma imunossupressão por vezes mais profunda, que está associada aos efeitos secundários conhecidos e por vezes a riscos elevados. Outra consequência é uma restrição em muitas áreas da vida como o planeamento familiar, as vacinas e as viagens.
O desenvolvimento de terapias específicas de antigénios que tratam com elevada selectividade apenas as partes do sistema imunitário responsáveis pela inflamação auto-reactiva teria o potencial de tratar a doença próximo da sua causa e evitar os riscos de imunossupressão global [1]. A implementação bem sucedida desta estratégia terapêutica seria um marco importante na medicina e um passo em frente na medicina de precisão.
Após estudos iniciais com terapias específicas de antigénios que, na sua maioria, não conseguiram alcançar o sucesso esperado, tem havido progressos importantes neste campo nos últimos anos, de modo que uma implementação bem sucedida deste conceito terapêutico promissor está ao nosso alcance. Estas incluem estratégias terapêuticas inovadoras, que estão já em desenvolvimento clínico precoce, e a identificação de novos antigénios alvo da resposta imunitária auto-reactiva dos doentes com EM, o que permitirá abordagens inteiramente novas às terapias específicas dos antigénios [2,3].
Um pré-requisito essencial para o desenvolvimento de terapias específicas de antigénios é uma boa compreensão da patogénese da doença e dos antigénios alvo da resposta imunitária auto-reactiva. A causa da EM não é conhecida, mas pensa-se que tanto os factores ambientais como genéticos contribuem para o aparecimento e progressão da doença. De longe o factor genético mais importante é um antigénio leucocitário humano específico (HLA), uma molécula de superfície responsável pelo reconhecimento de antigénios pelas células T e, portanto, um factor importante na caracterização das respostas imunitárias individuais. Em média, 50% dos doentes com EM são portadores do principal alelo de risco HLA DRB1*1501, estando o restante dividido entre vários outros alelos HLA. O tipo individual de HLA deve, portanto, ser tido em conta no futuro ao testar terapias específicas de antigénios em doentes com EM. Além disso, há uma série de descobertas que sugerem uma resposta imunitária mediada em EM dirigida contra autoantigénios específicos [4].
O espectro antigénico na EM
Vários antigénios alvo diferentes foram descritos na esclerose múltipla. Com base na fisiopatologia com foco na desmielinização no SNC, foram investigadas em particular as proteínas da camada de mielina dos neurónios no cérebro e na medula espinal. As proteínas mais importantes neste contexto são a proteína básica da mielina (MBP), a proteína proteolipídica (PLP) e a oligodendrocite gilocoproteína de mielina (MOG). Em vários modelos animais em ratos, ratos e macacos, uma resposta imunitária induzida contra uma destas proteínas pode desencadear uma doença desmielinizante inflamatória que se assemelha à EM em muitas características. Esta reacção imunitária é sobretudo dirigida contra algumas sequências de peptídeos destas proteínas, que são descritas como imunodominantes. Curiosamente, estes peptídeos imunodominantes em animais sobrepõem-se em grande medida às reactividades imunitárias encontradas em doentes com EM [4]. Num estudo de doentes com EM, sete péptidos de mielina (MOG1-20, MOG35-5, MBP13-32; MBP83-99, MBP111-129, MBP146-170, PLP139-154) foram identificados a partir de um maior número de péptidos imunodominantes das proteínas da mielina MBP, PLP, MOG e da fosfodiesterase cíclica nucleotídica (CNP) para os quais a reactividade diferia em doentes com EM dos controlos [5]. Este conjunto de peptídeos serve agora como base para terapias específicas de antigénios em várias abordagens.
Além das proteínas de mielina, outras proteínas podem desempenhar um papel importante como antigénios alvo da resposta imunitária auto-reactiva no SNC, e mais recentemente dois novos candidatos foram identificados como antigénios alvo importantes em doentes com EM. Em contraste com os estudos anteriores, que se baseavam essencialmente em conceitos fisiopatológicos pré-existentes e transferidos de modelos animais para humanos, estes estudos recentes tomaram como ponto de partida os doentes com EM e investigaram quais as sequências de péptidos que são reconhecidas pelas células T isoladas directamente do tecido cerebral inflamatório de doentes com EM [3]. A proteína TSTA3, uma L-fucose synthase do PIB, foi descoberta como um antigénio alvo da resposta imunitária auto-reactiva [3]. Um aspecto interessante e muito provavelmente patofisiologicamente relevante é que a proteína é também expressa por certas bactérias intestinais (Akkermansia), que são frequentemente encontradas em doentes com EM. Estas bactérias poderiam contribuir para a activação imunitária que depois leva ou mantém a inflamação no cérebro. Outro importante antígeno alvo é a proteína RAS Guanyl Releaseasing Protein 2 (RASGRP2), que é expressa em células B no sangue periférico, bem como no cérebro. As células T de doentes com EM, que são activadas no sangue periférico, tendem a aumentar a autoproliferação e, de preferência, migram para o cérebro, mostram uma maior reactividade contra a proteína RASGRP2 e podem ser detectadas em lesões de doentes com EM [2].
Não se pode assumir que a resposta imunitária patogénica de um doente com EM, ou na EM em geral, seja dirigida apenas contra um único antigénio, mas pode afectar vários antigénios. Além disso, foi demonstrado em modelos animais que esta auto-reactividade pode diversificar e estender-se a diferentes antigénios no decurso da doença. Nos seres humanos, há poucos dados sobre isto até à data, mas é importante porque na maioria dos casos o início da doença não está claramente estabelecido e, portanto, a cascata de diversificação, e portanto o espectro completo de antigénios no paciente individual, não é conhecido.
Mecanismos de tolerância imunitária
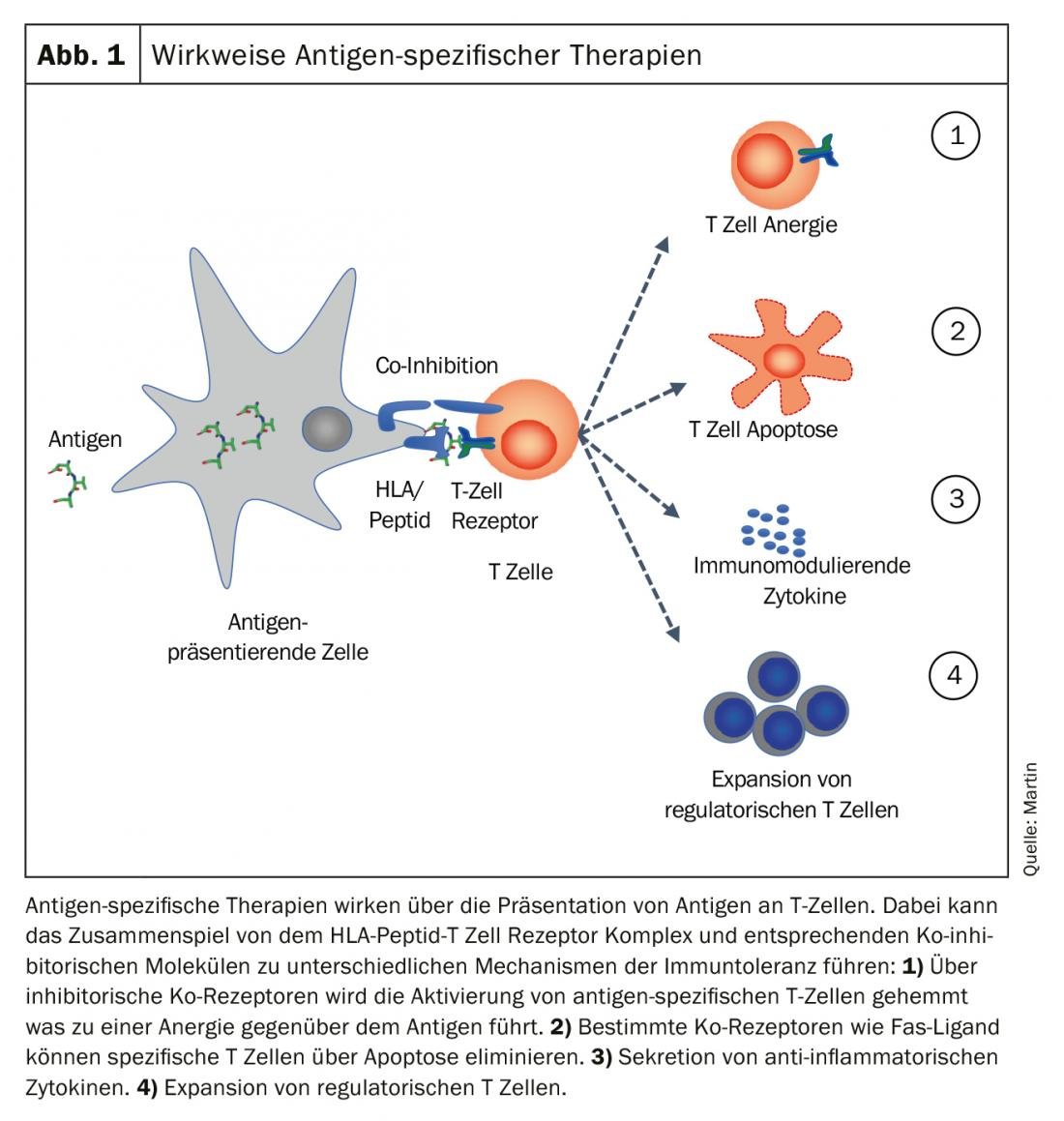
O objectivo das terapias específicas de antigénios é “restabelecer” a tolerância imunológica ao antigéneo específico. Diferentes mecanismos, isoladamente ou em combinação, podem contribuir para o estabelecimento e manutenção da tolerância imunitária. Os quatro principais mecanismos são mostrados na Figura 1.
- A célula que apresenta o antigénio pode impedir a activação de células T específicas do antigénio através de co-receptores inibitórios e gerar anergia ao antigénio.
- Co-receptores como o Fas ligand podem desencadear apoptose em células T específicas e eliminá-las.
- É criado um ambiente tolerogénico através da secreção de citocinas anti-inflamatórias e é induzida a expansão de células T reguladoras.
Terapias antigénios específicos em ensaios clínicos
Até à data, têm sido testadas diferentes estratégias com terapias específicas de antigénios em doentes com EM. A maioria destes concentrava-se quer em proteínas individuais de mielina, quer em alguns peptídeos como antigénios alvo para indução de tolerância. Apenas algumas abordagens têm usado múltiplos peptídeos de diferentes proteínas de mielina. As vias de administração testadas foram a oral, transdérmica, epi- e subcutânea e intravenosa. Após resultados negativos de estudos sobre a administração oral de mielina ou aplicação intravenosa de peptídeos MBP, vacinação com células T ou receptor de células T, algumas abordagens terapêuticas mostraram recentemente resultados positivos de estudos [1]. Um estudo da fase II investigou a administração transdérmica de três péptidos de mielina MOG35-55, MBP85-99 e PLP139-151, que foram aplicados através de um remendo no braço [6]. O estudo em 30 pacientes com EM em recidiva encontrou o ponto final do estudo de uma redução dos focos de contraste na ressonância magnética cerebral. Os autores conseguiram também mostrar uma redução de células T específicas do peptídeo a um nível mecanicista e descrever a importância das células dendríticas na drenagem dos gânglios linfáticos [7]. Outra abordagem terapêutica utiliza quatro peptídeos MBP, que são administrados por via parenteral. Um estudo da fase II em 37 pacientes recidivantes que receberam injecções intradérmicas quinzenais de péptidos MBP demonstrou uma redução significativa das lesões que aumentam o contraste na RM cerebral [8]. O efeito foi dose-dependente e persistiu durante a duração do tratamento. A injecção intramuscular de um ADN que leva à expressão da proteína MBP em células musculares foi testada em 267 pacientes. O estudo não atingiu o ponto final primário, mas foi capaz de demonstrar uma redução nas novas lesões por RM [9]. O procedimento está actualmente a ser seguido no tratamento da diabetes tipo I. Um pequeno ensaio clínico fase Ib com células dendríticas tolerogénicas confirmou a segurança e tolerabilidade do procedimento e mostrou provas de um efeito nas células imunitárias auto-reactivas [10]. No procedimento, monócitos autólogos foram obtidos por leucaférese e células dendríticas tolerogénicas (tolDCs) carregadas com peptídeos de mielina foram cultivadas in vitro. Os CDT foram injectados por via intravenosa em oito doentes com EM.
Para além da estratégia e via de administração específicas, a selecção e presumivelmente o número de antigénios alvo da terapia é importante para o sucesso do procedimento. Uma estratégia terapêutica que temos seguido nos últimos anos é a injecção intravenosa de células sanguíneas (leucócitos ou eritrócitos) que têm sido acopladas ex-vivo à superfície celular com peptídeos. A abordagem torna possível a utilização de um maior número de peptídeos e assim inibir a resposta imunitária específica de antigénios simultaneamente contra vários antigénios. Em modelos animais, isto foi muito eficaz na prevenção do aparecimento (profilático) e progressão da doença (terapêutico), e a terapia foi bem sucedida em vários modelos de doenças auto-imunes, alergias e transplantes. Além disso, as células acopladas a antigénios são o único método que se tem mostrado capaz de impedir a diversificação da resposta imunitária.
Numa primeira fase do estudo Ib em nove doentes com EM, foi investigada a segurança e tolerabilidade das células mononucleares autólogas do sangue periférico acopladas ex-vivo com sete péptidos de mielina da MOG (MOG1-20, MOG35-55), MBP (MBP1-32, MBP83-99, MBP111-129, MBP146-170) e PLP (PLP139-154) [11]. Globalmente, a terapia foi muito bem tolerada e o curso da EM permaneceu estável. Além disso, em estudos imunológicos concomitantes, não foram encontradas provas de actividade inflamatória após a terapia e nos doentes que receberam a dose mais elevada, pôde ser demonstrada uma redução das reactividades das células T específicas do peptídeo. Estes resultados também foram recentemente confirmados com eritrócitos autólogos como células portadoras tolerogénicas e foram encontradas provas de um efeito positivo a nível celular e humoral [Lutterotti et al. ECTRIMS Congress, Estocolmo, 2019]. Uma extensão desta fase do julgamento Ib está actualmente em curso. No futuro, peptídeos adicionais de novos antigénios podem ser adicionados ao procedimento, tornando-o no conjunto mais abrangente de autoantigénios utilizados num procedimento terapêutico específico de antigénios até à data.
Desafios actuais e futuros
Na era da medicina de precisão, as terapias específicas de antigénios estão de novo a tornar-se o foco de novos desenvolvimentos terapêuticos. Esta tendência é também apoiada por uma melhor compreensão da génese auto-imune da doença e pela identificação de novos antigénios alvo.
Novas tecnologias, tais como abordagens baseadas em nanopartículas e células, estão já em desenvolvimento pré-clínico precoce e irão expandir a gama de opções terapêuticas no futuro. Um grande desafio para a avaliação e comparabilidade de novas abordagens terapêuticas é a prova biológica da tolerância imunitária induzida. Até à data, não existem métodos biomédicos normalizados para confirmar uma redução da resposta imunitária autoreactiva a nível celular ou humoral após a terapia. O desenvolvimento de testes para identificar e quantificar as respostas imunitárias específicas de antigénios após terapia apropriada é um aspecto importante do desenvolvimento clínico e deve também ser utilizado para seleccionar e estratificar doentes em ensaios clínicos de terapias específicas de antigénios. O ideal seria seleccionar os pacientes com base na reactividade imunitária individual, medir a redução da resposta imunitária específica após o tratamento e correlacioná-la com a resposta clínica. Além disso, é um aspecto de segurança relevante excluir uma activação do sistema imunitário pela terapia, uma vez que tal poderia levar a um aumento da actividade da doença [12].
As terapias específicas dos antigénios irão melhorar o arsenal terapêutico para o tratamento da EM e devem, idealmente, ser utilizadas numa fase precoce da doença para prevenir uma maior propagação das respostas imunitárias auto-reactivas. A boa tolerabilidade e o elevado perfil de segurança da abordagem terapêutica são uma vantagem sobre as actuais terapias não específicas, especialmente na fase inicial da doença. No futuro, especialmente em pacientes com elevada actividade da doença, a combinação de abordagens específicas de antigénios com as terapias padrão actuais deve também ser investigada, com o objectivo de conseguir um controlo rápido da inflamação e tratar apenas com terapia específica de antigénios no curso seguinte. Isto pode evitar os riscos a longo prazo das terapias actuais.
Uma questão essencial será se a tolerância imunológica a longo prazo, ou seja, a eliminação completa da auto-reactividade mesmo após a interrupção da terapia, pode ser alcançada ou se deve ser administrada uma terapia permanente específica de antigénios para controlar a doença. Em qualquer caso, as terapias específicas de antigénios revolucionariam o tratamento da EM e de outras doenças auto-imunes e representariam um grande avanço na medicina.
Mensagens Take-Home
- As terapias específicas dos antigénios são um conceito terapêutico promissor para o tratamento da esclerose múltipla.
- O objectivo das terapias específicas de antigénios é inibir especificamente a resposta imunológica auto-reactiva e evitar os riscos de imunossupressão global.
- A identificação de novos antigénios alvo na EM é uma base importante para o desenvolvimento de terapias específicas de antigénios.
- Diferentes abordagens terapêuticas já se encontram em fases iniciais de desenvolvimento clínico e estão a mostrar o sucesso inicial no que diz respeito à sua eficácia.
Literatura:
- Lutterotti A, Martin R: Abordagens de tolerância específica a antigénios em esclerose múltipla. Expert Opinion Drugs Research Drugs 2014; 23:9-20.
- Jelcic I, Al Nimer F, Wang J, et al: Memory B Cells Activate Brain-Homing, Autoreactive CD4(+) T Cells in Multiple Sclerosis. Célula 2018; 175: 85-100 e123.
- Planas R, Santos R, Tomas-Ojer P, et al: GDP-l-fucose synthase é um autoantigénio CD4(+) específico de células T em pacientes com esclerose múltipla DRB3*02:02. Sci Transl Med 2018; 10.
- Sospedra M, Martin R: Imunologia da Esclerose Múltipla. Annu Rev Immunol 2005; 23: 683-747.
- Bielekova B, Sung MH, Kadom N, et al: Expansão e relevância funcional das células T CD4+ específicas de mielina de alta densidade em esclerose múltipla. J Immunol 2004; 172: 3893-3904.
- Walczak, A, Siger M, Ciach A, et al: Aplicação transdérmica de peptídeos de mielina no tratamento da esclerose múltipla. JAMA Neurol 2013; 70: 1105-1109.
- Jurynczyk M, Walczak A, Jurewicz A, et al: Regulação imunitária da esclerose múltipla por peptídeos de mielina aplicados transdermalmente. Ann Neurol 2010; 68: 593-601.
- Chataway J, Martin K, Barrell K et al. Efeitos da imunoterapia ATX-MS-1467 durante 16 semanas em recidiva de esclerose múltipla. Neurologia 2018; 90: e955-e962.
- Garren H, Robinson WH, Krasulova E, et al: Fase 2 do ensaio de uma vacina de ADN que codifica a mielina como proteína básica para a esclerose múltipla. Ann Neurol 2008; 63: 611-620.
- Zubizarreta I, Florez-Grau G, Vila G, et al: Tolerância imunitária em esclerose múltipla e neuromielite óptica com células dendríticas tolerantes carregadas com peptídeos num ensaio de fase 1b. Proc Natl Acad Sci U S A 2019; 116: 8463-8470.
- Lutterotti A, Yousef S, Sputtek A, et al: Antigen-specific Tolerance by Autologous Myelin Peptide-Coupled Cells – A Phase I Trial in Multiple Sclerosis. Science Translational Medicine 2013; 5: 188ra75.
- Bielekova B, Goodwin B, Richert N, et al: Potencial encefalitogénico do peptídeo proteico básico da mielina (aminoácidos 83-99) na esclerose múltipla: resultados de um ensaio clínico de fase II com um ligante de peptídeo alterado. Nat Med 2000; 6: 1167-1175.
InFo NEUROLOGIA & PSYCHIATRY 2019; 17(6): 10-13.