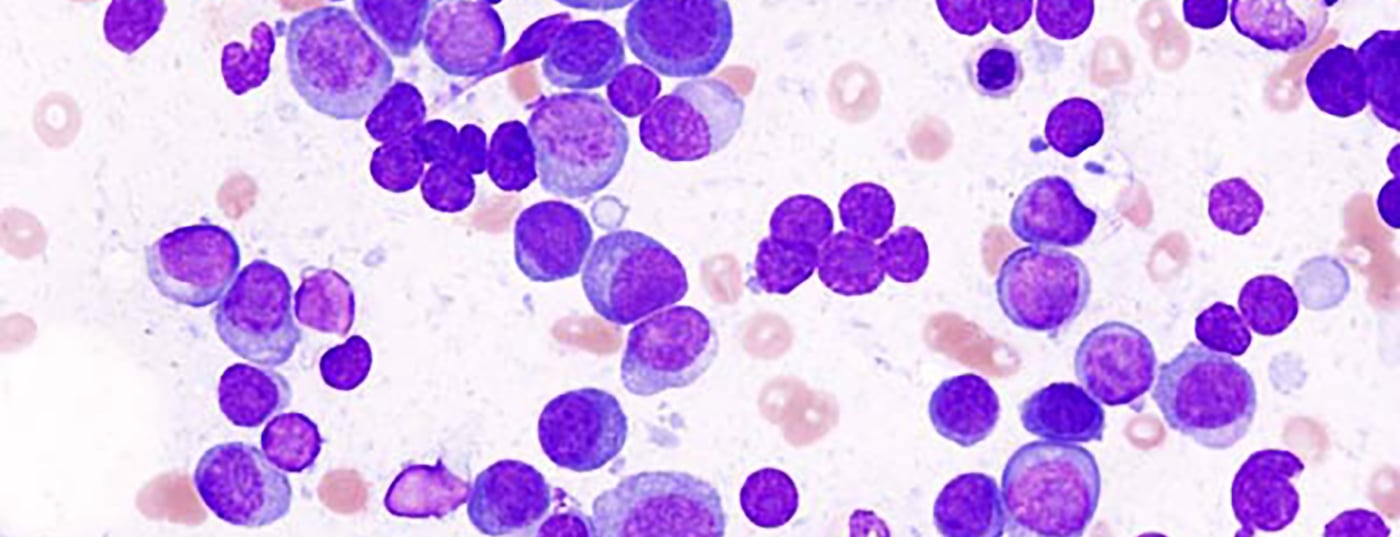
Com a aprovação de vários novos medicamentos, o espectro de tratamento para a terapia de segunda linha do mieloma de células plasma foi alargado. Em paralelo, foram questionados conceitos de tratamento estabelecidos, predominantemente em tratamento de primeira linha. Então, o que é válido neste momento?
Nos últimos quatro anos, o espectro de tratamento para a terapia de segunda linha de doentes com mieloma de plasmócitos foi alargado com a aprovação de vários novos medicamentos. Em paralelo, porém, conceitos de tratamento estabelecidos, predominantemente em tratamentos de primeira linha, foram também questionados em ensaios clínicos. Os resultados resultantes, parcialmente contraditórios, abrem um vasto campo de interpretação. Esta revisão visa fornecer um inventário das preferências actuais no tratamento do mieloma múltiplo na Suíça.
Em preparação da Reunião de Consenso Suíça da OMPE no Congresso Suíço de Oncologia e Hematologia de 2018, dez especialistas suíços em mieloma múltiplo foram questionados por escrito sobre temas controversos no diagnóstico e tratamento do mieloma múltiplo. Durante a reunião, as mesmas perguntas foram feitas aos médicos presentes. Cerca de 40 participantes responderam às perguntas (votação electrónica).
SLIM-CRAB
No final de 2014, foi publicada uma actualização dos critérios do IMWG para o diagnóstico do mieloma múltiplo [1]. A definição de mieloma ingénuo foi alargada para incluir os critérios SLIM-CRAB (Síntese 1). Isto destina-se a identificar doentes com uma probabilidade muito elevada de progressão rápida de um “mieloma de combustão lenta” para um mieloma múltiplo que requer tratamento de acordo com critérios clássicos, mesmo antes da ocorrência de danos orgânicos finais, e a iniciar o tratamento. Este conceito tornou-se agora estabelecido na Suíça.
Dois terços dos peritos entrevistados e 85% dos médicos da audiência disseram considerar sempre os critérios SLIM-CRAB ao diagnosticar o mieloma múltiplo. Um terço dos peritos e 15% dos médicos da audiência recolhem os parâmetros SLIM, mas avaliam a necessidade de tratamento em pacientes com um critério SLIM-CRAB positivo numa base individual.

Estratificação de risco genético
As alterações genéticas nas células do mieloma múltiplo estão entre os preditores mais importantes do prognóstico do doente. Um conjunto de cromossomas hiperdiplóides está subjacente a cerca de 50% dos casos de mieloma múltiplo e está associado a um prognóstico “favorável” (risco padrão). As translocações no locus IgH (por exemplo, t[4;14], t[11;14]) estão correlacionadas com diferentes agressividade do mieloma, dependendo do parceiro de fusão. Alterações genéticas secundárias adicionais são geralmente desfavoráveis em termos prognósticos (del17p, gain1q, eliminação 1p, etc.) [2]. As três melhores alterações citogenéticas estabelecidas com um perfil de risco desfavorável (del[17p], t[4;14] e t[14:16]), juntamente com a albumina e a β2-microglobulina no sistema de pontuação internacional revisto (R-ISS) (Tab. 1) e juntamente com o valor LDH no diagnóstico, permitem uma diferenciação prognóstica no que diz respeito à sobrevivência sem progressão e à sobrevivência global. A ESMO e NCCN recomendam a realização de citogenética e FISH no momento do diagnóstico.
Estas recomendações são também seguidas na Suíça: Metade dos médicos que responderam efectuam testes genéticos em todos os doentes no momento do diagnóstico, a outra metade abstém-se de testes genéticos em doentes idosos e comorbidos.

Quimioterapia de alta dose com transplante de células estaminais autólogas
O valor da quimioterapia de alta dose com transplante autólogo de células estaminais (HDT-ASCT) em terapia de primeira linha foi revisto em vários ensaios aleatórios nos últimos anos [3,4]. Houve uma sobrevivência significativamente melhor sem progressão para HDT-ASCT em comparação com a terapia “convencional” de primeira linha (VRD, VMP), mas sem prolongamento do SO. Os resultados do estudo americano StaMINA foram apresentados na ASH 2016: Aqui, nenhuma vantagem PFS foi demonstrada para os pacientes que receberam HDT-ASCT na terapia de primeira linha [5]. Contudo, devido a vários pontos de discussão na concepção do estudo StaMINA, estes resultados devem ser interpretados com cautela. A vantagem da terapia primária de alta dose em relação à terapia convencional do mieloma múltiplo em termos de sobrevivência global foi demonstrada antes da introdução de inibidores do proteasoma na terapia convencional. Formalmente falando, na era dos inibidores do proteasoma, nenhum dos estudos randomizados foi ainda capaz de mostrar um benefício de OS para o HDT-ASCT na terapia de primeira linha em comparação com a terapia convencional, uma vez que o tempo de seguimento dos estudos correspondentes é ainda demasiado curto. Portanto, formalmente, o uso de terapia de alta dose só seria justificável no caso de uma recaída.
No entanto, a quimioterapia de alta dose continua a ter um lugar firme no tratamento de primeira linha dos doentes com mieloma múltiplo. 100% dos médicos que responderam consideram o HDT-ASCT como sendo o padrão nesta situação.
Transplante em tandem
As quimioterapias de dose dupla de alta com ASCT têm sido realizadas desde os anos 90. Em comparação com o transplante único, o transplante em tandem leva a uma remissão mais profunda e foi associado a um prolongamento do PFS em muitos estudos. O prolongamento do SO ainda não foi demonstrado para transplante em tandem na era da terapia de indução com inibidores de proteasoma ou IMIDs. O ensaio EMN02/HOVON95 incorporou uma comparação de tandem vs. transplante único no desenho do estudo. O transplante em tandem resultou em PFS e OS significativamente melhores para toda a população do estudo neste ensaio. A diferença foi particularmente pronunciada para pacientes com citogenética de alto risco (t[4;14], t[14;16], del[17p]) ou R-ISS II + III [6].
De acordo com o nosso inquérito, o ASCT tandem adaptado ao risco no tratamento de primeira linha é favorecido por 98% dos médicos.
Terapia de indução antes de ASCT
As terapias triplas à base de bortezomibe (até agora principalmente em combinação com ciclofosfamida ou talidomida) para indução têm sido o padrão internacional durante vários anos. A combinação de bortezomib com um alquilano (VCd) é inferior à combinação com um IMID (VTd) em termos de resposta e qualidade de remissão antes da terapia de alta dose [7]. A combinação de bortezomib com lenalidomida e dexametasona mostrou uma elevada taxa de resposta em vários estudos e é menos neurotóxica do que a VTD. Não foram realizados estudos comparativos aleatórios. Desde 2017, a lenalidomida tem sido aprovada na Suíça para o tratamento de primeira linha de pacientes que não se qualificam para a terapia ASCT. Isto levou à “disponibilidade mais fácil” da lenalidomida também no estabelecimento da indução antes do ASCT.
A lenalidomida é actualmente o parceiro preferido da combinação de bortezomib e dexametasona (VRD) em indução antes do HDT-ASCT. Para 85% dos médicos que responderam, o VRD é a primeira escolha, 12% favorecem outra combinação de trigémeos à base de bortezomibe, 2% vão para uma indução não baseada em bortezomibe.
Consolidação de acordo com ASCT
Com a consolidação (dois a quatro ciclos de uma combinação análoga à indução) após o HDT-ASCT, consegue-se uma maior redução do tumor, que foi acompanhada por um prolongamento do PFS em muitos estudos. Isto foi novamente confirmado no ensaio EMN02 com uma segunda randomização após o ASCT (dois ciclos de VRD vs. nenhuma consolidação), mas não foi possível demonstrar um benefício de OS. No ensaio StaMINA (sem consolidação vs. segundo ASCT vs. 4× VRD), por outro lado, não houve vantagem para os pacientes que receberam consolidação. O valor da consolidação após HDT-ASCT continua a não ser claro.
Isto também se reflecte nos resultados do inquérito. Para 66% dos médicos, a consolidação após o HDT-ASCT é padrão. 19% consolidam apenas pacientes com características de alto risco. 15% geralmente não consolidam.
Terapia de manutenção
Os ensaios aleatórios demonstraram um benefício PFS para os pacientes que recebem terapia de manutenção com lenalidomida (IFM CALGB). Numa meta-análise com dados de mais de 1200 pacientes, a manutenção da lenalidomida foi associada a um benefício de SO de mais de dois anos [8]. Os dados para a manutenção do bortezomib são menos robustos. Contudo, os pacientes com citogenética de alto risco parecem beneficiar mais da manutenção do bortezomib [9].
A duração óptima da manutenção da lenalidomida não está definida. Na maioria dos estudos, a manutenção até à progressão foi planeada. A duração média da manutenção com lenalidomida foi de 30 meses (cessação antecipada da manutenção no ensaio IFM 2005-02 devido ao aumento da ocorrência de malignidades secundárias).
Para 80% dos peritos suíços inquiridos, a manutenção da lenalidomida é padrão para todos os doentes após o HDT-ASCT. 20% fazem depender a utilização da manutenção da resposta à terapia de indução e prescrevem a terapia de manutenção apenas para pacientes que não tenham atingido CR ou VGPR.
A manutenção com lenalidomida é indicada para 70% dos peritos para todos os doentes. 30% dos peritos entrevistados diferenciam-se de acordo com o perfil de risco genético e favorecem o bortezomib na manutenção para pacientes com citogenética de alto risco.
Duração da terapia de manutenção: 50% dos médicos favorecem a manutenção até nova progressão, 50% favorecem a terapia de manutenção com lenalidomida limitada a (um a) dois anos.
Tratamento de primeira linha de pacientes que não são elegíveis para HDT-ASCT
As combinações triplas baseadas em bortezomib (VMP, VCD), geralmente dadas durante seis a nove ciclos, foram o tratamento de escolha para pacientes idosos ou comorbidos até à aprovação em primeira linha de Revlimid®/dexamethasone. O PRIMEIRO ensaio aleatório de três braços comparado com Rd a MPT durante 18 meses com Rd a progressão. A atribuição contínua de Rd conduz a PFS significativamente mais longo em comparação com Rd durante 18 meses, mas sem um benefício de SO [10]. Os doentes com citogenética de alto risco parecem beneficiar de uma terapia baseada em bortezomib [11].
Quando perguntados se a escolha do protocolo de tratamento é influenciada pela estratificação de risco citogenética, 60% responderam sim: Um protocolo baseado em bortezomib é utilizado para doentes com citogenética de alto risco. 10% dos médicos escolhem Rd independentemente da citogenética e 20% escolhem uma combinação à base de bortezomib para o tratamento de primeira linha.
Entre os protocolos baseados em bortezomib, o VMP é ligeiramente preferido a 55% em comparação com o VCD a 45%. A combinação VMP mais daratumumab ainda não é utilizada.
Se for utilizado Rd, a administração contínua (55%) foi mencionada mais frequentemente em comparação com a duração fixa da terapia (45%).
Terapia de segunda linha
Carfilzomibe, daratumumab, elotuzumab e ixazomibe em combinação com lenalidomida ou bortezomibe são aprovados para terapia de segunda linha. Não há estudos que comparem directamente estas novas substâncias.
Quando questionados sobre a sua preferência na terapia de segunda linha, poderiam escolher entre três opções: A KRd foi nomeada com mais frequência com 70%, DRd ou DVd alcançou 20% de acordo e 10% prefeririam outra terapia.
Mensagens Take-Home
- A aplicação dos critérios do SLIM-CRAB tornou-se estabelecida.
- A caracterização genética do mieloma múltiplo no diagnóstico faz parte do trabalho inicial na Suíça.
- A estratificação genética do risco no tratamento de pacientes é praticada por uma grande proporção de médicos.
- O tratamento de doentes com mieloma múltiplo mais jovens na Suíça é uniforme: a quimioterapia de alta dose e o transplante autólogo de células estaminais continuam a ser uma parte indiscutível do tratamento de primeira linha. A consolidação para uma maior redução da carga tumoral é praticada pela maioria. A terapia de manutenção é padrão.
- Nos pacientes mais velhos, o tratamento à base de bortezomib continua a ser preferível; Revlimid® dexamethasone ainda não foi (ainda) estabelecido.
- Na terapia de segunda linha, as combinações triplas baseadas em carfilzomibe e daratumumab tornaram-se estabelecidas.
Literatura:
- Rajkumar V, et al: International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014; 15: e538-548S.
- Morgan GJ, Walker BA, Davies FE: A arquitectura genética do mieloma múltiplo. Nat Rev Cancer 2012; 12(5): 335-348.
- Cavo M, et al: Transplante autólogo de células estaminais versus bortezomib-melphalan-prednisone para mieloma múltiplo recentemente diagnosticado: segunda análise provisória do estudo EMN02/HO95 da fase 3. Sangue 2017; 130(Suppl 1): 397.
- Attal M, et al: Lenalidomida, Bortezomib, e Dexametasona com Transplante para Mieloma Múltiplo. N Engl J Med 2017; 376: 1311-1320.
- Stadtmauer EA, et al.Comparação de transplante autólogo de células hematopoiéticas (autoHCT), bortezomib, consolidação de lenalidomida (len) e dexametasona (RVD) com manutenção de len (ACM), tandem autohct com manutenção de len (TAM) e autohct com manutenção de len (AM) para tratamento inicial de doentes com mieloma múltiplo (MM): resultados primários do ensaio aleatório fase III da Rede de Ensaios Clínicos de Transplante de Sangue e Medula Óssea (BMT CTN 0702 – Ensaio StaMINA). Sangue 2016; 128(Suppl 1): LBA-1.
- Cavo M, et al: O transplante duplo de células estaminais autólogas prolonga significativamente a sobrevivência sem progressão e a sobrevivência global em comparação com um único autotransplante em mieloma múltiplo recentemente diagnosticado: uma análise do estudo EMN02/HO95 da fase 3. Sangue 2017; 130(Suppl 1): 401.
- Moreau P, et al: VTD é superior ao VCD antes da terapia intensiva no mieloma múltiplo: resultados do possível ensaio IFM2013-04. Sangue 2016; 127(21): 2569-2574.
- McCarthy PL, et al: Manutenção da lenalidomida após transplante autólogo de células estaminais em mieloma múltiplo recém-diagnosticado: Uma Meta-Análise. J Clin Oncol 2017; 35: 3279-3289.
- Sonneveld P, et al: Indução de Bortezomib e Tratamento de Manutenção em Pacientes com Mieloma Múltiplo Recentemente Diagnosticado: Resultados do Ensaio Randomizado Fase III HOVON-65/GMMG-HD4. J Clin Oncol 2012; 30: 2946-2955.
- Facon T, et al: Análise final dos resultados da sobrevivência na fase 3 PRIMEIRO ensaio de tratamento inicial para o mieloma múltiplo. Sangue 2018; 131(3): 301-310.
- Larocca A, et al.: Impacto do tratamento por indução com bortezomibe ou lenalidomida em doentes com mieloma múltiplo recentemente diagnosticado, inscritos nos ensaios Gimema-MM-03-05 e EMN01, com citogenética de alto risco, não elegível. Sangue 2017; 130(Suppl 1): 744.
InFo ONCOLOGy & HaEMATOLOGy 2018; 6(6): 18-20.