O benefício do rastreio do cancro do pulmão em grupos de risco definidos foi demonstrado em dois grandes estudos. Nas fases iniciais da doença, a ressecção limitada com linfadenectomia é o tratamento de escolha.
O carcinoma bronquial primário é uma das doenças malignas mais comuns em todo o mundo. Na Suíça, é a segunda malignidade mais comum nos homens com uma incidência de 11,9%. Nas mulheres, a incidência é de 8,7%, o que faz dele o terceiro tumor mais comum. Com 21,9%, o carcinoma brônquico tem a maior mortalidade associada ao tumor nos homens e, com 15,4%, a segunda maior nas mulheres depois do carcinoma da mama [1].
O prognóstico a longo prazo depende da fase clínica da doença tumoral no momento do diagnóstico. Assim, a taxa de sobrevivência a 5 anos é de 80-90% para a fase IA1-IA3, 73% para a fase IB, 65% para IIA, 56% para IIB, 41% para IIIA, 24% para IIIB e 12% para IIIC. Com base nestes dados de sobrevivência, as recomendações para a oitava edição da classificação TNM para NSCLC com as correspondentes alterações nas fases clínicas foram publicadas no mesmo estudo [2].
Detecção precoce do NSCLC – resultados actuais de novos estudos
O facto do prognóstico relativamente bom numa fase inicial da doença e o facto do carcinoma brônquico ser uma das principais doenças malignas em mulheres e homens levou a vários estudos internacionais sobre o rastreio do carcinoma brônquico nos últimos anos.
O maior estudo, o “National Lung Screening Trial” (NLST) da América do Norte, publicado em 2011, randomizou 53 454 pacientes com um risco definido. Um grupo recebeu “dose baixa” tomografia computorizada (TCLD) durante três anos consecutivos, o outro grupo recebeu apenas uma radiografia convencional do tórax. No grupo da TLDCT, o ponto final primário de uma redução de 20% na mortalidade do cancro do pulmão foi atingido e o estudo foi terminado. Desconhece-se quanto teria sido reduzida a mortalidade por cancro do pulmão se o estudo tivesse continuado. A mortalidade global foi reduzida em 6,7%. O número necessário para rastrear era de 320 pacientes em risco para evitar a morte [3].
O maior ensaio aleatório na Europa e o segundo maior no mundo é o ensaio de rastreio do cancro do pulmão holandês-belga (NELSON), que teve início em 2003. Os dados completos são esperados em Dezembro de 2018, mas os principais conteúdos já foram apresentados em Setembro de 2018 na “Conferência Mundial sobre Cancro do Pulmão” em Toronto [4,5]. Foram incluídos os fumadores actuais ou ex-fumadores com dez anos ou menos de abstinência, com mais de 15 cigarros/dia durante 25 anos ou mais de dez cigarros/dia durante 30 anos. O estudo conclui que 50% dos carcinomas foram diagnosticados numa fase inicial, 65-70% na fase IA-II. 70% dos carcinomas do grupo de controlo foram da fase III-IV. A mortalidade por todas as causas foi reduzida em 26% durante um período de 10 anos em doentes masculinos de alto risco e em 61% nas mulheres.
Entre Janeiro de 2016 e Novembro de 2018, os dados actuais da Fundação para o Diagnóstico dos Pulmões estão disponíveis neste país: 961 exames foram realizados. A repartição dos grupos de risco pode ser encontrada no quadro 1. Entre os examinados, cinco carcinomas brônquicos foram recentemente diagnosticados, dois na fase IA e uma pessoa na fase IIA, IIIA e IV. 102 pessoas foram submetidas à cessação do tabaco.

Dados sobre ressecções limitadas (sublobar) para NSCLC
Os resultados dos estudos de rastreio são também notáveis no que diz respeito às opções de terapia cirúrgica. O ensaio NELSON conseguiu demonstrar que 65-70% dos carcinomas correspondem a uma fase IA-II [4]. O que significam estes resultados em termos de terapia cirúrgica?
Nos últimos anos, tem sido intensamente investigado se uma ressecção limitada no sentido de uma segmentectomia ou uma ressecção extra-anatómica (cunha) representa uma alternativa sensata à lobectomia clássica – tanto oncosurgicamente como em geral. A intenção de realizar uma segmentectomia é preservar o máximo de tecido pulmonar saudável possível, o que é particularmente benéfico em pacientes com reserva pulmonar limitada.
Os dados sobre a ressecção de segmentos parecem controversos no início. Vários estudos do período de 1990 a aproximadamente 2012 mostram uma clara vantagem em termos de sobrevivência global e sem recorrência a favor da lobectomia em todas as fases operatórias, especialmente nas fases I e II [6,7]. Wolf et al. No entanto, mostrou que nas segmentectomias com linfadenectomia mediastinal, a taxa de recorrência local e de sobrevivência sem recorrência eram idênticas. Isto foi notável e deu origem a estudos mais detalhados com enfoque no respeito pela anatomia segmentar e linfadenectomia sistemática [8]. O desenvolvimento da técnica cirúrgica minimamente invasiva na direcção de uma verdadeira ressecção do segmento anatómico (não simplesmente ressecção em cunha) foi decisivo. Isto respeita automaticamente a drenagem linfática anatómica predeterminada e a remoção cirúrgica radical, apesar da ressecção limitada e economizadora de parênquima [9].
Altorki et al. 2014 e Tsutani et al. 2013 mostrou taxas de sobrevivência iguais durante dez anos na fase IA, bem como em 3 anos de sobrevivência sem recorrência em adenocarcinomas. Da mesma forma, o levantamento retrospectivo de Kodama et al. 2016 (312 pacientes com estágio clínico cT1 N0 M0) sem aumento da taxa de recidiva local ou diferenças na sobrevida global no grupo de ressecção segmentar [10–12].
A influência positiva na função pulmonar pós-operatória após uma ressecção limitada foi demonstrada em alguns estudos [13,14].
Importância da linfadenectomia mediastinal
Como já foi mencionado, a influência de uma linfadenectomia mediastinal consistente e suficiente no que diz respeito à sobrevivência sem recorrência é um aspecto importante. Ludwig et al. e Gulack et al. mostrou que uma vantagem de sobrevivência está associada a um número crescente de gânglios linfáticos ressecados [15,16].
Da mesma forma, o trabalho de Stiles et al. o impacto da linfadenectomia na fase IA NSCLC. Foi demonstrada uma clara vantagem em termos de sobrevivência a longo prazo, bem como de sobrevivência sem recorrência para a ressecção sublobar com linfadenectomia em comparação com a ressecção sublobar sem linfadenectomia [17].
Impacto desta evolução na cirurgia torácica diária
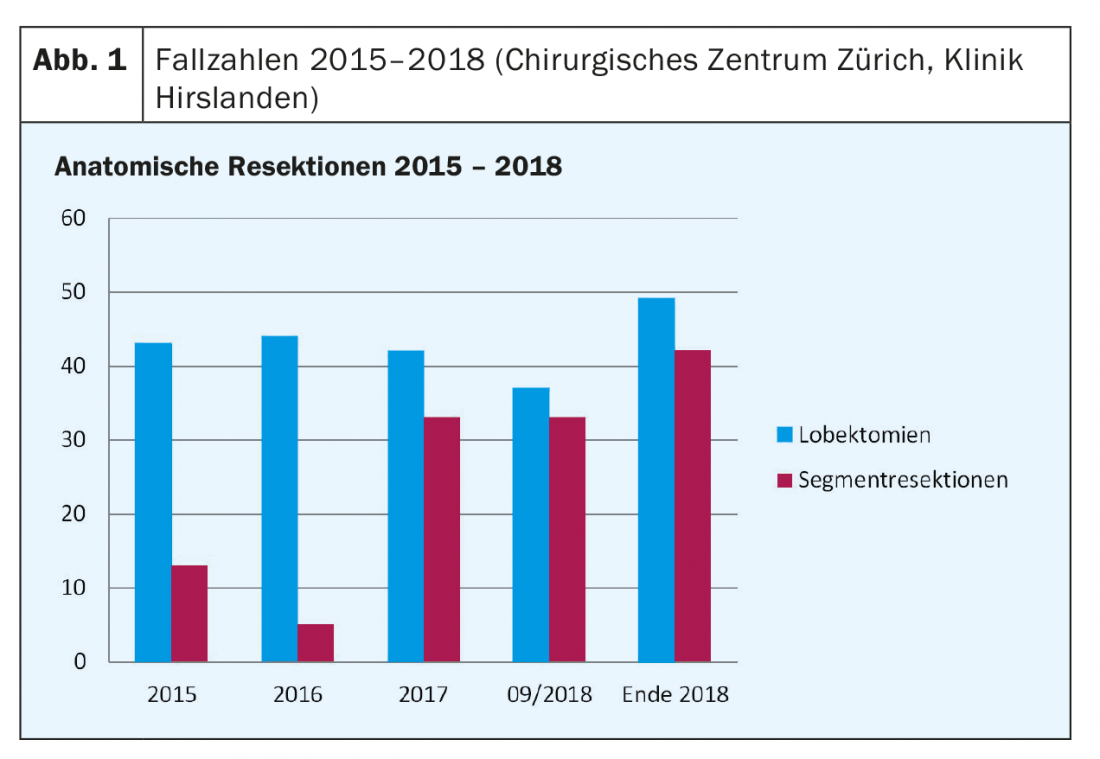
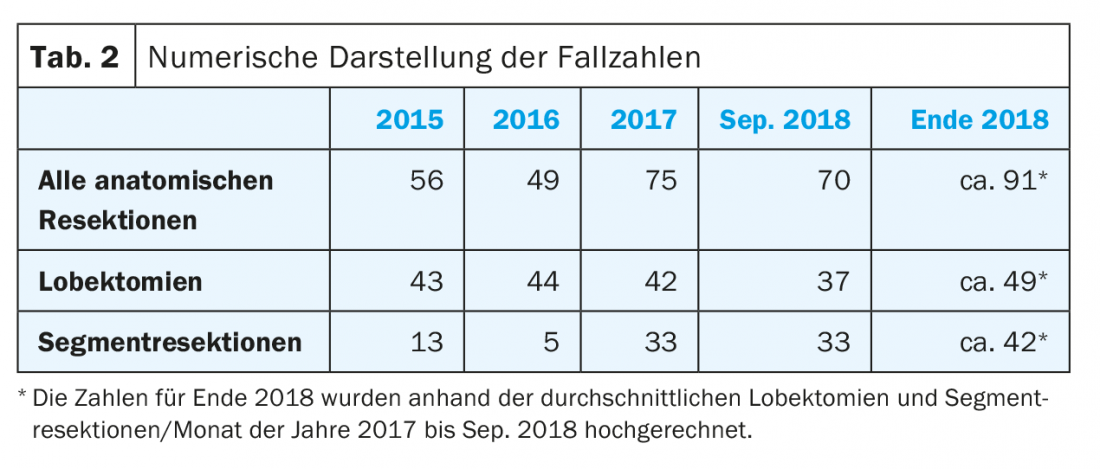
No Centro Cirúrgico de Zurique da Clínica Hirslanden estamos de facto a assistir a um aumento constante na proporção de ressecções de segmentos anatómicos. Além disso, houve um aumento global do número de todas as ressecções anatómicas desde o início de 2015 (Fig. 1 e Tab. 2).
Resultados do último período em detalhe
Entre Janeiro de 2016 e Setembro de 2018, foram realizadas 194 ressecções anatómicas na nossa instituição, das quais 123 (63%) foram lobectomias. O número de ressecções do segmento anatómico foi de 71 pacientes (37%), contra 13 pacientes (23%) em 2015, e já aumentou para 33 pacientes (44%) em 2017. Esperam-se cerca de 42 pacientes (46%) até ao final de 2018.
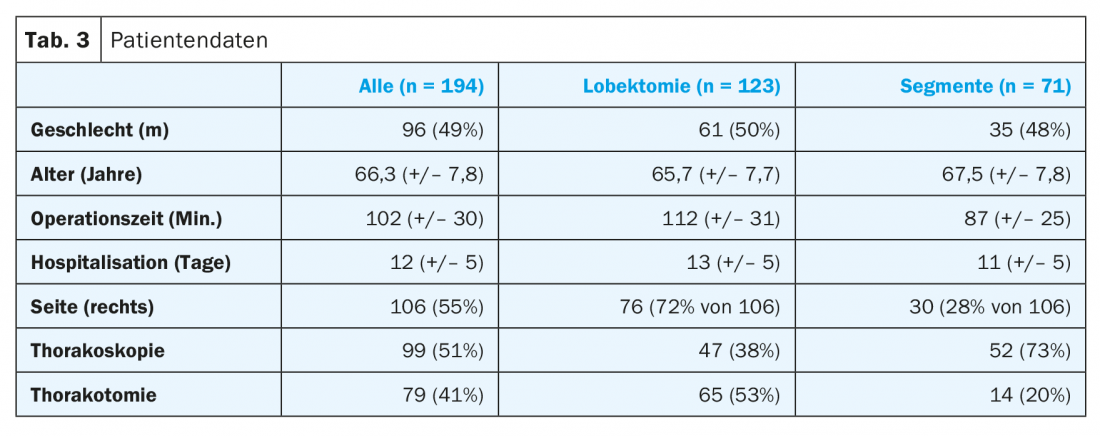
O tempo de funcionamento foi em média 25 minutos mais longo para as lobectomias com 112 minutos (+/- 31) do que para as ressecções segmentares com 87 minutos (+/- 25). Aos 13 dias (+/- 5), a duração da hospitalização tendeu a ser dois dias mais longa para as lobectomias. Mais de 70% das operações de ressecção segmentar foram realizadas por toracoscopia, com pouco menos de metade das lobectomias a serem minimamente invasivas (Tab. 3).
Em quase três quartos dos pacientes, o diagnóstico pós-operatório foi de cancro do pulmão de células não pequenas (Fig. 2).
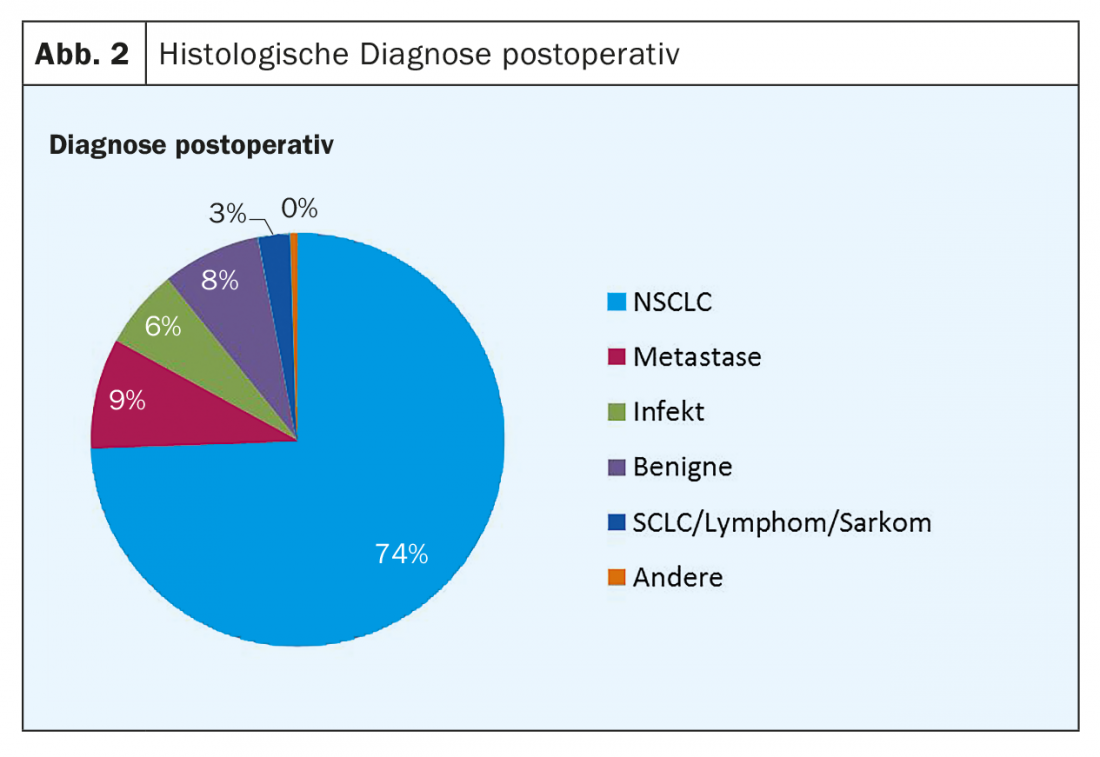
Entre as lobectomias, a proporção de NSCLC foi de 94 pacientes (76%), seguida de achados benignos ou infecciosos com 14% e metástases com 6%. Para ressecções segmentares, a proporção de NSCLC foi de 50 pacientes (70%), assim como 15% para achados benignos e infecciosos e 14% para metástases.
Histologicamente, 66% do NSCLC eram do tipo adenocarcinoma, 23% carcinoma espinocelular, 7% carcinoma carcinoide, 3% carcinoma pleomórfico e 1% carcinoma de células grandes (Fig. 2).
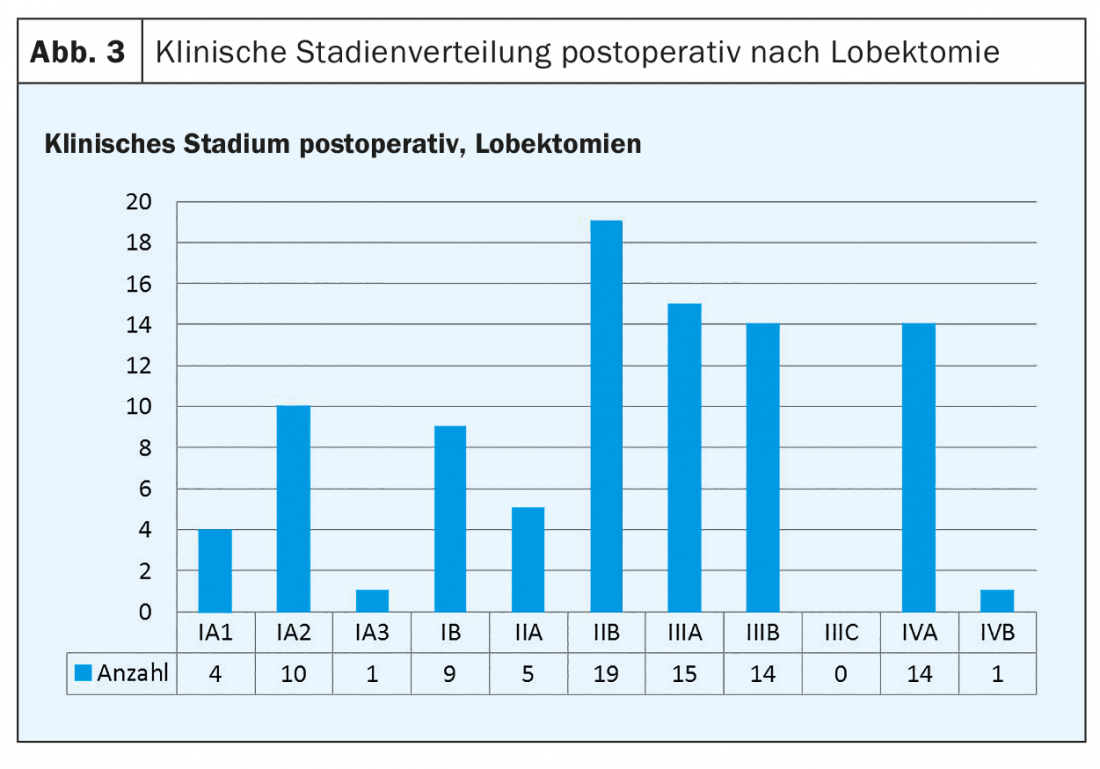
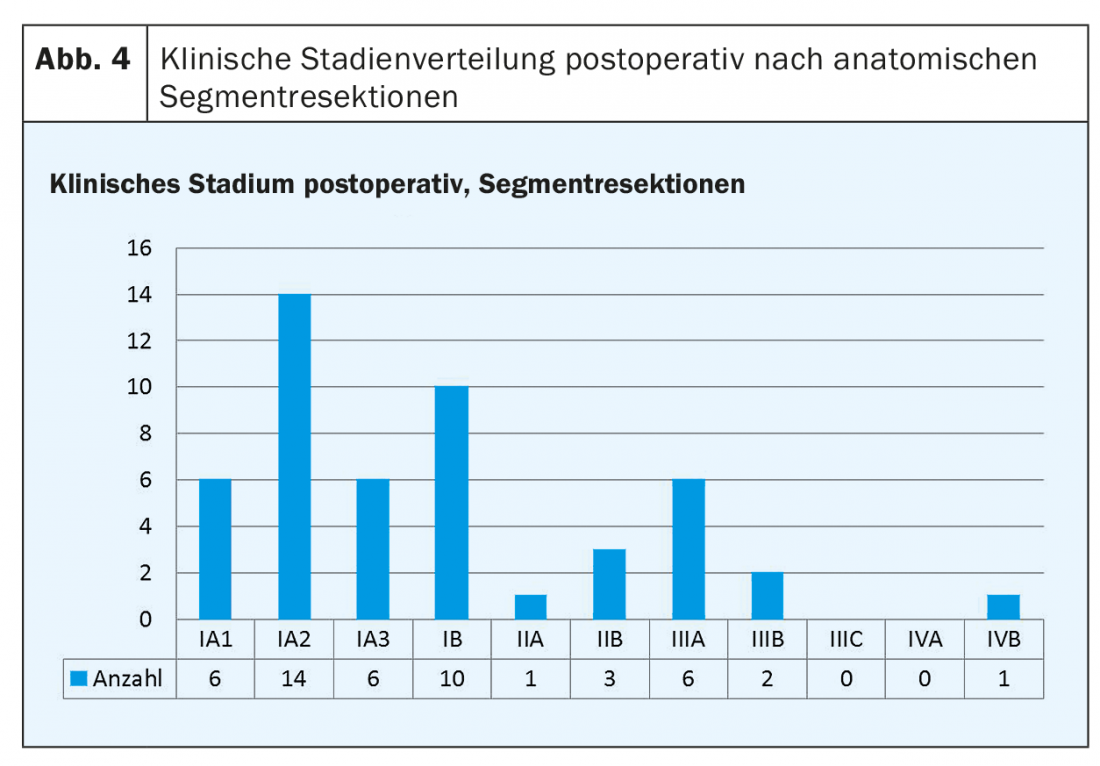
As figuras 3 e 4 mostram a distribuição das fases clínicas pós-operatórias para lobectomias (Fig. 3) e ressecções segmentares (Fig. 4).
Morbilidade e mortalidade
A mortalidade de 30 dias de todas as ressecções anatómicas (n=194) foi de três mortes (1,5%).
A morbilidade global foi de 9,5%, sem qualquer diferença encontrada em qualquer dos grupos. A complicação mais comum foi uma fuga de ar persistente (definida >7 dias), seguida de pneumonia, empiema pós-operatório, complicações cardíacas tais como fibrilação atrial e hematoma/pós-operatório de hemorragia.
Discussão
A tendência para ressecções oncológicas modernas, cada vez mais poupadoras de pulmões, tem sido claramente reconhecida na nossa instituição desde 2015. Isto mostra que um conceito cada vez mais personalizado está a ser aplicado não só no tratamento medicamentoso dos carcinomas pulmonares, mas também na cirurgia. Não houve alterações em termos de morbidade e mortalidade. No entanto, a proporção de operações minimamente invasivas está a aumentar e a duração das hospitalizações tende a ser mais curta.
A correcta execução técnica de uma ressecção segmentar (ao longo das estruturas anatómicas) é de grande importância para que, em última análise, se possa proceder de forma radical oncosúrgica, apesar da ressecção limitada. Só então a sobrevivência sem recorrência será tão boa como no passado, quando a lobectomia era o padrão de ouro. Curiosamente, 80% das ressecções segmentares que realizámos mostraram uma fase pós-operatória I-IIB. Os restantes dez pacientes mostraram uma situação oculta de N2 na maioria dos casos. São precisamente estas “sub-identificações”, algumas das quais já foram detectadas intra-operatoriamente, que irão sempre animar a discussão sobre se a tendência pode prevalecer. Dyas et al. conseguiram demonstrar em 2018, com base num estudo prospectivo de 1444 pacientes, que apesar da tomografia computorizada do tórax, PET-CT e outros esclarecimentos, uma situação oculta N2 estava presente em 10% dos pacientes com NSCLC classificados como fase I e 21% dos classificados como fase II [18]. A influência positiva da linfadenectomia na sobrevivência sem recorrência tem sido demonstrada em vários estudos [15–17]. Com base nestes dados, todos os nossos pacientes com NSCLC são submetidos a uma linfadenectomia mediastinal radical. O diagnóstico rápido intra-operatório, também nas estações de gânglios linfáticos, é da maior importância e é uma fonte de informação muito importante para definir o rumo certo desde o início, especialmente no caso de ressecções limitadas.
Mensagens Take-Home
- Dois grandes estudos internacionais demonstram o benefício do rastreio do cancro do pulmão em grupos de risco definidos.
- O tratamento de escolha nas fases iniciais é a ressecção limitada (ressecção de segmento anatómico) com linfadenectomia, de preferência minimamente invasiva ou assistida por robot.
Literatura:
- Krebsliga: Cancro na Suíça: figuras importantes. 2016.
- Goldstraw P, et al: The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer. J Thorac Oncol 2016 Jan; 11(1): 39-51.
- Aberle DR, et al: Redução da mortalidade pulmonar-cancerígena com baixa dose de rastreio tomográfico computorizado. N Engl J Med 2011; 365: 395-409.
- De Koning H, et al: Effects of volume CT lung cancer screening: Mortality results of the NELSON randomized-controlled population based trial. Conferência Mundial sobre Cancro do Pulmão 2018; Resumo PL02.05.
- Zhao YR, et al: Estudo de despistagem do cancro do pulmão NELSON. Cancer Imaging 2011; 11(1A): S79-S84.
- Grupo de estudo do cancro do pulmão: ensaio aleatório de lobectomia versus ressecção limitada para cancro do pulmão T1 N0 de células não pequenas. The Annals of Thoracic surgery 1995; 60(3): 615-623.
- Whitson A, et al: Survival After Lobectomy Versus Segmentectomy for Stage I Non-Small Cell Lung Cancer: A Population-Based Analysis. The Annals of Thoracic surgery 2011; 92(6): 1943-1950.
- Wolf AS, et al: Lobectomy Versus Sublobar Resection for Small (2 cm or Less) Non-Small Cell Lung Cancers. The Annals of Thoracic surgery 2011; 92(5): 1819-1825.
- Koike T, et al: Análise do factor de risco de recidiva locorregional após ressecção sublobar em doentes com cancro de pulmão de fase clínica IA não pequenas células. The Journal of Thoracic and cardiovascular surgery 2013; 146 (2): 372-378.
- Altorki NK, et al: A ressecção subobar é equivalente à lobectomia para o cancro do pulmão na fase clínica 1A em nódulos sólidos. The Journal of Thoracic and cardiovascular surgery 2014; 147(2): 754-764.
- Tsutani Y, et al. Resultados oncológicos da segmentectomia em comparação com a lobectomia para o adenocarcinoma pulmonar da fase clínica IA: Análise de probabilidades em comparação com um estudo multicêntrico. The Journal of Thoracic and cardiovascular surgery 2013; 146(2): 358-364.
- Kodama K, et al: Oncologic Outcomes of Segmentectomy Versus Lobectomy for Clinical T1a N0 M0 Non-Small Cell Lung Cancer. The Annals of Thoracic surgery 2016; 101(2): 504-511.
- Macke RA, et al: As ressecções anatómicas parenquimatosas preservadoras resultam em menos perda da função pulmonar em doentes com cancro do pulmão de fase I não pequenas células. J Cardiothorac Surg 2015; 10: 49.
- Saito H, et al: Função Pulmonar Após Lobectomia Versus Segmentectomia em Pacientes com Cancro Pulmonar Não-Pulmonar de Fase I. World Journal of Surgery Agosto de 2014; 38(8): 2025-2031.
- Ludwig MS, et al: Sobrevivência pós-operatória e o número de gânglios linfáticos amostrados durante a ressecção do cancro do pulmão não negativo de pequenas células. Peito 2005; 128(3): 1545-1550.
- Gulack BC, et al: The Impact of Tumour Size on the Association of the Extent of Lymph Node Resection and Survival in Clinical Stage I Non-Small Cell Lung Cancer. Cancro do pulmão 2015; 90(3): 554-560.
- Stiles BM, et al: A importância da dissecção dos gânglios linfáticos que acompanha a ressecção em cunha para o cancro do pulmão na fase clínica IA. Eur J Cardiothorac Surg 2017; 51(3): 511-517.
- Dyas AR, et al: Clinical Misstagings and Risk Factors of Occult Nodal Disease in Non-Small Cell Lung Cancer. The Annals of Thoracic surgery 2018; 106(5): 1492-1498.
InFo ONCOLOGy & HaEMATOLOGy 2018; 6(6): 4-7.