As terapias curativas para o carcinoma hepatocelular são a ressecção cirúrgica, ablação e transplante de fígado. Foram formuladas recomendações internacionalmente válidas para o transplante de fígado para HCC na Conferência de Consenso de Zurique 2010.
O carcinoma hepatocelular (HCC) é a terceira causa mais comum de morte por cancro a nível mundial e a sexta causa mais comum de morte por cancro na Suíça [1]. A incidência está a aumentar ao longo de muitos anos. As principais causas aqui são as infecções com o vírus da hepatite B/C (HBV/HCV) e, mais recentemente, o aumento epidemiológico da estetohepatite não alcoólica (NASH). Sem tratamento, o HCC tem um prognóstico desfavorável com uma taxa de sobrevivência de 5 anos inferior a 10%. A maioria dos doentes desenvolve o CHC no cenário da cirrose hepática, o que torna as estratégias de tratamento óptimas muito mais difíceis. Na última década, foram feitos progressos decisivos no conhecimento biomédico sobre a doença e na terapia. As opções de tratamento baseiam-se principalmente em abordagens cirúrgicas (ressecção, transplante de fígado) e não cirúrgicas (quimioembolização radiológica interventiva, ablação locoregional, quimioterapia). No caso da doença HCC localizada e não multi-focal, a remoção cirúrgica de tumores e o transplante de fígado são a norma de ouro [2,3].
Apresentação clínica e diagnóstico
Os sintomas e o aspecto clínico dependem da fase da doença tumoral. Numa fase avançada, os pacientes apresentam frequentemente a tríade de dor abdominal superior, tumor palpável no abdómen superior direito e perda de peso. Além disso, ocorrem ascite e sinais clínicos de hipertensão portal e raramente icterícia. Em menos de 5% dos casos, os doentes apresentam ruptura do tumor, o que pode também levar a hemorragias com risco de vida e “sementeira de tumor” intra-abdominal. Além disso, foram descritas numerosas complicações paraneoplásicas, tais como hipoglicemia, hipercalcemia, eritrocitose e osteoartrofia pulmonar hipertrófica. Em doentes com cirrose hepática que são monitorizados num programa de rastreio, os tumores podem ser detectados numa fase mais precoce.
O marcador tumoral α-fetoproteína (AFP) é elevado em até 90% dos doentes com CHC; contudo, não está correlacionado com a extensão da doença tumoral e é limitado tanto na sua especificidade como na sua sensibilidade, uma vez que doenças benignas como a hepatite e a cirrose hepática também podem ser associadas a uma elevação da AFP. Como regra básica, um AFP >200 ng/ml em combinação com imagens adequadas é altamente sensível à doença HCC.
Em termos de imagem, o foco está na TC, MRI e US. O ultra-som é bem adequado como um método de rastreio de baixo custo. Contudo, a baixa sensibilidade e especificidade, bem como as elevadas taxas de falsos negativos superiores a 50%, são as limitações deste exame.
Semelhantes aos critérios BiRAD estabelecidos para o carcinoma da mama, os critérios LiRAD (incluindo a acumulação de agentes de contraste na fase arterial, tamanho do achado, “wash out”) foram definidos pela Sociedade Americana de Radiologia. Com base nestes critérios, um nódulo hepático pode ser avaliado em relação à sua malignidade.
Devido à melhoria da imagem, a confirmação do diagnóstico só é indicada no caso de resultados inconclusivos. Neste caso, a biopsia percutânea de agulha fina guiada por ultra-sons é o padrão de ouro, embora a sementeira de tumores possa ocorrer ao longo do canal de biopsia em <1%.
Encenação de acordo com a classificação BCLC
A encenação e a escolha adequada da terapia são feitas de acordo com o algoritmo de classificação da Clínica de Cancro do Fígado de Barcelona (BCLC), que define cinco fases da doença HCC. Estes dependem do número e tamanho do tumor, da fase Child-Pugh e do estado de desempenho do ECOG (Fig. 1) [4].
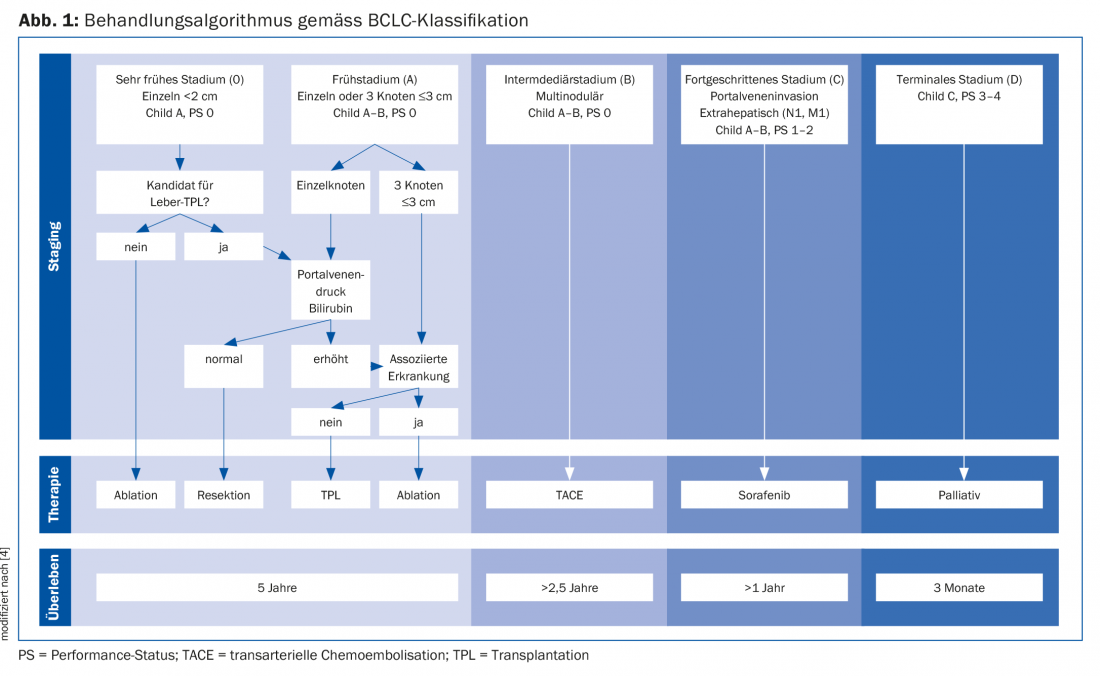
Terapias conservadoras: Terapia do sistema vs. terapias locais
Os métodos terapêuticos conservadores incluem a terapia sistémica (inibidores multikinase e imunoterapia) e métodos de ablação tumoral. O inibidor de proteína cinase sorafenibe é indicado como terapia de primeira linha para a fase C BCLC. Uma vantagem de sobrevivência de 10,7 vs. 7,9 meses é demonstrada para pacientes tratados com sorafenibe (vs. placebo) [5]. Os novos inibidores multikinase como o lenvatinib também parecem ser eficazes de acordo com estudos actuais de não-inferioridade (ainda não publicados: Cheng et al., abstracto 4001 na ASCO 2017) e em breve serão aprovados como terapias sistémicas de primeira linha. Além disso, outros inibidores multikinase (por exemplo regorafenibe e cabozantinibe) estarão brevemente disponíveis como terapias de segunda linha [6].
Ainda não está claro e o tema da investigação actual é o lugar da imunoterapia, com ensaios de fase II com nivolumab mostrando resultados promissores. Assim, podemos aguardar com expectativa os próximos estudos de eficácia.
Os pacientes com CHC na lista de transplantes de fígado são regularmente reavaliados. No caso de progressão hepática da doença tumoral fora dos critérios de listagem – determinada com imagens e AFP – em muitos casos ocorre uma listagem inactiva e prevê-se uma diminuição da mesma. Se a progressão ocorrer apesar das terapias locorregionais, o paciente deve ser “retirado” da lista de espera de transplantes. Centros de transplantação com longas listas de espera realizam terapias de transição locais para o controlo de tumores nestes doentes. Estes incluem a quimioembolização transarterial (TACE), radiofrequência (RFA) e ablação por microondas (MWA) e a injecção percutânea de etanol (PEI) [7]. TACE é uma embolização selectiva do influxo do hepatoma arterial usando agentes quimioterápicos (principalmente cisplatina ou doxorubicina), que em combinação conduz a danos tumorais isquémicos e quimioterapia local com poucos efeitos secundários sistémicos. Com este método intervencionista, é possível obter uma redução do tamanho do tumor de 50% para uma necrose tumoral completa. O TACE também pode ser utilizado para reduzir a taxa de abandono na lista de espera e a taxa de recorrência de tumores após transplante de fígado e para conseguir uma redução. RFA/MWA envolve a colocação percutânea assistida por imagem de uma sonda RFA no tumor, que é destruída termicamente com energia eléctrica alternada de alta frequência. Os resultados são satisfatórios e foram publicados relatórios de uma taxa de abandono de 0% e de sobrevivência de 3 anos até 83% [8]. A PEI tem sido menos estudada como terapia de transição. O uso de uma agulha fina torna-a teoricamente menos invasiva e, portanto, menos susceptível de causar a sementeira de tumores. Com um espectro favorável de efeitos secundários da PEI, podem ser alcançados resultados bem sucedidos com até 80% de necrose tumoral. No entanto, como são necessários vários tratamentos, a maioria desta técnica foi substituída por RFA. Novas técnicas de ablação, como a radioterapia interna selectiva (SIRT), mostram resultados promissores em termos de resposta a tumores e sobrevivência [4]. Num estudo recente, pacientes com CHC após TACE frustrado foram tratados com SIRT versus sorafenibe; não houve diferença na sobrevivência [9]. No entanto, de acordo com estudos actuais, o significado de SIRT continua por definir [4].
Em caso de tamanho e número de tumores limítrofes após a terapia de transição, o paciente é listado como inactivo para aprender sobre biologia tumoral por ressonância magnética, TAC e AFP no curso. Se não for observada qualquer progressão do tumor após um período de espera inactivo de três meses na lista, o paciente pode ser activamente listado.
Terapia cirúrgica: ressecção vs. transplante de fígado
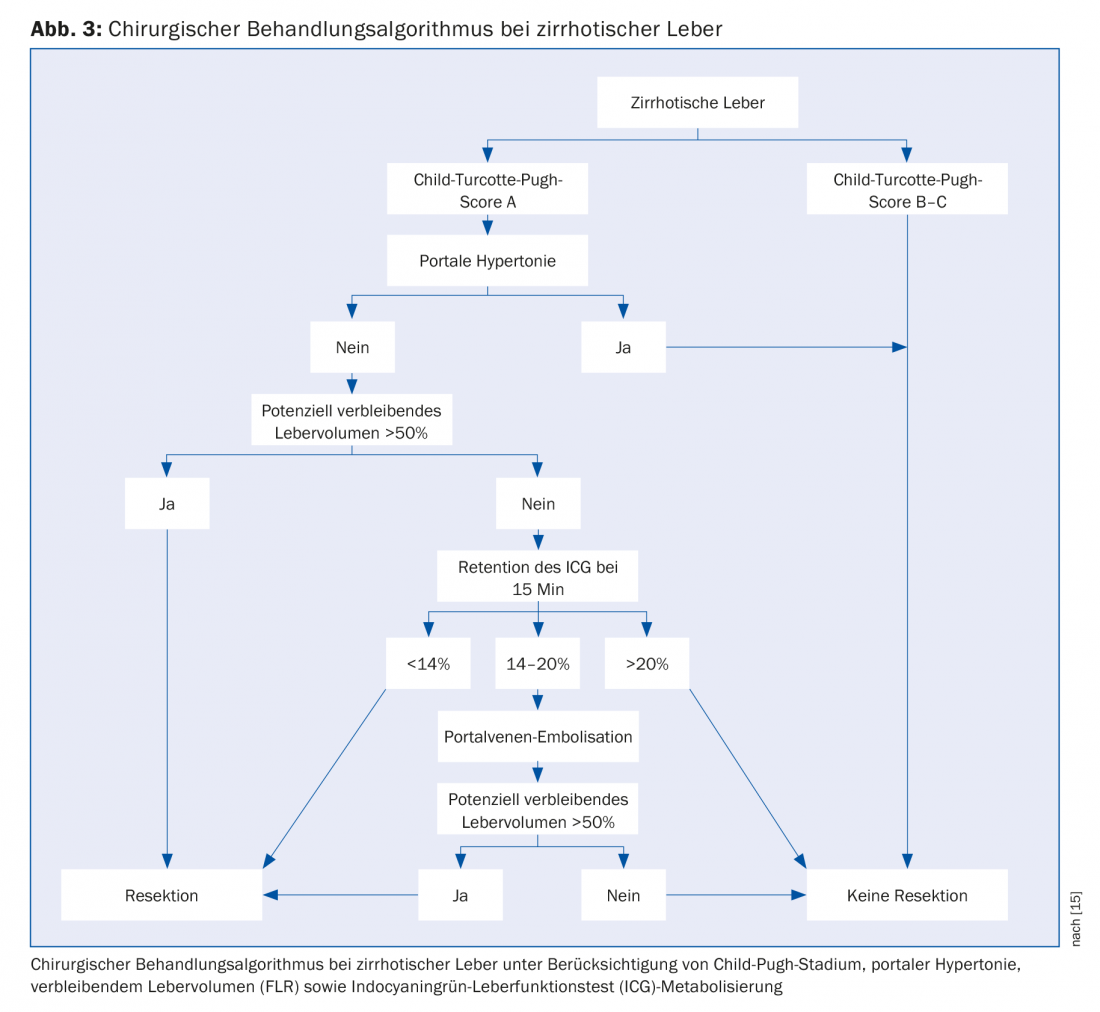
O padrão de ouro para HCC é a ressecção cirúrgica ou o transplante ortotópico do fígado. No entanto, apenas 10-30% dos doentes com CHC são candidatos à ressecção. Após laparotomia exploratória, a ressecção curativa pode ser realizada em apenas 50-70% dos pacientes. A única contra-indicação à cirurgia é a metástase extra-hepática. A ressecabilidade depende do tamanho do tumor, do número, da proximidade de vasos sanguíneos e da doença hepática subjacente. O objectivo da operação é uma ressecção completa em tecido saudável correspondente a um R0 histopatológico. A resectabilidade é também determinada pelo volume de fígado restante in-situ (“remanescente de fígado futuro”, FLR) e pela hipertensão portal. De acordo com o nosso algoritmo proposto, um volume residual do fígado livre de tumores de pelo menos 50% deve permanecer. Para volumes abaixo deste valor, a embolização da veia porta pode ser executada para indução de volume. A hipertensão portal já não é necessariamente uma contra-indicação absoluta para a ressecção hepática [10,11]. Ao considerar a ressecção em pacientes cirróticos, um procedimento cirúrgico minimamente invasivo deve ser prosseguido sempre que possível, uma vez que este grupo de pacientes beneficia particularmente do mesmo [12]. Nós em Zurique oferecemos aos nossos pacientes procedimentos de ressecção laparoscópica e robótica como operações minimamente invasivas [7].
Para tumores mais pequenos (<2-3 cm) é discutida a indicação para ablação curativa, uma vez que foi postulada uma sobrevida equivalente à ressecção cirúrgica [13,14]. No entanto, o valor destes estudos deve ser considerado com reservas, uma vez que, por um lado, são análises de subgrupos de estudos retrospectivos com um nível de evidência limitado e, por outro lado, os poucos estudos prospectivos até agora não mostraram qualquer diferença [7].
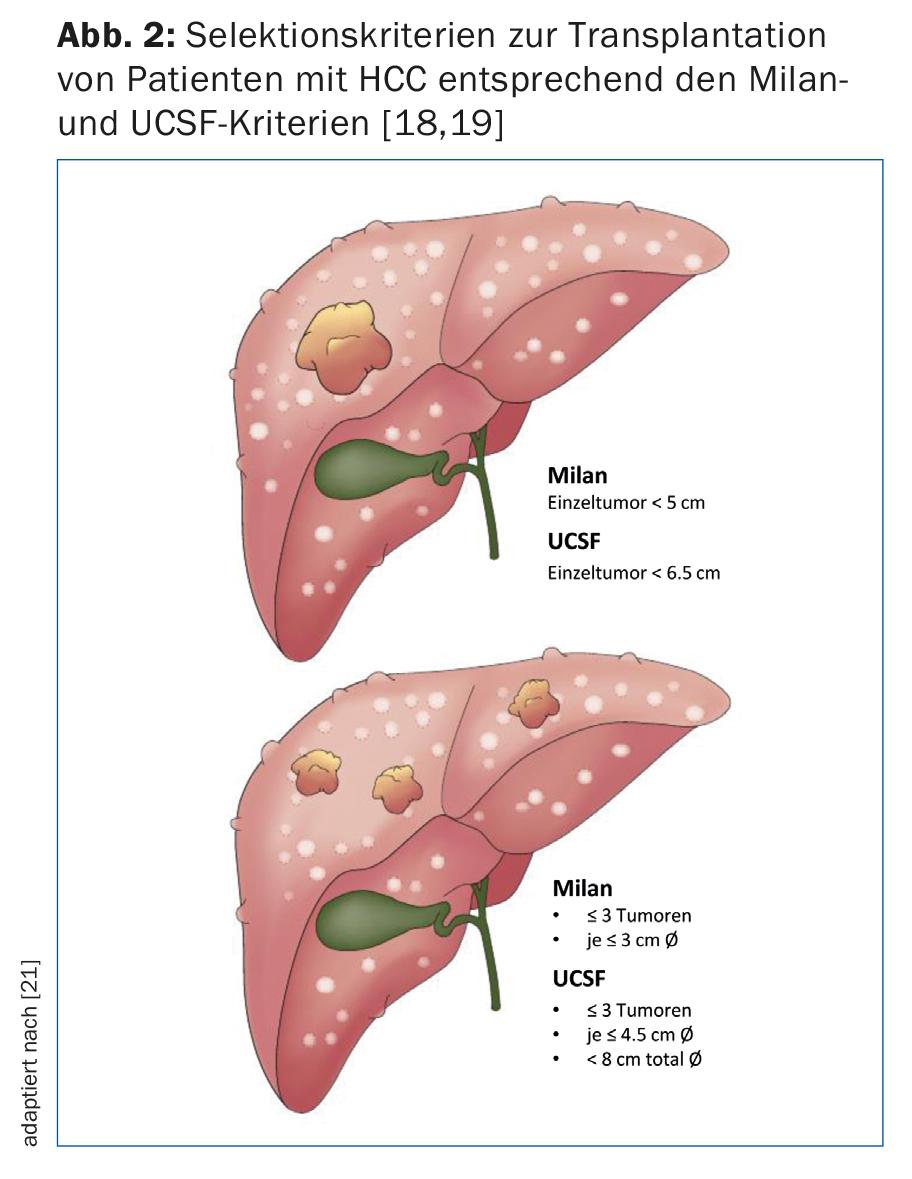
O transplante do fígado é claramente superior à ressecção em termos de sobrevivência sem recaídas durante 5 anos e é certamente a melhor opção terapêutica em pacientes cirróticos com pequeno CHC. Devido à escassez de órgãos doadores, bem como à fase frequentemente avançada da doença fora dos critérios aceites (Fig. 2), o transplante só pode ser oferecido numa população selectiva de HCC. Portanto, a ressecção continua a ser o tratamento de escolha para os pacientes cirróticos com função hepática compensada (Child-Pugh stage A) sem hipertensão portal (Fig. 3) [15].
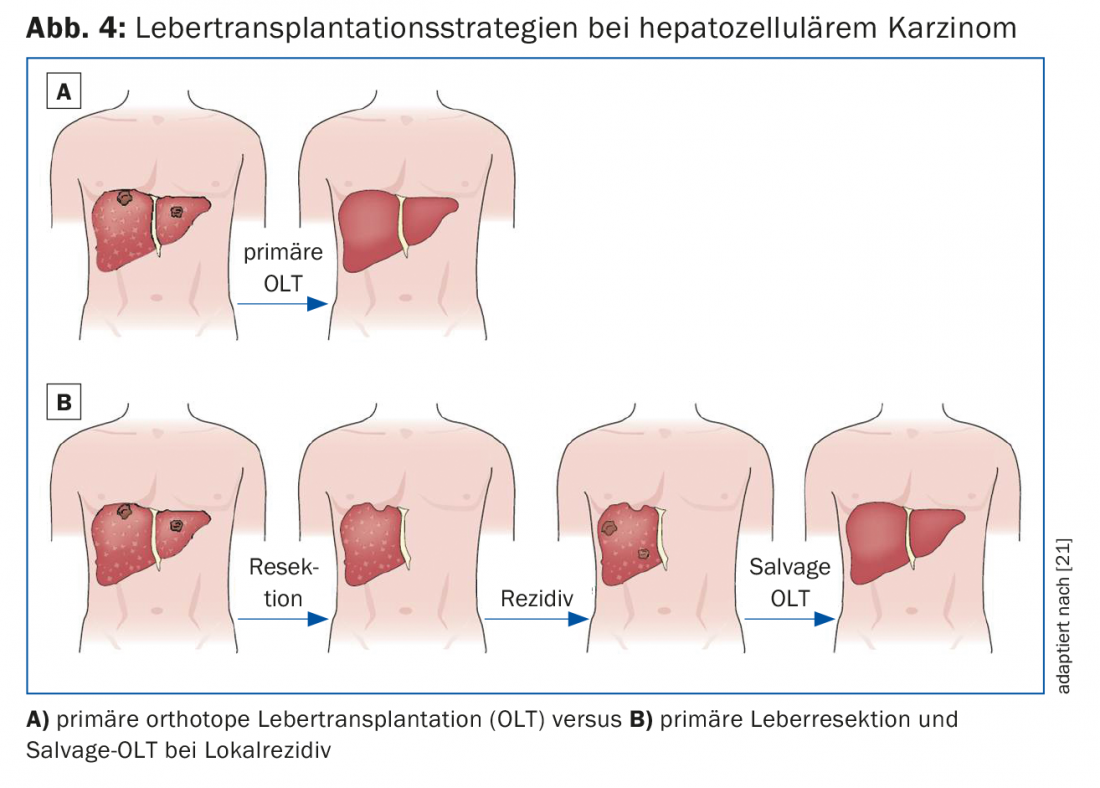
A terapia combinada de ressecção e transplante de fígado pode ser considerada em três cenários clínicos diferentes:
- Terapia primária com transplante de salvados em caso de recidiva de tumor (Fig. 4)
- Procedimento de diagnóstico para avaliação histopatológica do tumor no que diz respeito à invasão vascular, bem como satélites tumorais com selecção consecutiva e adequada de candidatos a transplante
- Terapia de transição antes do transplante para assegurar o controlo do tumor dentro dos critérios de Milão ou UCSF (Fig. 2) [16].
Os doentes com HCC com função hepática não compensada (Child-Pugh B ou C) e/ou hipertensão portal devem ser tratados principalmente com transplante hepático se a doença tumoral estiver dentro dos respectivos critérios de transplante aceites (Fig. 2).
O transplante do fígado parece ser a terapia HCC ideal, uma vez que a remoção completa do fígado infestado de tumores corresponde formalmente a uma remoção oncológica de tumores com margens de ressecção negativas. No contexto da escassez de órgãos do doador, o transplante de fígado só é considerado em pacientes cuja sobrevivência é comparável à de um receptor de órgãos sem HCC.
Originalmente, o grupo de Bismuto relatou a extensão da infestação tumoral como um marcador substituto da biologia tumoral. Mostraram que os pacientes com pequenos tumores uni ou binodulares <3 cm têm uma melhor sobrevivência em caso de transplante em comparação com a ressecção tumoral (83% vs. 18%). Além disso, pacientes com CHC difuso com mais de dois nódulos >3 cm ou trombo venoso portal tiveram uma maior taxa de recorrência com sobrevida consecutiva reduzida [17]. Mazzaferro et al. estudaram pacientes com cirrose e CHC não ressecáveis que foram tratados com transplante. Estabeleceram critérios específicos – a base dos chamados critérios de Milão – definidos como um tumor único <5 cm ou ≤3 tumores cada um <3 cm de diâmetro (Fig. 2). Os pacientes que cumpriram os critérios de Milão mostraram uma melhoria significativa na sobrevivência global e sem recorrência após o transplante [18]. Numerosos estudos relataram excelentes dados de sobrevivência em doentes com CHC transplantados dentro destes critérios. Isto levou alguns peritos a considerar os critérios demasiado restritivos. De facto, um grupo de investigação da Universidade da Califórnia, São Francisco (UCSF) mostrou que os pacientes fora dos critérios de Milão também beneficiam significativamente do transplante. Os critérios mais amplos da UCSF são definidos como um único tumor ≤6.5 cm ou ≤3 tumores cada um ≤4.5 cm e soma dos diâmetros totais do tumor ≤8 cm (Fig. 2) [19]. A European Liver and Intestine Transplant Association (ELITA) e a International Liver Transplantation Society (ILTS) lançaram o projecto Metroticket. Com base em dados de pacientes pré e pós-operatórios (tamanho máximo do tumor, número de tumores, valor AFP), a sobrevivência “pós-transplante” pode ser prevista usando uma calculadora online no sítio web www.hcc-olt-metroticket.org [20] (Fig. 5).
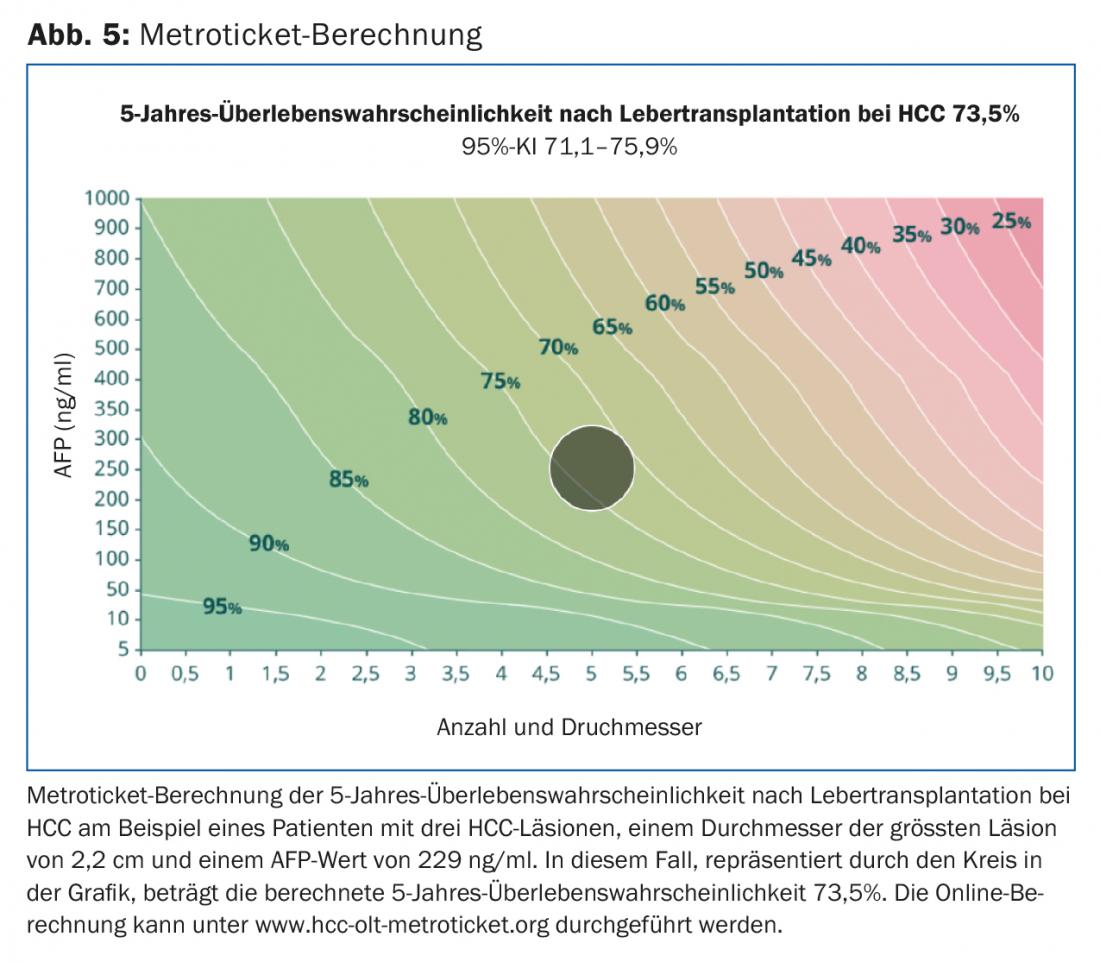
Os pacientes transplantados dentro dos critérios de Milão ou UCSF têm dados de sobrevivência semelhantes (80% vs. 75% de sobrevivência em 5 anos). No entanto, o transplante fora dos critérios da UCSF está associado a uma sobrevivência reduzida – com uma taxa de sobrevivência de 5 anos bem abaixo dos 50%. Independentemente do tamanho e número do tumor, a evidência de invasão do tumor macrovascular é uma contra-indicação ao transplante hepático.
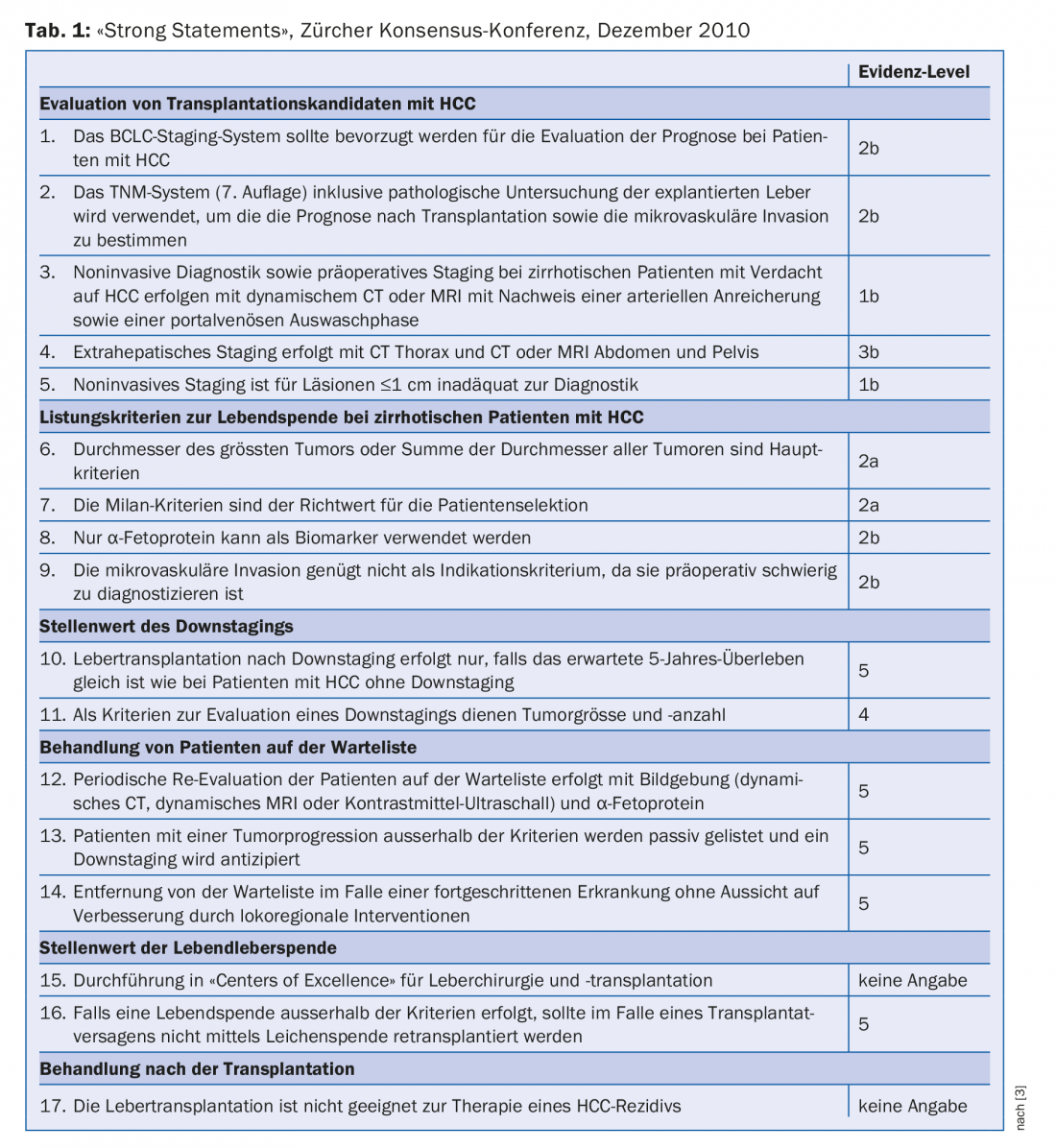
Em Dezembro de 2010, realizou-se em Zurique uma conferência de consenso com peritos internacionais. O objectivo era elaborar a prática actual de transplante de fígado para HCC e desenvolver directrizes internacionalmente aceites. Foi formulado um total de 37 declarações e recomendações. Estes dizem respeito às áreas de: Avaliação dos candidatos a transplante de fígado, critérios para a listagem de doentes cirróticos e não cirróticos, o papel da redução do tumor, o tratamento dos doentes em lista de espera, o valor da doação de fígado vivo e o tratamento pós-transplante. As 17 recomendações mais importantes (“declarações fortes”) estão resumidas no Quadro 1 [3].
Mensagens Take-Home
- A incidência de carcinoma hepatocelular (HCC) está a aumentar em todo o mundo.
- As estratégias de tratamento curativo incluem a ressecção cirúrgica, ablação e transplante hepático.
- Depois do sorafenibe, o lenvatinib pode ser utilizado como terapia de primeira linha.
- O transplante do fígado via cadavérico ou doação em vida é uma possível opção de tratamento para pacientes com CHC e doença hepática em fase terminal (ESLD).
- Os pacientes em lista de espera para transplante beneficiam de terapias de transição que consistem na quimioembolização transarterial (TACE), ablação por radiofrequência (RFA) e injecção percutânea de etanol (PEI). O papel do SIRT é o tema da investigação actual.
- Foram formuladas recomendações internacionalmente válidas para transplantes de fígado em pacientes com CHC na Conferência de Consenso de Zurique, em Dezembro de 2010.
Literatura:
- Parkin DM, et al: Global cancer statistics, 2002. CA Cancer J Clin 2005; 55: 74-108.
- Dutkowski P, et al: Challenges to Liver Transplantation and Strategies to Improve Outcomes. Gastroenterologia 2015 Fev; 148(2): 307-323.
- Clavien PA, et al: Recommendations for liver transplantation for hepatocellular carcinoma: an international consensus conference report. The Lancet Oncology 2012; 13: e11-22.
- Bruix J, Reig M, Sherman M: Diagnóstico Baseado em Evidências, Encenação, e Tratamento de Pacientes com Carcinoma Hepatocelular. Gastroenterologia 2016; 150: 835-853.
- Llovet JM, et al: Sorafenib em carcinoma hepatocelular avançado. The New England Journal of Medicine 2008; 359: 378-390.
- Bruix J, et al: Regorafenib para doentes com carcinoma hepatocelular que progrediram no tratamento com sorafenibe (RESORCE): um ensaio aleatório, duplo-cego, controlado por placebo, fase 3. Lancet 2017; 389: 56-66.
- Petrowsky H, Busuttil RW: Ressecção ou ablação de pequeno carcinoma hepatocelular: qual é o melhor tratamento? Journal of Hepatology 2008; 49: 502-504.
- Mazzaferro V, et al: Ablação por radiofrequência de pequeno carcinoma hepatocelular em pacientes cirróticos à espera de transplante hepático: um estudo prospectivo. Anais de Cirurgia 2004; 240: 900-909.
- Vilgrain V, et al: Eficácia e segurança da radioterapia interna selectiva com microesferas de resina ítrio-90 em comparação com sorafenibe em carcinoma hepatocelular localmente avançado e inoperável (SARAH): um ensaio de fase 3 controlado aleatoriamente com rótulo aberto. The Lancet Oncology 2017; 18: 1624-1636.
- Capussotti L, et al: ressecção do fígado para carcinoma hepatocelular na cirrose: análise da mortalidade, morbilidade e sobrevivência – uma experiência europeia de centro único. Revista europeia de oncologia cirúrgica: a revista da Sociedade Europeia de Oncologia Cirúrgica e da Associação Britânica de Oncologia Cirúrgica 2005; 31: 986-993.
- Cucchetti A, et al: A hipertensão portal é uma contra-indicação à ressecção hepática? Anais de cirurgia 2009; 250: 922-928.
- Abu Hilal M, et al: The Southampton Consensus Guidelines for Laparoscopic Liver Surgery: From Indication to Implementation. Anais de cirurgia 2017. DOI: 10.1097/SLA.00000000002524 [Epub ahead of print].
- Vivarelli M, et al: Ressecção cirúrgica versus ablação percutânea por radiofrequência no tratamento do carcinoma hepatocelular no fígado cirrótico. Anais de Cirurgia 2004; 240: 102-107.
- Guglielmi A, et al: Ablação por radiofrequência versus ressecção cirúrgica para o tratamento do carcinoma hepatocelular na cirrose. Journal of gastrointestinal surgery: jornal oficial da Society for Surgery of the Alimentary Tract 2008; 12: 192-198.
- Clavien PA, et al: Estratégias para uma cirurgia hepática mais segura e transplante de fígado parcial. N Engl J Med 2007; 356: 1545-1559.
- Chua TC, et al: Ressecção hepática para carcinoma hepatocelular transplantável para doentes dentro dos critérios de Milão e UCSF. Am J Clin Oncol 2012; 35: 141-145.
- Bismuto H, et al: Ressecção do fígado versus transplante para carcinoma hepatocelular em pacientes cirróticos. Anais de cirurgia 1993; 218: 145-151.
- Mazzaferro V, et al: Transplante de fígado para o tratamento de pequenos carcinomas hepatocelulares em pacientes com cirrose. N Engl J Med 1996; 334: 693-699.
- Yao FY, et al: Transplante de fígado para carcinoma hepatocelular: a expansão dos limites do tamanho do tumor não tem um impacto negativo na sobrevivência. Hepatologia 2001; 33: 1394-1403.
- Mazzaferro V, et al: Previsão de sobrevivência após transplante hepático em doentes com carcinoma hepatocelular para além dos critérios de Milão: uma análise retrospectiva, exploratória. The Lancet Oncology 2009; 10: 35-43.
- Agopian V, Petrowsky H: Transplante de fígado para tumores malignos. In: Fong Y, et al. (Eds.): Cancro Hepatobiliar. People’s Medical Publishing House 2014; 293-316.
PRÁTICA DO GP 2018; 13(1): 14-19











