Um resumo da situação actual da farmacogenética em psiquiatria – com conselhos práticos para a sua aplicação, dado que uma revisão da lista de análise entrou em vigor desde o início de 2017. Sob certas condições, isto permite o reembolso de testes farmacogenéticos.
A farmacogenética na psiquiatria poderá em breve celebrar o seu 50º aniversário. Autores escandinavos já tinham descoberto em 1969 que, após tratamento com nortriptilina, os níveis plasmáticos deste antidepressivo tricíclico noradrenérgico eram muito semelhantes dentro de pares gémeos monozigóticos mas não dizigóticos, o que levou à conclusão de que a variabilidade dos níveis plasmáticos tinha um fundo genético [1]. Ao mesmo tempo, este trabalho também já apontava para a ocorrência de interacções farmacocinéticas que devem ser designadas por factores ambientais, na medida em que a semelhança das concentrações de nortriptylink dentro dos pares não era observada nos gémeos monozigóticos tratados com fármacos adicionais.

O passo importante seguinte em 1977 foi a descrição de diferentes fenótipos, nomeadamente de metabolizadores “eficientes” (EM) ou “normais” e “não metabolizadores” (n.m., hoje chamados “metabolizadores pobres”, PM) dos resíduos de drogas anti-hipertensivas [2]. Uma deficiência genética de hidroxilase de detritos, que é agora conhecida como a enzima geneticamente polimórfica citocromo P-450 2D6, ou CYP2D6, foi suspeita em PMs com base em dados farmacocinéticos. Utilizando técnicas modernas de análise de DNA, a apresentação de genótipos foi então conseguida em 1988, nomeadamente a primeira prova biológica molecular de um polimorfismo genético, utilizando o CYP2D6 como exemplo [3]. Em 1981, foram medidos níveis excepcionalmente elevados de nortriptilina no plasma num paciente tratado com nortriptilina que era PM no teste farmacogénico de resíduos de nortriptilina. Além disso, o doente sofria de graves efeitos secundários apesar da dose habitual (75 mg/dia). A redução da dose para 25 mg/dia resultou numa melhoria clínica e resolução dos efeitos secundários [4]. Este estudo de caso histórico é considerado a primeira descrição psicofarmacogenética, clinicamente relevante. Desde então, numerosos estudos têm apoiado a hipótese de que, para além de factores ambientais e factores ligados ao paciente enquanto pessoa, os factores genéticos são também responsáveis pelas diferenças interindividuais na farmacocinética e farmacodinâmica dos psicofármacos (Fig. 1) [5]. Em particular, foram identificadas numerosas variantes genéticas nas enzimas envolvidas no metabolismo destes medicamentos e a sua influência na actividade enzimática tem sido caracterizada [6,7]. Graças à colaboração entre o meio académico e a indústria no domínio da farmacogenómica-farmacogenética, já existem biomarcadores genéticos adequados para implementar na prática a terapia personalizada [7,8].
Este documento resume a situação actual da farmacogenética na psiquiatria. Contém conselhos práticos para a sua aplicação, uma vez que a farmacogenómica na Suíça foi recentemente submetida a uma importante inovação: Em 1 de Janeiro de 2017, entrou em vigor uma revisão da lista de análise, que permite que os testes farmacogenéticos sejam reembolsados pelo seguro básico sob certas condições.
Importância geral da farmacogenómica farmacogenética
Desenvolveu-se uma disciplina chamada farmacogenómica que investiga o efeito das diferenças genéticas interindividuais sobre a farmacocinética, efeitos terapêuticos e efeitos secundários dos medicamentos [9]. A farmacogenómica e a farmacogenética são frequentemente utilizadas como sinónimos. Os biomarcadores farmacogenéticos permitem estimar a resposta terapêutica a um fármaco ou a sua toxicidade num paciente individual. Estas são frequentemente variantes genéticas de enzimas do metabolismo da droga ou de proteínas de transporte, de receptores responsáveis pelo efeito das drogas, mas também do maior complexo de histocompatibilidade (antigénios leucócitos humanos, HLA; ver o seguinte exemplo de carbamazepina).
Na prática clínica, os seguintes papéis são atribuídos aos testes farmacogenéticos [10]:
- Evitar overdoses que conduzam a reacções adversas aos medicamentos
- Evitar as subdoses que levam a um efeito terapêutico insuficiente
- Evitar o uso de medicamentos em doentes hipersensíveis e expostos ao risco
- Melhoria do diagnóstico diferencial, por exemplo, para estabelecer a causalidade de uma reacção adversa aos medicamentos.

O objectivo geral é utilizar os conhecimentos adquiridos na farmacogenética farmacogenética para adaptar as terapias medicamentosas ao perfil genético de um paciente individual. Outros autores referem-se a isto como “farmacoterapia estratificada” [11]. A fim de contribuir significativamente para a sua implementação, mas também para promover a investigação, o grupo suíço “Farmacogenómica e Terapia Personalizada” foi recentemente fundado neste contexto como uma secção da Sociedade Suíça de Farmacologia Clínica e Toxicologia (SGKPT) (Caixa “Grupo Suíço de Farmacogenómica e Terapia Personalizada”). Deve ser especificado que a farmacogenética não costuma estudar genes responsáveis pelo desenvolvimento de doenças [12]. A farmacogenómica estuda variantes genéticas que influenciam as áreas da farmacocinética e farmacodinâmica de um fármaco. Os alvos dos medicamentos são, por exemplo, receptores ou proteínas de transporte de neurotransmissores. Dependendo da variante genética presente, os medicamentos interagem com eles de forma diferente em termos farmacológicos. Os fármacos podem, portanto, diferir entre si na sua farmacodinâmica, devido aos diferentes perfis genéticos dos pacientes tratados. A este respeito, existem numerosos estudos sobre a importância das variantes genéticas das proteínas do neurotransmissor transportador (por exemplo, 5-HT transportador) e das proteínas receptoras (por exemplo, receptor de dopamina) para o efeito clínico dos medicamentos psicotrópicos [13,14]. No entanto, a genotipagem nesta área não é actualmente recomendada na prática diária devido a provas insuficientes [15].
A situação é diferente na área da farmacocinética-farmacogenómica, onde já está a ter lugar uma tentativa de implementação. Muitos autores e comités recomendam a genotipagem de enzimas metabolizadoras de drogas e, mais recentemente, de proteínas transportadoras de drogas na prática clínica. As quatro fases do destino de uma droga no organismo são absorção, distribuição, metabolismo e eliminação (“ADME”). No passado, supunha-se que as drogas eram distribuídas no organismo por meio de simples difusão. Entretanto, no entanto, têm-se caracterizado proteínas de transporte que aceleram a passagem de substâncias activas através de barreiras de membrana e células, por exemplo, do intestino para o sangue e através da barreira hemato-encefálica. A absorção para o fígado, onde grande parte do metabolismo da droga tem lugar, é também mediada por proteínas de transporte. Estes incluem a glicoproteína P (PgP), que, entre outras coisas, actua como um transportador de efluxo para assegurar que as drogas e outros xenobióticos, na medida em que são substratos do PgP, sejam rapidamente removidos novamente do SNC e assim não possam atingir concentrações intracerebral relevantes. O gene ABCB1, que codifica a proteína PgP, tem numerosas variantes genéticas. Como resultado deste polimorfismo genético, há indivíduos em que a função da PgP como proteína de transporte para certos substratos só é exercida de forma limitada ou não é exercida de todo, influenciando assim a sua farmacocinética e efeito clínico [16].
Como mencionado no início, o sistema enzimático do citocromo P-450 também desempenha um papel importante no metabolismo dos produtos farmacêuticos. Várias formas como CYP2B6, CYP2C9, CYP2C19 e CYP2D6 têm um polimorfismo genético. É feita uma distinção aproximada entre PM sem cópia do gene activo, EM com duas cópias do gene activo – são agora referidos como “metabolizadores normais” [17] – metabolizadores intermediários (IM) com, por exemplo, apenas uma cópia do gene activo e metabolizadores ultra-rápidos (UM) com mais de duas cópias do gene activo como consequência da multiplicação do gene. Dependendo do estado metabólico geneticamente determinado, são medidos níveis extremamente elevados (em PM), “normais” (em EM, IM) ou extremamente baixos (em UM) do plasma do medicamento. Existe, portanto, um risco acrescido de reacções adversas aos medicamentos (em PM) ou de não resposta (em UM) à medicação nas doses habituais [18]. Para drogas que são convertidas de uma forma inactiva para o agente activo por uma enzima com um polimorfismo genético, os grupos de risco são invertidos (não resposta em PM; risco de efeitos secundários em UM). Por exemplo, o substrato CYP2D6 codeína é um precursor (um “prodrug”) de morfina: no UM, o risco de intoxicação de morfina após a administração do código é aumentado [19].
Fontes de informação para recomendações e orientações
O médico assistente baseia a sua estratégia de tratamento, entre outras coisas, nas informações acessíveis no “ Resumo das características do produto” (SPC). Contém informações sobre o metabolismo, farmacocinética e mecanismos de acção dos fármacos. Para vários fármacos, há agora também provas da influência de variantes farmacogenéticas. Apesar das recomendações da literatura científica, a realização de testes farmacogenéticos é muito raramente explicitamente recomendada na informação sobre medicamentos. Os pares droga/gene carbamazepina/HLA-A*31:01 e carbamazepina/HLA-B*15:02 são uma excepção (no espectro farmacodinâmico). Nos portadores dos alelos HLA-A*31:01 ou HLA-B*15:02, o risco de efeitos secundários dermatológicos graves é significativamente aumentado em comparação com os não portadores. Nos doentes para os quais a terapia com carbamazepina está planeada, a genotipagem deve, portanto, ser realizada a fim de reduzir o risco de síndrome de Stevens-Johnson, entre outras coisas. Contudo, a frequência destas variantes de risco difere em diferentes grupos étnicos, razão pela qual, por exemplo, apenas se recomenda a genotipagem de HLA-A*31:01 para indivíduos de origem europeia, como descrito em pormenor em “Carbamazepine” [20]. A variante HLA-B*15:02 , por outro lado, só é comum em certas populações asiáticas e a genotipagem só é recomendada em doentes de origem asiática.
Outra excepção diz respeito a um genótipo farmacocinético-farmacogénico, nomeadamente o par CYP2D6/Atomoxetina, um medicamento prescrito para o tratamento da TDAH (“Transtorno de défice de atenção e hiperactividade”), que é um substrato da enzima. O “Drug Information” especifica: “Cerca de 7% de todos os caucasianos têm um genótipo correspondente a uma enzima CYP2D6 defeituosa (o chamado “metabolizador pobre” CYP2D6). Os doentes com este genótipo têm uma exposição muito maior à atomoxetina em comparação com os doentes com uma enzima em funcionamento. Os maus metabolizadores têm, portanto, um risco acrescido de efeitos secundários. Para pacientes com um genótipo conhecido de “mau metabolizador”, deve ser considerada uma dose inicial mais baixa e uma titulação mais lenta”. Apesar destas recomendações de acção, a genotipagem óbvia antes de se iniciar a terapia não é explicitamente recomendada na informação sobre medicamentos. Por outro lado, os dados farmacocinéticos para o mesmo fármaco permitem assumir que o risco de falta de efeito (não-resposta) à atomoxetina é elevado nos doentes UM (CYP2D6). [21].
Para outros medicamentos, tais como o aripiprazole, a informação do medicamento menciona que este antipsicótico é metabolizado pelo CYP2D6 e, portanto, a sua biotransformação é fortemente reduzida em PM, mas não há informação ou acção recomendada sobre um possível benefício da genotipagem. No entanto, vários grupos de autores e organizações publicaram entretanto directrizes com recomendações que ajudam o médico assistente na interpretação dos resultados dos testes farmacogenéticos e nas decisões sobre tratamentos futuros com a inclusão de informação farmacogenética.
Muito úteis a este respeito são organizações como o Clinical Pharmacogenetics Implementation Consortium (CPIC) e o PharmGKB hospedado pela Universidade de Stanford. (A Base de Conhecimento Farmacogenómica). Recolhem e analisam as provas científicas neste campo, publicam recomendações para a selecção de fármacos e ajuste da dose de fármacos com base nos resultados de testes farmacogenéticos e informações sobre a relação entre genes específicos e variantes de genes e o efeito clínico sobre o resultado do tratamento medicamentoso. PharmGKB também oferece ferramentas de interpretação online onde, após entrar no genótipo de um paciente, as recomendações relevantes para esse genótipo são exibidas directamente.
Isto mostra que não é simplesmente necessário determinar para um grupo de medicamentos com estruturas químicas semelhantes ou com a mesma indicação, mas para cada medicamento individual com base em dados experimentais e estudos clínicos, quão relevantes são certas variantes genéticas e se a genotipagem é de alguma utilidade. Portanto, têm de ser definidos pares de medicamentos/gene para os quais a genotipagem de acordo com certos critérios fornece informação clinicamente orientadora relevante para o tratamento.
Níveis de evidência
PharmGKB definiu diferentes níveis de evidência que reflectem a força dos dados científicos que apoiam uma associação entre variantes genéticas e um resultado de tratamento específico (efeito, efeitos secundários) para pares genes/droga individuais (ver caixa).

Os estudos farmacogenéticos são difíceis de realizar porque, dependendo da frequência dos alelos investigados numa população ou do efeito secundário investigado, um número muito grande de pacientes deve ser incluído no estudo a fim de se obterem resultados estatisticamente relevantes. O PharmGKB definiu, portanto, quatro níveis diferentes de provas [22,23]. Cada nota clínica (“anotação”) contém assim informações sobre o nível alcançado para o respectivo par medicamento/gene.
O quadro 1 mostra uma compilação dos medicamentos mais importantes para a psiquiatria, as suas proteínas envolvidas no metabolismo e transporte, e os níveis de evidência clínica das associações. O ideal seria que os níveis de evidência se reflectissem também nas recomendações na informação sobre drogas. Além disso, a US Food and Drug Administration (FDA) publicou uma lista de 200 medicamentos cuja informação sobre medicamentos fornece informação sobre biomarcadores farmacogenómicos.
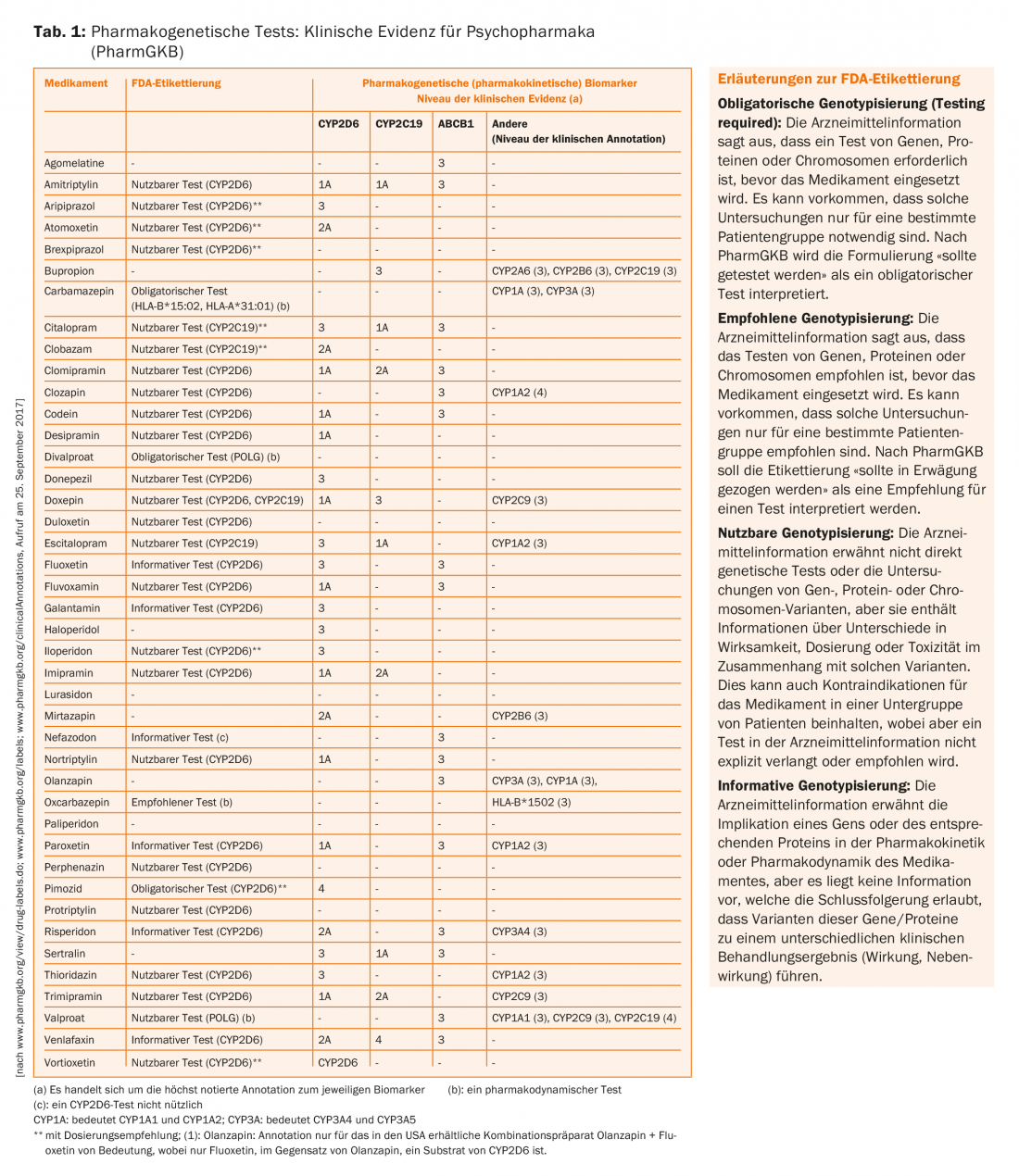
Com 26 biomarcadores, a psiquiatria ocupa o segundo lugar após a oncologia em termos de frequência (Tab. 1) [24]. Deve ser realçado que em oncologia, a genética do tumor é muito frequentemente examinada para estimar o efeito de um medicamento (por exemplo, certas mutações no receptor EGF devem estar presentes nas células tumorais para que o gefitinib funcione), mas isto difere normalmente da genética do paciente. Em contraste, questões farmacogenéticas no metabolismo e no transporte, bem como no efeito de medicamentos não oncológicos, utilizam a informação genética das células do corpo do paciente.
O quadro 1 também apresenta anotações de informação da FDA sobre drogas psicotrópicas, tal como resumido pelo PharmGKB. Existem também anotações correspondentes, mas menos completas e não apresentadas aqui, da Agência Médica Europeia (EMA), da Agência Japonesa de Produtos Farmacêuticos e Dispositivos Médicos (PMDA), da Health Canada Santé Canada (HCSC) e de outras agências. O que se segue pode ser resumido a partir desta compilação:
- Para pares medicamentos/gene como carbamazepina/HLA-A*31:01 alelo e carbamazepina/HLA-B*15:02 alelo, mas também para certos antidepressivos (ex. amitriptilina)/CYP2D6 e/ou CYP2C19, existem recomendações ao mais alto nível (1A)
- Os pares de drogas/gene relacionados com proteínas transportadoras tais como ABCB1 (PgP) (por exemplo, citalopram/ABCB1) só atingem o nível de evidência 3.
- Para praticamente todos os pares droga/gene, os testes farmacogenéticos são indicados como “accionáveis”, ou seja, utilizáveis ou direccionáveis, mas não necessariamente obrigatórios ou classificados como obrigatórios. Apenas para a carbamazepina, divalproato (mas estranhamente não para o valproato – poderia ser a consequência da falta de dados dos ensaios clínicos para atingir este nível de recomendação) e a pimozida antipsicótica, que já não está licenciada na Suíça, é um teste farmacogenético designado como “exigido” pela FDA.
Recomendações para testes farmacogénicos em psiquiatria
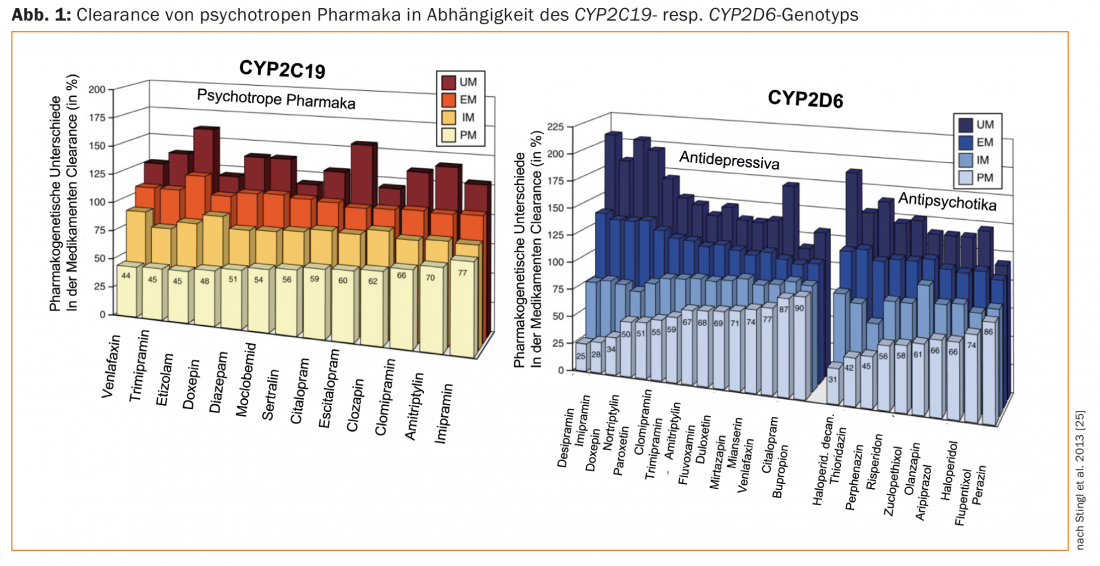
As revisões sobre a farmacogenética dos fármacos psicotrópicos e as directrizes para os testes farmacogenéticos em psiquiatria dizem sobretudo respeito à genotipagemde doentes tratados com antidepressivos e antipsicóticos CYP2D6 e CYP2C19 [25–29]. As drogas diferem nas suas propriedades como substratos destas enzimas. Isto explica as diferenças significativas nas recomendações de dose entre os diferentes medicamentos, tendo em conta os genótipos dos doentes (UM, EM, IM, PM; Fig. 1; [25]). Por exemplo, para o quase exclusivo substrato de CYP2D paroxetina, a dose deve ser reduzida para apenas cerca de 50% da dose habitual para uma PM (CYP2D6), e aumentada em mais de 50% para uma UM. Em contraste, esta enzima desempenha um papel menor no citalopram, razão pela qual não é necessário um ajustamento da dose dependendo do genótipo CYP2D6. Por outro lado, o CYP2C19 desempenha um papel importante no metabolismo deste antidepressivo – dependendo do genótipo CYP2C19, a dose deve ser aumentada (UM) ou diminuída (PM) (Fig. 1).
Merece especial atenção a recomendação de autores suíços de renome que, em nome da Sociedade Suíça de Ansiedade e Depressão (SGAD), da Sociedade Suíça de Psiquiatria Biológica (SGBP) e da Sociedade Suíça de Psiquiatria e Psicoterapia (SGPP), recomendaram a genotipagem de ABCB1 Recomendar em todos os doentes deprimidos que são prescritos tratamentos com antidepressivos mas que experimentam um efeito terapêutico insuficiente. [30]. Esta recomendação tem uma política de saúde e um significado económico, pois pode resultar na genotipagem de milhares de doentes deprimidos todos os anos, quer sejam ou não tratados com um substrato de PgP.
Alguns antidepressivos são substratos de PgP (citalopram), mas outros não são (mirtazapina). Em doentes deprimidos tratados com antidepressivos, um estudo retrospectivo descobriu que, naqueles tratados com os substratos PgP amitriptilina, paroxetina, venlafaxina ou citalopram, o polimorfismo genético do gene ABCB1foi associado à resposta ao tratamento [31]. A distribuição dos genótipos da variante ABCB1(polimorfismo de nucleótido único, SNP) rs2032583 foi particularmente importante aqui. Havia significativamente menos pacientes não autorizados entre os portadores do alelo C desta variante (25%) do que entre os pacientes que não eram portadores do alelo C (62%). Resultados semelhantes foram observados em cálculos relacionados com o SNP rs2235015. Entre os transportadores do alelo T desta variante, havia significativamente menos não transportadores em comparação com os não transportadores. Tais correlações não foram observadas num grupo de comparação de pacientes que não foram tratados com substratos de PgP.
Deve ser mencionado que apenas um antidepressivo foi prescrito para este grupo, nomeadamente mirtazapina. Numa meta-análise, a mesma equipa concluiu que os SNPs rs2032583 e rs2235015 estão significativamente associados ao efeito clínico [32], enquanto que a análise de outros SNPs não mostrou tal associação. Ao mesmo tempo, porém, os investigadores concluíram noutro estudo que a manutenção dos níveis plasmáticos terapêuticos de antidepressivos é uma medida necessária para além da genotipagem ABCB1 [33].
Alguns autores da meta-análise acima referida publicaram recentemente outra análise muito mais completa de 32 estudos sobre a relação do polimorfismo ABCB1e o efeito clínico (efeito terapêutico, tolerância) dos antidepressivos [32]: As associações mais elevadas são obtidas quando são analisadas as rs2032583 e rs2235040, mas já são mais fracas quando se tem em conta a rs2032582, e ainda mais fracas quando se tem em conta outros SNPs como os acima mencionados rs2235015. Globalmente, os autores da análise concluíram que os estudos até à data não são suficientes para provar um benefício clínico da genotipagem da ABCB1na terapia medicamentosa da depressão [34].
São necessários mais estudos clínicos, mas também aqueles que demonstram um significado funcional destas variantes ABCB1localizadas fora da região codificadora de proteínas do gene. Isto poderia ser investigado com técnicas de imagem para descobrir se os pacientes com diferentes genótipos ABCB1 ou combinações de variantes (haplótipos) experimentam uma absorção diferente dos medicamentos no cérebro após a administração de antidepressivos. Uma análise independente da literatura confirma que, nesta fase, a introdução geral da genotipagem ABCB1na prática clínica é prematura [16]. Esta conclusão foi também recentemente alcançada por membros da Comissão de Drogas da Profissão Médica Alemã [35].
Para o médico praticante, esta disputa é confusa, especialmente porque um grupo de autores duvida, com base nos seus resultados de investigação, que a amitriptilina seja um substrato do Pgp em humanos [36]. Também não é facilmente visível quais as variantes genéticas que estão a ser investigadas pelos laboratórios especiais que oferecem análises farmacogenéticas da ABCB1 . A genotipagem de rotina ABCB1 de uma maioria de doentes deprimidos tratados com drogas não é, portanto, claramente recomendada actualmente, especialmente porque também faltam estudos sobre a sensibilidade e especificidade do teste.
Importância do regulamento de 1. Janeiro 2017 para os testes farmacogenéticos
Em 1. Em 1 de Janeiro de 2017, entrou em vigor na Suíça uma portaria revista, segundo a qual os testes farmacogenéticos são cobertos por um seguro de saúde obrigatório se certas condições forem preenchidas (Portaria da FDHA de 29 de Janeiro de 2017). Setembro de 1995 sobre as prestações do seguro de saúde obrigatório (KLV, a partir de 1 Janeiro 2017). É de significado prático que estas análises estejam agora incluídas na Lista Federal de Análises (Anexo 3 do KLV). Os testes farmacogenéticos estão cobertos na lista de análises de 1 de Julho de 2017 nos itens 2150.10, 2250.10, 2271.01, 2547.01 (revisto em 14 de Julho de 2017). Deve ser feita uma distinção entre duas condições:
- Um pequeno número de testes farmacogenéticos pode ser prescrito por todos os médicos, independentemente do seu título de especialista, e reembolsado pelas caixas de seguro de saúde. Uma lista destas análises relacionadas com medicamentos especificados (ou seja, são pares medicamentos/gene em cada caso), é fornecida pela Sociedade Suíça de Farmacologia Clínica e Toxicologia (SGKPT, compilada em 9.6.2016, versão 1):
- Abacavir (HLA-B*57:01);
- Carbamazepina (HLA-A*31:01 e HLA-B*15:02);
- 6-mercaptopurina, azatioprina (TPMT);
- 5-fluorouracil, capecitabina (DPYD);
- Irinotecan (UGT1A1).
Esta lista é actualizada anualmente pelo SGKPT, com base tanto na literatura científica actual como nas provas obtidas através da experiência clínica na selecção de pares genes/droga. Para psiquiatria e neurologia, é significativo que todo o psiquiatra, neurologista, mas também o médico de clínica geral possa (e deva) realizar um genotipagem de HLA-A*31:01 e HLA-B*15:02 (em pacientes de origem asiática) no caso de um tratamento de carbamazepina recentemente planeado e que as companhias de seguros de saúde reembolsem o paciente pelos custos do teste.
2. Para testes farmacogenéticos a serem prescritos para pares de fármacos/gene diferentes dos indicados acima, as duas limitações seguintes na lista de análise são particularmente importantes:
- Limitação 1: “Apenas no caso de uma indicação para a administração de um fármaco ou no caso da ocorrência de um efeito secundário relacionado com um fármaco ou de uma redução ou falta de eficácia terapêutica durante o tratamento com um fármaco para o qual existe uma associação cientificamente comprovada entre efeitos secundários significativos relacionados com um fármaco (incluindo efeitos tóxicos) ou uma redução ou falta de eficácia terapêutica e as mutações genéticas investigadas”.
- Limitação 4: “Para medicamentos que não constem da lista do SGKPT, prescrição da análise apenas por médicos com uma pós-graduação federal em farmacologia clínica e toxicologia de acordo com a Lei Federal de 23 de Junho de 2006 sobre as Profissões Médicas Universitárias (Medical Professions Act, MedBG; SR 811.11)”.
Do ponto de vista ético, a Limitação 3 também é digna de nota, segundo a qual os testes não devem ser utilizados para fazer um diagnóstico ou para procurar uma predisposição para uma doença genética.
Dicas práticas
Este documento mostra que a farmacogenómica terá uma importância crescente na psiquiatria para o planeamento e implementação da farmacoterapia. Devido à revisão da lista de análises, os testes farmacogenéticos relevantes em psiquiatria estão disponíveis a expensas do seguro de saúde obrigatório se um especialista em farmacologia clínica e toxicologia tiver determinado a necessidade do teste. São necessários conhecimentos adequados para planear testes farmacogenéticos e para interpretar os seus resultados de forma óptima. Este tema deve, portanto, ser mais considerado na formação de especialistas em psiquiatria e psicoterapia, na educação contínua e em programas de formação complementar [37–39]. As sessões de ensino para o público são também necessárias para promover a compreensão geral da farmacogenómica e para optimizar a sua implementação [40]. Recomenda-se a literatura especializada que não só resume os princípios genéticos mas também contém conselhos sobre procedimentos práticos e exemplos clínicos [11]. Tendo em conta o tema difícil e como resultado da nova regulamentação, a colaboração com farmacologistas clínicos e toxicólogos é também particularmente valiosa. A colaboração com profissionais de laboratório formados em genética também é recomendada para a implementação prática.
As indicações para testes farmacogenéticos incluem: Níveis plasmáticos de drogas superiores ou inferiores aos normalmente esperados na dose administrada, sugerindo que o paciente tem uma peculiaridade genética no seu metabolismo. O medicamento deve, portanto, ser um substrato da enzima geneticamente polimórfica citocromo P-450 para ser testado. Quando um paciente é comedicado com inibidores, também deve ser considerado que níveis elevados de plasma podem imitar uma deficiência genética metabólica como resultado da interacção medicamentosa. Da mesma forma, a co-medicação com um fármaco indutor de enzimas pode levar a uma redução do nível plasmático, que não é determinado geneticamente. Os testes farmacogenéticos devem portanto ser geralmente considerados como um complemento à Monitorização Terapêutica de Medicamentos (TDM) (Fig. 2). Esta abordagem é também recomendada pela Arbeitsgemeinschaft für Neuropsychopharmakologie und Pharmakopsychiatrie (AGNP), que está actualmente a reeditar uma “Directriz de Consenso” para o TDM: descreve a utilização óptima do TDM apenas, mas também em combinação com testes farmacogénicos [41,42].
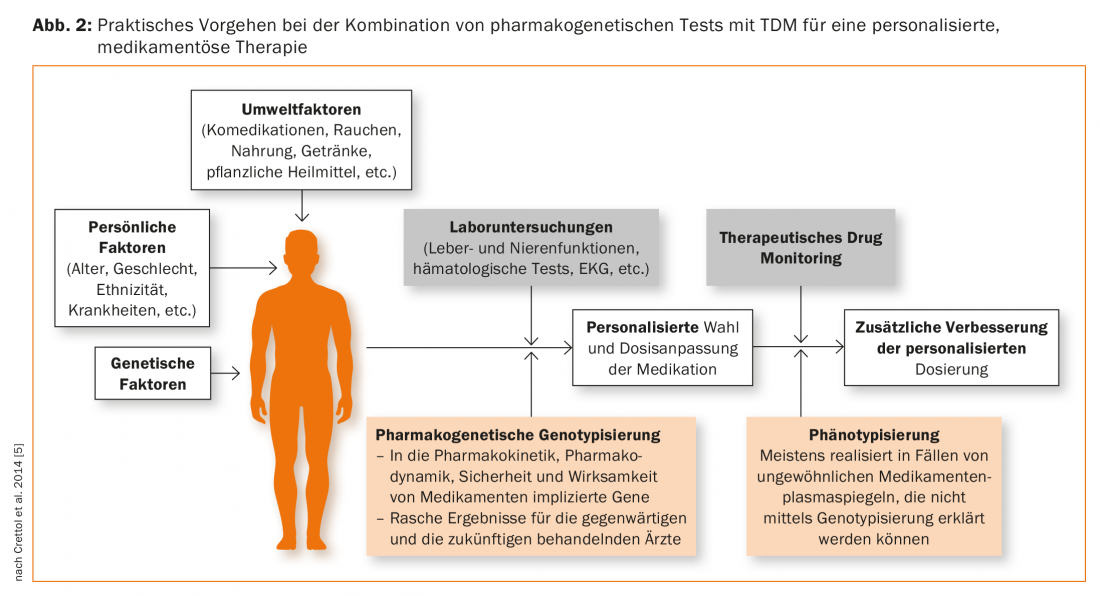
A genotipagem conduz a resultados que têm validade vitalícia e representam, portanto, uma espécie de “marcador de traços”. O resultado de um fenótipo, tal como a determinação de uma taxa metabólica, por outro lado, deve ser considerado como um “marcador de estado”. Para este fim, é administrada ao doente uma substância que é o substrato da enzima a ser testada, depois recolhe-se sangue ou urina dependendo do protocolo, depois geralmente determina-se a substância parental e o metabolito. A razão metabólito / substância mãe fornece um quociente metabólico, que é uma medida da capacidade metabólica da enzima testada, como ilustrado acima utilizando o exemplo do debrisoquintest. O resultado pode fornecer informação sobre o perfil genético do paciente, na medida em que o EM e o PM diferem no quociente metabólico. Contudo, se o doente estiver sob a influência de drogas ou outras substâncias estranhas que inibem ou induzem a enzima, esta influência ambiental mascara o componente genético do metabolismo da substância em estudo. Na psiquiatria, os seguintes fenótipos são comuns: CYP2D6 (dextrometorfano como substância de teste), CYP2C19 (omeprazol), CYP1A2 (cafeína), CYP2B6 (bupropion), CYP3A (midazolam) [43,44]. A fenotipagem é particularmente útil para enzimas como CYP1A2 e CYP3A (CYP3A4), que mostram grandes diferenças interindividuais na sua actividade, mas para as quais não se conhece nenhum polimorfismo genético clinicamente relevante, pelo que a genotipagem não é útil. Fexofenadina [44] ou digoxina [45] foram sugeridos para fenotipagem da actividade ABCB1. Dependendo da questão, várias amostras para as diferentes enzimas ou transportadores podem ser administradas simultaneamente como um “cocktail” [44,45]. A fenotipagem é portanto um complemento à TDM e à genotipagem (Fig. 2) [46], pois o resultado fornece informações sobre o estado real da actividade enzimática ou do transportador no momento do teste [42].
Informações tais como níveis plasmáticos de medicamentos, comedicamentos, comorbilidades, natureza de quaisquer efeitos secundários, informações sobre a resposta terapêutica aos medicamentos, são úteis e necessárias para o farmacologista clínico justificar uma prescrição. No caso de questões farmacogenéticas, os Centros Suíços de Farmacologia Clínica e Toxicologia oferecem consultas, e os pacientes podem ser encaminhados para testes farmacogenéticos numa base consultiva.
Conclusões
Chegou agora o momento de avançar com a implementação de testes farmacogenéticos em psicofarmacoterapia. Podem ser uma ferramenta valiosa para complementar as investigações clínicas, bem como a TDM (Fig. 2) . Autoridades como a FDA e a EMA, bem como organismos científicos como PharmGKB e CPIC, publicam regularmente recomendações para o uso clínico de testes farmacogenéticos. Assim, existem agora directrizes que foram desenvolvidas por organismos independentes e que são adequadas para utilização na prática clínica diária. Promovem a correcta implementação e interpretação dos resultados dos testes farmacogenéticos e, por conseguinte, uma terapia optimizada em função do genótipo [48]. É importante que o resultado genético seja colocado no contexto geral da terapia do paciente, ou seja, que influências não genéticas como a co-medicação sejam tidas em conta no ajustamento da terapia. No entanto, são agora também necessárias directrizes adaptadas a nível regional, a fim de permitir uma aplicação económica e clinicamente sensata adaptada às condições locais, na sequência da decisão política de tornar os testes farmacogenéticos sujeitos a determinadas condições obrigatórias para o sistema de seguro de saúde e, assim, mais acessíveis. A aplicação inadequada pode levar a resultados decepcionantes e o médico praticante perderá a confiança na farmacogenómica e na terapia personalizada a médio prazo [49]. Como mencionado acima, o tema da “farmacogenómica na psiquiatria” deve ser cada vez mais considerado na educação e formação de especialistas em psiquiatria e psicoterapia [37–39]. Por conseguinte, é necessário promover a cooperação entre psiquiatras e médicos praticantes, por um lado, e o especialista em farmacologia clínica, por outro. Ao mesmo tempo, há ainda muitas questões por resolver, razão pela qual ainda são necessários estudos clínicos adequadamente planeados e conduzidos sobre farmacogenética, em particular.
Literatura:
- Alexanderson B, Evans DA, Sjöqvist F: Níveis plasmáticos estáveis de nortriptilina em gémeos: influência de factores genéticos e terapia medicamentosa. British Medical Journal 1969; 4(686): 764-768.
- Mahgoub A, et al: Hidroxilação polimórfica de detritos no homem. Lancet 1977: 584-6.
- Gonzalez FJ, et al: Characterization of the common genetic defect in humans deficiente in debrisoquine metabolism. Natureza 1988; 331: 442-446.
- Bertilsson L, et al: Lenta hidroxilação da nortriptilina e concomitante pobre hidroxilação da nortriptilina: implicações clínicas. Lancet 1981; i: 560-561.
- Crettol S, et al: Pharmacogenomics in psychiatry: desde a monitorização de medicamentos terapêuticos até à medicina genómica. Clin Pharmacol Ther 2014; 95(3): 254-257.
- Pratt V, et al: Medical Genetics Summaries. Bethesda (Md), EUA: National Center for Biotechnology Information; 2017. 416 p.
- Zhang G, Nebert DW: Medicina personalizada: previsão do risco genético da resposta aos medicamentos. Pharmacol Ther 2017; 175: 75-90.
- MV Relling, Evans WE: Farmacogenómica na clínica. Natureza 2015; 526(7573): 343-350.
- Patil J: Farmacogenética e Farmacogenómica: Uma breve introdução. Journal of Pharmacovigilance 2015; 3: e139.
- Sim SC, Ingelman-Sundberg M: biomarcadores farmacogenómicos: novas ferramentas na terapia medicamentosa actual e futura. Tendências Pharmacol Sci 2011; 32(2): 72-81.
- Dingermann T, Zündorf I: Farmacoterapia estratificada. Genética básica, procedimento prático. Eschborn, Alemanha: Govi; 2017. 339 p.
- Gandal MJ, et al: The road to precision psychiatry: traduzindo a genética em mecanismos de doença. Nat Neurosci 2016; 19(11): 1397-1407.
- Lohoff FW, Ferraro TN: Considerações farmacogenéticas no tratamento de doenças psiquiátricas. Expert Opinion Pharmacother 2010; 11(3): 423-439.
- Budde M, et al: Pharmacogenomic aspects of bipolar disorder: An update. Eur Neuropsicofarmacol 2017; 27(6): 599-609.
- Malhotra AK, Zhang JP, Lencz T: Pharmacogenetics in psychiatry: traduzindo a investigação em prática clínica. Mol Psychiatry 2012; 17(8): 760-769.
- Wolking S, et al: Impact of Genetic Polymorphisms of ABCB1 (MDR1, P-Glycoprotein) on Drug Disposition and Potential Clinical Implications: Update of the Literature. Farmacocinética Clínica 2015; 54(7): 709-735.
- Caudle KE, et al: Padronização dos termos dos resultados dos testes farmacogenéticos clínicos: termos consensuais do Clinical Pharmacogenetics Implementation Consortium (CPIC). Genet Med 2017; 19(2): 215-223.
- Hicks JK, et al: Clinical pharmacogenetics implementation consortium guideline (CPIC) for CYP2D6 and CYP2C19 genotypes and dosing of tricyclic antidepressants: actualização de 2016. Clin Pharmacol Ther 2017; 102(1): 37-44.
- Gasche Y, et al: intoxicação por codeína associada ao metabolismo do CYP2D6 ultrarápido. N Engl J Med 2004; 351(27): 2827-2831.
- McCormack M, et al: HLA-A*3101 e reacções de hipersensibilidade induzidas por carbamazepina em europeus. N Engl J Med 2011; 364(12): 1134-1143.
- de Leon J: Traduzindo a Farmacogenética à Prática Clínica: O Citocromo P450 2D6 Metabolizadores Ultrarápidos Precisa de Doses de Atomoxetina Mais Elevadas? J Am Acad Child Adolescent Psychiatry 2015; 54(7): 532-534.
- Whirl-Carrillo M, et al: Conhecimentos farmacogenómicos para medicina personalizada. Clin Pharmacol Ther 2012; 92(4): 414-417.
- McDonagh EM, et al: Da aquisição de conhecimentos farmacogenómicos a aplicações clínicas: o PharmGKB como um recurso farmacogenómico clínico biomarcador. Biomark Med 2011; 5(6): 795-806.
- Dickmann LJ, Ware JA: A farmacogenómica na era da medicina personalizada. Drug Discov Today Technol 2016; 21-22: 11-6.
- Stingl JC, Brockmoller J, Viviani R: Variabilidade genética das enzimas metabolizadoras de drogas: o duplo impacto na terapia psiquiátrica e na regulação da função cerebral. Mol Psychiatry 2013; 18(3): 273-287.
- Stingl JC, Brockmoller J: [Farmacogenética personalizada. Orientações baseadas em provas e aplicação clínica de diagnósticos farmacogenéticos]. Bundesgesundheitsblatt, Investigação em Saúde, Protecção da Saúde. 2013; 56(11): 1509-1521.
- Ravyn D, et al: CYP450 estratégias de tratamento farmacogenético para antipsicóticos: uma revisão das provas. Schizophr Res 2013; 149(1-3): 1-14.
- Fabbri C, et al: Progressos e perspectivas em farmacogenética de medicamentos antidepressivos. Parecer de especialista Drug Metab Toxicol 2016; 12(10): 1157-1168.
- Spina E, de Leon J: Aplicações clínicas da genotipagem de CYP em psiquiatria. J Transmissão Neural (Viena) 2015; 122(1): 5-28.
- Holsboer-Trachsler E, et al: Traitement aigu des épisodes dépressifs. Swiss Medical Forum 2016; 16(35): 716-724.
- Uhr M, et al: Polimorfismos no gene do transportador de drogas ABCB1 prevêem resposta ao tratamento antidepressivo na depressão. Neuron 2008; 57(2): 203-209.
- Breitenstein B, et al: Variantes do gene ABCB1 e resultado do tratamento antidepressivo: Uma meta-análise. Am J Med Genet B Neuropsychiatr Genet 2015; 168B(4): 274-283.
- Breitenstein B, et al: Associação de variantes do gene ABCB1, concentração plasmática antidepressiva, e resposta ao tratamento: Resultados de um estudo clínico aleatório. J Psiquiatra Res 2016; 73: 86-95.
- Bruckl TM, Uhr M: genotipagem ABCB1 no tratamento da depressão. Farmacogenómica 2016; 17(18): 2039-2069.
- Bschor T, et al:[Genetic tests for controlling treatment with antidepressants]. Neurologista 2017; 88(5): 495-499.
- O’Brien FE, et al: Human P-glycoprotein afecta diferentemente o transporte de medicamentos antidepressivos: relevância para a permeabilidade da barreira hemato-encefálica. Int J Neuropsicofarmacol 2013; 16(10): 2259-2272.
- Baumann P, et al: Uma proposta para um catálogo de objectivos de aprendizagem psicofarmacologia-farmacoterapia e um currículo na Europa. Mundo J Biol Psiquiatria 2017; 18(1): 29-38.
- Whirl-Carrillo M, et al: Novel Disease Database Demonstrating Applicability for Pharmacogenomic-Based Prescribing. Clin Pharmacol Ther 2016; 100(6): 600-602.
- Collins SL, Carr DF, Pirmohamed M: Avanços na Farmacogenómica das Reacções Adversas às Drogas. Drug Saf 2016; 39(1): 15-27.
- Green ED, Guyer MS; National Human Genome Research I: Traçar um curso de medicina genómica desde os pares de bases até à cabeceira da cama. Natureza 2011; 470(7333): 204-213.
- Hiemke C, et al: AGNP consensus guidelines for therapeutic drug monitoring in psychiatry: Update 2011. Pharmacopsychiatry 2011; 44(6): 195-235.
- Hiemke C, et al: Consensus Guidelines for Therapeutic Drug Monitoring in Neuropsychopharmacology: Update 2017. Pharmacopsychiatry 2017 Set 14. doi: 10.1055/s-0043-116492. [Epub ahead of print]
- Hiemke C, Shams M: Fenotipagem e genotipagem do metabolismo de medicamentos para orientar a farmacoterapia em psiquiatria. Curr drug deliv 2013; 10(1): 46-53.
- Bosilkovska M, et al.: cocktail de Genebra para avaliação da actividade do citocromo p450 e da glicoproteína P utilizando manchas de sangue secas. Clin Pharmacol Ther 2014; 96(3): 349-359.
- Fuhr U, Jetter A, Kirchheiner J: Procedimentos apropriados de fenotipagem para enzimas metabolizadoras e transportadores de drogas em humanos e a sua utilização simultânea na abordagem “cocktail”. Clin Pharmacol Ther 2007; 81(2): 270-283.
- Crettol S, et al.: Pharmacogenomics in psychiatry – da TDM à medicina genómica. Clin Pharmacol Ther 2014; 95(3): 254-257.
- Baumann P, et al: Ataque epiléptico após tratamento com sertralina num adolescente que sofre de distúrbio obsessivo compulsivo e apresenta um raro estado farmacogenético. J Clin Psychopharmacol 2006; 26(6): 679-681.
- Amstutz U, Carleton BC: Testes farmacogenéticos: tempo para directrizes de prática clínica. Clin Pharmacol Ther 2011; 89(6): 924-927.
- de Leon J: Testes farmacogenéticos em Psiquiatria: Do Medo ao Fracasso ao Hype. J Clin Psychopharmacol 2016; 36(4): 299-304.
- Mlakar V, et al: Pharmacogenomics in Pediatric Oncology: Review of Gene-Drug Associations for Clinical Use. Int J Mol Sci 2016; 17(9): 1502.
InFo NEUROLOGIA & PSYCHIATRY 2017; 15(6): 21-30.