A endocardite infecciosa é uma infecção do endocárdio e especialmente dos folhetos das válvulas com uma incidência anual de 3-10/100.000 pessoas. Com elevada mortalidade e morbilidade, estratégias de prevenção como a adesão à profilaxia antibiótica (AP) em doentes com condições cardíacas pré-existentes são da maior prioridade. As directrizes actuais limitam a PA a doentes de alto risco e procedimentos principalmente na área oral/dentária.
A endocardite infecciosa (IE) é uma infecção do endocárdio e em particular dos folhetos das válvulas, com uma incidência anual de 3-10 por 100.000 pessoas [1–3]. A principal característica do IE são as vegetações valvulares infectadas, que podem embolizar o corpo e formar mais focos sépticos de infecção. O prognóstico da doença é pobre com uma mortalidade hospitalar de 15-20% e uma mortalidade de um ano de 30% [1,4]. A morbilidade dos sobreviventes é elevada, com risco residual de recorrência, nova infecção ou deterioração progressiva da função das válvulas, que pode estar associada à insuficiência cardíaca e à necessidade de mais intervenções médicas e cirúrgicas [1,4]. Apesar das melhorias nas terapias médicas e cirúrgicas ao longo dos últimos 30 anos, o IE continua a ser uma das doenças infecciosas mais mortíferas.
Com uma mortalidade e morbilidade persistentemente elevadas, estratégias de prevenção como a adesão à profilaxia antibiótica (AP) em doentes com doenças cardíacas pré-existentes são uma prioridade máxima. As directrizes da AP sobre endocardite foram estabelecidas pela primeira vez pela Associação Americana do Coração (AHA) em 1955, embora as directrizes tenham mudado consideravelmente desde a sua introdução. Assim, muitos países e sociedades profissionais modificaram as directrizes e adaptaram-nas às suas próprias necessidades. Além disso, uma simplificação teve lugar em 2008.
A necessidade de protecção antibiótica tem sido limitada aos doentes de alto risco, com os doentes em risco intermédio de EI já não incluídos na maioria das directrizes actuais. Estes incluem válvula aórtica bicúspide, prolapso da válvula mitral, bem como defeito do septo ventricular (VSD) e botalli de canal persistente (PDA). Devido à falta de dados clínicos (especialmente a falta de um ensaio controlado aleatório sobre o tema), a AP para evitar o IE continua a ser um tema controverso. Actualmente, as seguintes directrizes são válidas para a Suíça: as directrizes da AHA de 2007 [3], as directrizes da AP revistas em 2008 por Flückiger et al. [5] e as Orientações do CES de 2015 [6]. Desde 2008, as directrizes suíças de profilaxia da endocardite [5] não foram revistas. Uma vez que existem certas divergências em relação às Orientações do CES 2015 [6] sobre o tema, gostaríamos de aproveitar esta oportunidade para discutir certos pontos e inovações.
Contexto histórico: o caminho para a simplificação e restrição
O IE como entidade da doença foi descrito pela primeira vez em 1870 por Winge et al. descrita [8]. A hipótese de que as bactérias podem entrar na circulação durante um procedimento dentário invasivo e assim causar IE foi apresentada pela primeira vez por Lewis e Grant em 1923, embora esta tese não tenha sido provada até 1935 por Okell e Elliott. Assim, estes autores foram capazes de deduzir que 61% dos pacientes têm hemoculturas positivas para Streptococcus viridans após a extracção dentária, enquanto que o Streptococcus viridans é conhecido por ser identificado como o germe causador em 40-45% dos casos de EI. Conhecendo o efeito antimicrobiano das sulfonamidas, foi postulado pela primeira vez em 1930 que um PA poderia levar a uma redução da frequência do EI. First Hirsch et al. mostrou uma redução na bacteremia estreptocócica com penicilina num ensaio aleatório, abrindo caminho para as primeiras directrizes oficiais da AHA sobre a profilaxia da endocardite em 1955.
Directrizes Suíças para a Profilaxia da Endocardite
Depois de Moreillon ter publicado as primeiras directrizes suíças sobre o assunto em 2000 [9], as directrizes foram consideravelmente simplificadas em 2008. Isto baseou-se nas seguintes considerações:
- Actividades diárias como a escovagem ou mastigação são mais susceptíveis de causar IE do que a cirurgia dentária
- Mesmo com 100% de eficácia de um PA, apenas um pequeno número de EI pode ser evitado com PA
- Os doentes de alto risco têm mais probabilidades de ter um curso letal de EI do que outros doentes
- Os efeitos secundários dos antibióticos e os seus custos devem ser tidos em conta.
As directrizes suíças revistas de 2008 sobre a profilaxia da endocardite [5] baseiam-se nas directrizes da AHA de 2007 [3] e nas directrizes da AP alemã de 2007 [10]. O uso de profilaxia antibiótica para prevenir o EI é geralmente considerado justificado porque o EI é raro mas associado a uma elevada mortalidade e morbilidade. Além disso, a prevenção de medicamentos curtos é preferível à terapia prolongada de uma infecção, especialmente em pacientes com doenças cardíacas anteriores ou episódios anteriores de EI que estejam em risco de recidiva. Além disso, as bactérias da flora oral, do tracto gastrointestinal e do trato urogenital podem promover o IE. Em última análise, a eficácia de um PA para prevenir um EI só poderia ser demonstrada em experiências em animais, mas um PA é muito provavelmente eficaz em humanos.
Medidas perioperatórias não específicas e gerais
É importante aderir a medidas perioperatórias gerais como a higiene dentária, oral e cutânea completa para todos os pacientes, especialmente para o grupo de alto risco [6]. Uma boa higiene oral é muito mais importante em todos os casos do que um antibiótico em algum momento da vida, uma vez que a bacteriemia ocorre diariamente mesmo quando se mastiga e escovam os dentes. Evitar piercings e tatuagens é também muito importante neste contexto. Se existirem feridas no momento da cirurgia, então estas devem ser cuidadosamente desinfectadas. Além disso, quaisquer focos infecciosos devem ser devidamente tratados com antibióticos e quaisquer agentes patogénicos devem ser erradicados para reduzir a colonização bacteriana. Em doentes de alto risco, a indicação para cateteres venosos centrais e exames invasivos deve ser reservada, e as medidas de higiene hospitalar devem ser urgentemente observadas.
Indicações para a profilaxia de endocardite
AP só é recomendado para pacientes de alto risco submetidos a procedimentos bem definidos que estão associados a um risco acrescido de bacteremia (Tab. 1) . Os pacientes que recebem profilaxia perioperatória com antibióticos não necessitam de profilaxia de endocardite porque as bactérias encontradas durante a cirurgia planeada já estão cobertas pela administração do antibiótico especificamente escolhido.
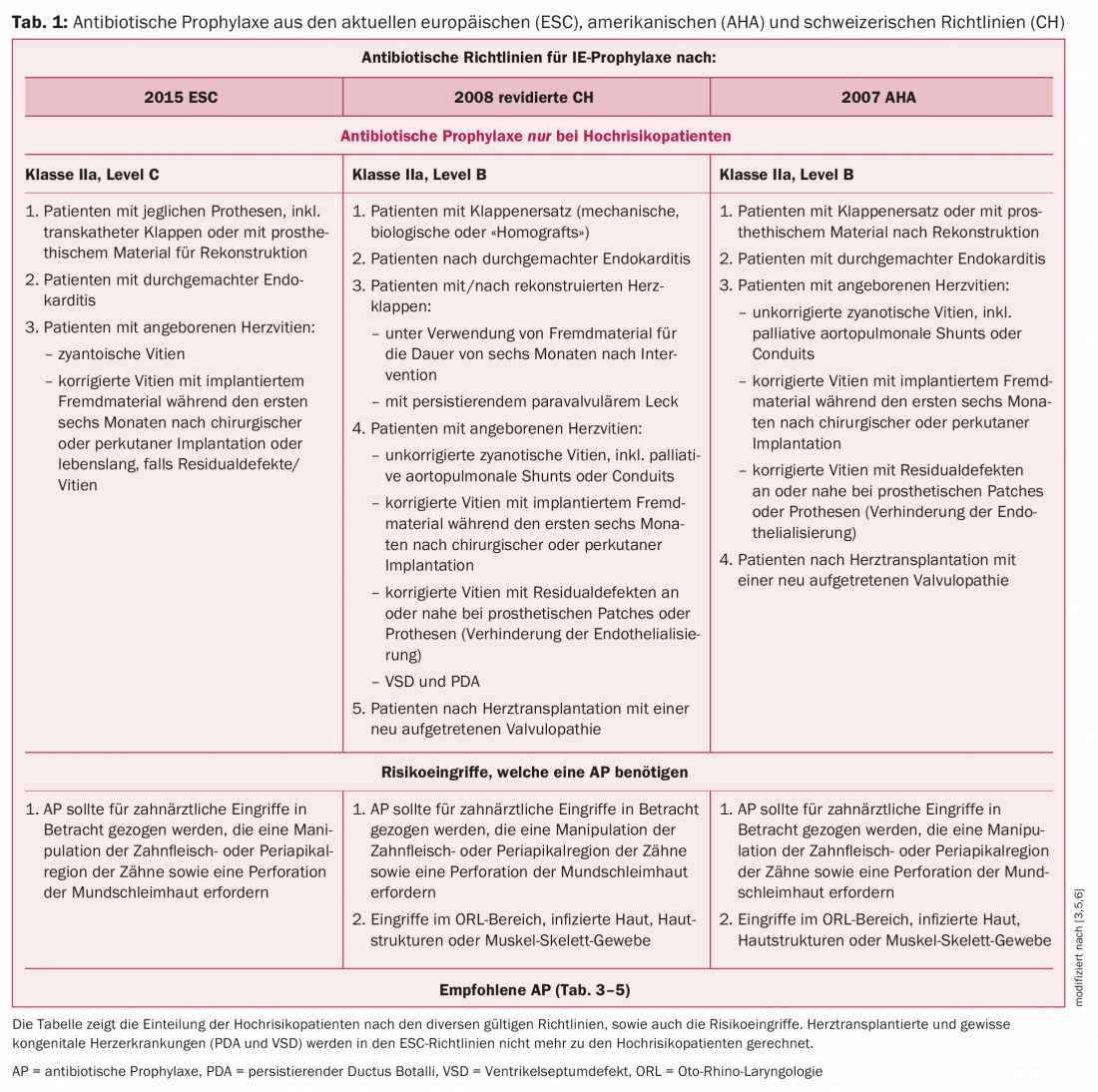
Os pacientes de alto risco são definidos de forma diferente, dependendo das directrizes. Resumidamente, este grupo pode ser dividido em pacientes com material protético, pacientes com doença cardíaca congénita ou endocardite anterior. Enquanto as directrizes da AHA e da Suíça ainda contavam pacientes de transplante cardíaco como pacientes de alto risco, as directrizes europeias de 2015 já não consideram este grupo para a profilaxia da endocardite. Este é um tema controverso e existem diferentes opiniões sobre o assunto, dependendo do grupo de trabalho. Devido à imunossupressão com maus resultados na EI, bem como à valvulopatia frequentemente presente (por exemplo, regurgitação tricúspide em consequência de biópsias cardíacas repetidas), continuamos a recomendar a PA antes de intervenções de alto risco, em contraste com as directrizes do CES. Para detalhes sobre a definição de pacientes de alto risco, ver o Quadro 1 e o Quadro 2.

Classificação do AP de acordo com intervenções e sistemas de órgãos
AP é definido como uma dose única (peroral ou parenteral) de um antibiótico administrado 30-60 minutos antes da intervenção. O objectivo é maximizar a eficácia do antibiótico durante o procedimento. Para pequenas intervenções, principalmente procedimentos dentários ou procedimentos sobre a pele, a administração peroral é favorecida, para intervenções maiores e/ou administração parentérica anestésica. AP como dose única antes da intervenção é limitada aos procedimentos dentários para prevenir o desenvolvimento de IE como resultado de bacteremia transitória. Todos os outros procedimentos no tracto respiratório, área cutânea, tracto urogenital e tracto gastrointestinal sem evidência de infecção já não são uma indicação para AP [6]. Uma excepção importante é a cirurgia abdominal electiva, onde é recomendada uma dose parenteral única (profilaxia perioperatória de antibióticos). No caso de infecções pré-existentes, a PA deve ser vista como a primeira dose de um tratamento antibiótico de longa duração e necessário. Neste caso, recomendamos a consulta de um infectologista a fim de ajustar de forma óptima a terapia antibiótica. As recomendações de dose para a profilaxia de AP única assumem a função renal e hepática normal. Um ajuste da dose não é normalmente necessário para uma única dose, mas é evidentemente necessário para terapias de longo prazo. As directrizes da AP para crianças são muito semelhantes às dos adultos. A única diferença aqui é a dosagem de antibióticos.
Procedimentos dentários
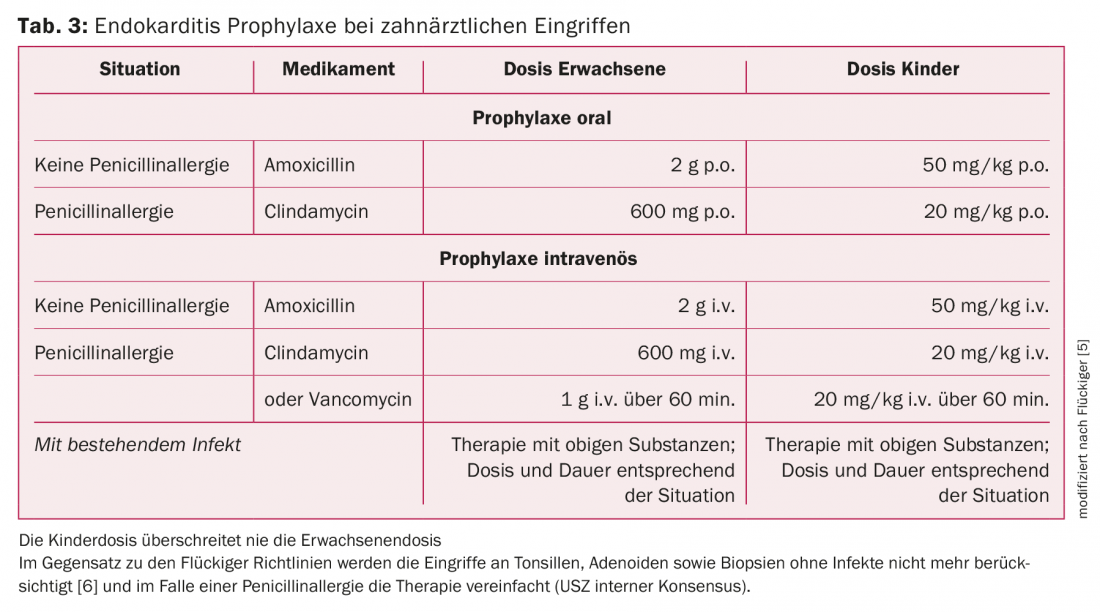
Dentes e/ou maxilares: O principal pré-requisito para reduzir a frequência do EI é uma boa higiene oral, uma vez que as manipulações diárias na cavidade oral, tais como escovar os dentes, podem causar bacteremia. Para pacientes em risco, é indicado um check-up dentário duas vezes por ano. AP é indicado para manipulações dentárias que envolvem a gengiva ou a região periapical dos dentes ou perfuram a mucosa oral (extracções, procedimentos cirúrgicos, tratamentos de abscesso, terapia periodontal, biópsias). Os agentes patogénicos mais comuns na cavidade oral que podem causar IE são os estreptococos do grupo dos viridianos e, consequentemente, a penicilina ou a amoxicilina são os antibióticos de primeira escolha. No caso da alergia à penicilina, as directrizes suíças para a escolha dos antibióticos distinguem entre reacção de tipo tardio (cefuroxima) e reacção de tipo imediato (clindamicina). As directrizes do CES simplificam isto e simplesmente tratam qualquer alergia à penicilina com clindamicina. Para detalhes sobre a AP recomendada, ver quadro 3.
Procedimentos não dentários
Tracto respiratório: Nas directrizes suíças de 2008, a AP foi geralmente considerada indicada. Tendo em conta as Directrizes do CES 2015, consideramos que um PA para broncoscopia, laringoscopia ou intubação já não é indicado. O AP também não é indicado para uma amigdalectomia ou adenotomia, a menos que haja uma infecção. Os pacientes de alto risco (tab. 2) que recebem um procedimento invasivo para tratar uma infecção estabelecida (drenagem de abscesso) devem, no entanto, receber profilaxia ou terapia análoga ao procedimento para procedimentos dentários (tab. 3).
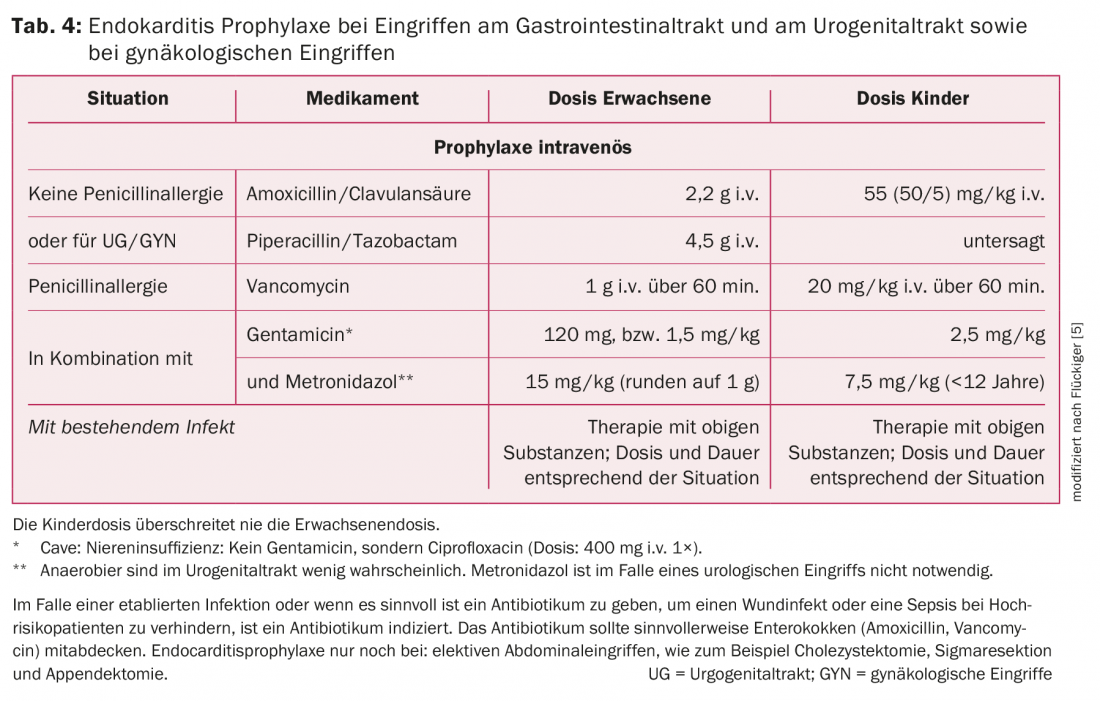
Tracto gastrointestinal: A maioria dos procedimentos no tracto gastrointestinal, tais como endoscopias (gastroscopia ou colonoscopias com ou sem biopsia), não requerem AP. No entanto, no caso de uma infecção estabelecida ou quando faz sentido dar um antibiótico para prevenir a infecção ou septicemia em doentes de alto risco, é indicado um antibiótico. Além disso, os procedimentos abdominais electivos (colecistectomia, ressecção sigmóide, apendicectomia) são uma indicação para AP. Aqui, recomenda-se o AP parentérico 30 minutos antes da intervenção. A terapia de escolha é amoxicilina/ácido clavulânico, já que o objectivo aqui é cobrir enterococos e anaeróbios. Em caso de alergia à penicilina, a vancomicina é indicada, embora as substâncias activas contra bactérias gram-negativas e anaeróbias devam ser aqui suplementadas.
Nas infecções pré-existentes, a PA é a primeira dose de uma terapia antibiótica de longa duração e necessária. Mais uma vez, um antibiótico com actividade contra enterococos, bactérias gram-negativas e anaeróbias é recomendado Para mais detalhes sobre as recomendações de AP no tracto gastrointestinal, ver quadro 4.
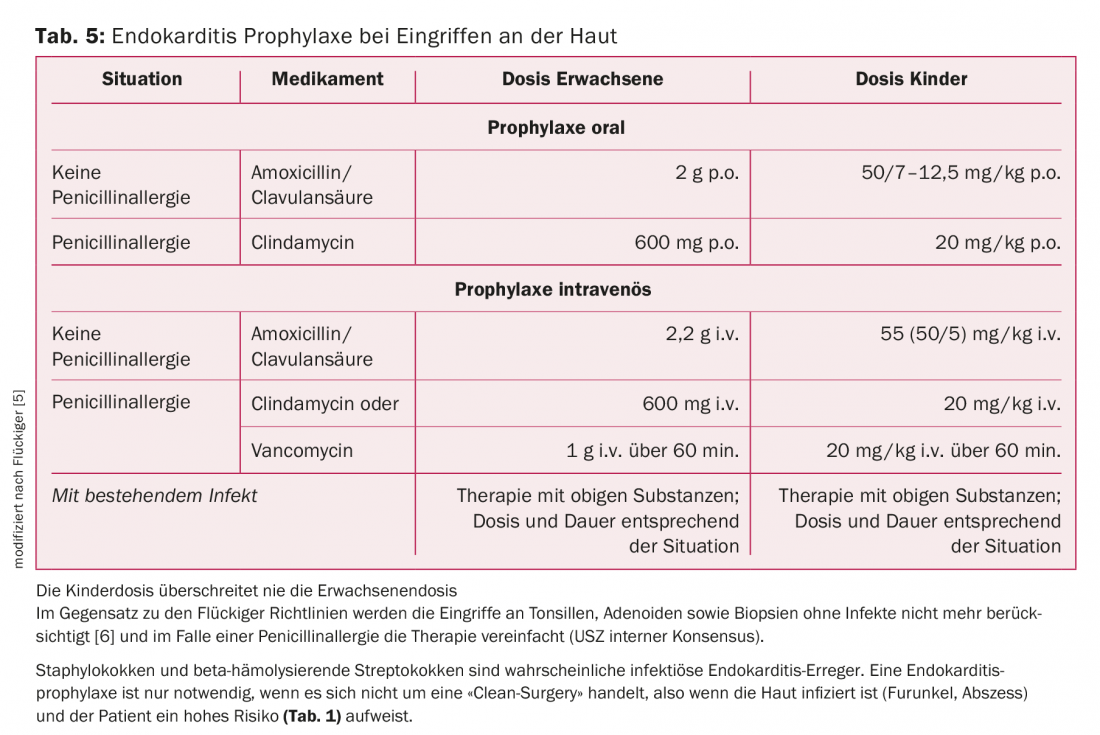
Tracto geniturinário: procedimentos cirúrgicos ou endoscópicos na presença de urina estéril ou ausência de infecção não requerem AP. Se estiver presente uma infecção, deve ser escolhido um antibiótico com efeito enterocócico. Em certas circunstâncias, um suplemento com uma preparação contra germes gram-negativos é útil (tab. 5).
Pele: Os agentes patogénicos mais comuns nas infecções de pele são os estafilococos e os estreptococos. AP só é indicado se não for uma “cirurgia limpa”, ou seja, se a pele estiver infectada (fervura, abcesso) e o paciente estiver em alto risco (tab. 2). Amoxicilina/ácido flavulânico é o tratamento de escolha (tab. 5).
Discussão
A endocardite infecciosa continua a ser uma das doenças infecciosas mais mortíferas e, portanto, a prevenção é a melhor terapia para o IE. Por esta razão, recomendamos geralmente o AP para evitar o IE apesar da falta de dados e consenso. A questão continua a ser altamente controversa e existem divergências de tratamento no seio dos mesmos grupos de trabalho. Propomos a última directriz do CES como principal referência para a profilaxia da endocardite. A remoção de pacientes de transplante de coração do grupo de pacientes de alto risco continua a não ser clara para nós. Para estes pacientes, recomendamos sempre a consulta ao cardiologista assistente antes de um procedimento de alto risco.
Na nossa opinião, a AP das directrizes suíças para intervenções dentárias pode ser simplificada e adaptada às directrizes do CES. O ajustamento de acordo com o tipo de alergia parece-nos bastante pesado na vida quotidiana. Ajustámos isto em conformidade nas nossas directrizes internas. Nas directrizes suíças, a PA sem infecção activa só é recomendada para procedimentos dentários e determinados procedimentos do tracto respiratório. As directrizes do CES, por outro lado, apenas consideram os procedimentos dentários como intervenções de alto risco. Em qualquer caso, uma dentição própria reabilitada parece ser uma das medidas profilácticas mais importantes.
Estudos mais focalizados e prospectivos deverão eventualmente clarificar a questão há muito existente e fornecer melhores dados sobre o risco de eventos adversos dos antibióticos no IE. As novas directrizes da AHA estão planeadas para 2018 e, se necessário, estas dar-nos-ão uma visão sobre novos aspectos e tópicos para uma discussão renovada.
Mensagens Take-Home
- Como uma correlação marcante entre os procedimentos dentários, a subsequente bacteremia transitória e endocardite infecciosa foi observada, as directrizes para a profilaxia da endocardite foram estabelecidas pela primeira vez pela Associação Americana do Coração (AHA) em 1955.
- Desde a criação destas directrizes, e na ausência de dados suficientes, estas foram revistas e simplificadas várias vezes.
- As directrizes actuais limitam a profilaxia antibiótica (AP) aos doentes de alto risco e aos procedimentos orais/dentários, em particular.
- Infelizmente, não há aqui consenso – as várias directrizes definem os doentes de alto risco de forma diferente. Seguindo as orientações recentemente publicadas da Sociedade Europeia de Cardiologia (ESC), recomendamos a adesão à AP ao manipular a gengiva ou região periapical dos dentes neste grupo de alto risco.
Literatura:
- Cahill TJ, Prendergast BD: endocardite infecciosa. Lancet 2016; 387(10021): 882-893.
- Achermann Y, et al: endocardite da válvula protética e infecção da corrente sanguínea devido a Mycobacterium chimaera. J Clin Microbiol 2013; 51(6): 1769-1773.
- Wilson W, et al: Prevention of infective endocarditis: guidelines from the American Heart Association: a guideline from the American Heart Association Rheumatic Fever, Endocarditis, and Kawasaki Disease Committee, Council on Cardiovascular Disease in the Young, and the Council on Clinical Cardiology, Council on Cardiovascular Surgery and Anesthesia, and the Quality of Care and Outcomes Research Interdisciplinary Working Group. Circulação 2007; 116(15): 1736-1754.
- Hoen B, Duval X: endocardite infecciosa. N Engl J Med 2013; 369(8): 785.
- Fluckiger U, Troillet N: [New Swiss guidelines for the prevention of infective endocarditis]. Rev Med Suisse 2008; 4(174): 2134-2138.
- Habib G, et al.: 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endossado por: Associação Europeia de Cirurgia Cardio-Torácica (EACTS), a Associação Europeia de Medicina Nuclear (EANM). Eur Heart J 2015; 36(44): 3075-3128.
- Habib G, et al.: Guidelines on the prevention, diagnosis, and treatment of infective endocarditis (new version 2009): the Task Force on the Prevention, Diagnosis, and Treatment of Infective Endocarditis of the European Society of Cardiology (ESC). Endossada pela Sociedade Europeia de Microbiologia Clínica e Doenças Infecciosas (ESCMID) e pela Sociedade Internacional de Quimioterapia (ISC) para a Infecção e Cancro. Eur Heart J 2009; 30(19): 2369-2413.
- Contrepois A: Notas sobre a história inicial da endocardite infecciosa e o desenvolvimento de um modelo experimental. Clin Infect Dis 1995; 20(2): 461-466.
- Moreillon P: Profilaxia da endocardite revisitada: evidência experimental de eficácia e novas recomendações suíças. Grupo de Trabalho Suíço para a Profilaxia da Endocardite. Schweiz Med Wochenschr 2000; 130(27-28): 1013-1026.
- Naber CK, et al: Novas directrizes para a endocardite infecciosa: um apelo à investigação em colaboração. Int J Antimicrob Agents 2007; 29(6): 615-616.
CARDIOVASC 2017; 16(6): 3-8