O aconselhamento interdisciplinar rápido quando uma malignidade é diagnosticada é imperativo e permite uma “tomada de decisão informada” para as pessoas afectadas. A protecção da fertilidade não deve piorar o prognóstico. O não fornecimento de informação pode ter consequências em termos de responsabilidade. Nas doenças benignas do espectro hematológico, reumatológico e ginecológico, é importante considerar a redução da reserva ovárica. Mesmo com um risco médio ou pequeno de danos nos ovários, pode esperar-se um encurtamento da fase de vida fértil de até dez anos. Após a terapia gonadotóxica na infância, a reserva de fertilidade deve ser verificada na jovem mulher. A criopreservação de oócitos neste momento pode permitir que o desejo de uma criança seja realizado numa data posterior.
<De acordo com o Registo Alemão do Cancro, são diagnosticadas anualmente na Alemanha 1800 crianças com 1500 e 30.000 adultos com idades compreendidas entre os 16 e os 45 anos; na Suíça, o número é de cerca de 250 crianças por ano. Com uma taxa de sobrevivência de 80% para crianças e 50% para todos os grupos etários, isto equivale a milhares de sobreviventes com menos de 45 anos todos os anos. Se acrescentarmos as doenças benignas com a terapia gonadotóxica, o número total de pessoas afectadas cuja fertilidade é reduzida devido a uma doença e a terapia correspondente é muito mais elevada. Há agora também provas de que a gravidez após o cancro não piora o prognóstico, mesmo em tumores dependentes de hormonas, como o carcinoma da mama. A protecção da fertilidade não é portanto um tema exótico, mas diz respeito aos oncologistas, ginecologistas e médicos de clínica geral [1]. O enfoque está no aconselhamento interdisciplinar atempado juntamente com médicos reprodutivos, a fim de permitir às pessoas afectadas – mesmo numa situação excepcional com risco de vida – tomar uma “decisão informada”. Por razões de espaço, limito-me neste artigo à protecção da fertilidade nas mulheres.
Danos na reserva ovariana
Cirurgia, quimioterapia e radioterapia são os pilares da terapia do cancro. Os danos directos causados pelo próprio tumor ou por medidas cirúrgicas afectam as tumorações malignas na pequena pélvis, ou seja, o cólon, os carcinomas ovarianos, uterinos e cervicais.
O efeito gonadotóxico da quimioterapia depende da substância, dose e duração da terapia, bem como da idade da paciente e da reserva ovariana (Tab. 1) [2]. É de esperar um risco acrescido de aborto espontâneo ou malformação nos primeiros seis meses após a conclusão da quimioterapia. Em contraste com a quimioterapia, a radioterapia afecta os ovários e o útero [3].

90% dos pacientes após irradiação total do corpo antes do transplante de células estaminais têm insuficiência ovárica, após irradiação directa da pélvis é quase 100%. Os danos consequentes da radioterapia na infância sobre o útero são fibrose do miométrio e atrofia do endométrio com risco aumentado de aborto e prematuridade. A transposição dos ovários para fora do campo de irradiação não é isenta de problemas.
O método de preservação da fertilidade que pode ser oferecido depende de o diagnóstico oncológico e a janela de tempo até ao início previsto da terapia (tab. 2) . A técnica de vitrificação dos oócitos melhorou decisivamente as hipóteses de sucesso. Em paralelo, a criopreservação do tecido ovariano com retransplantação deixou a fase experimental. Para ambas as opções, é importante lembrar que os pacientes com tumores têm frequentemente um risco mais elevado de tromboembolismo, hemorragia ou infecção. Devem ser tomadas as devidas precauções.

Criopreservação de oócitos ou zigotos
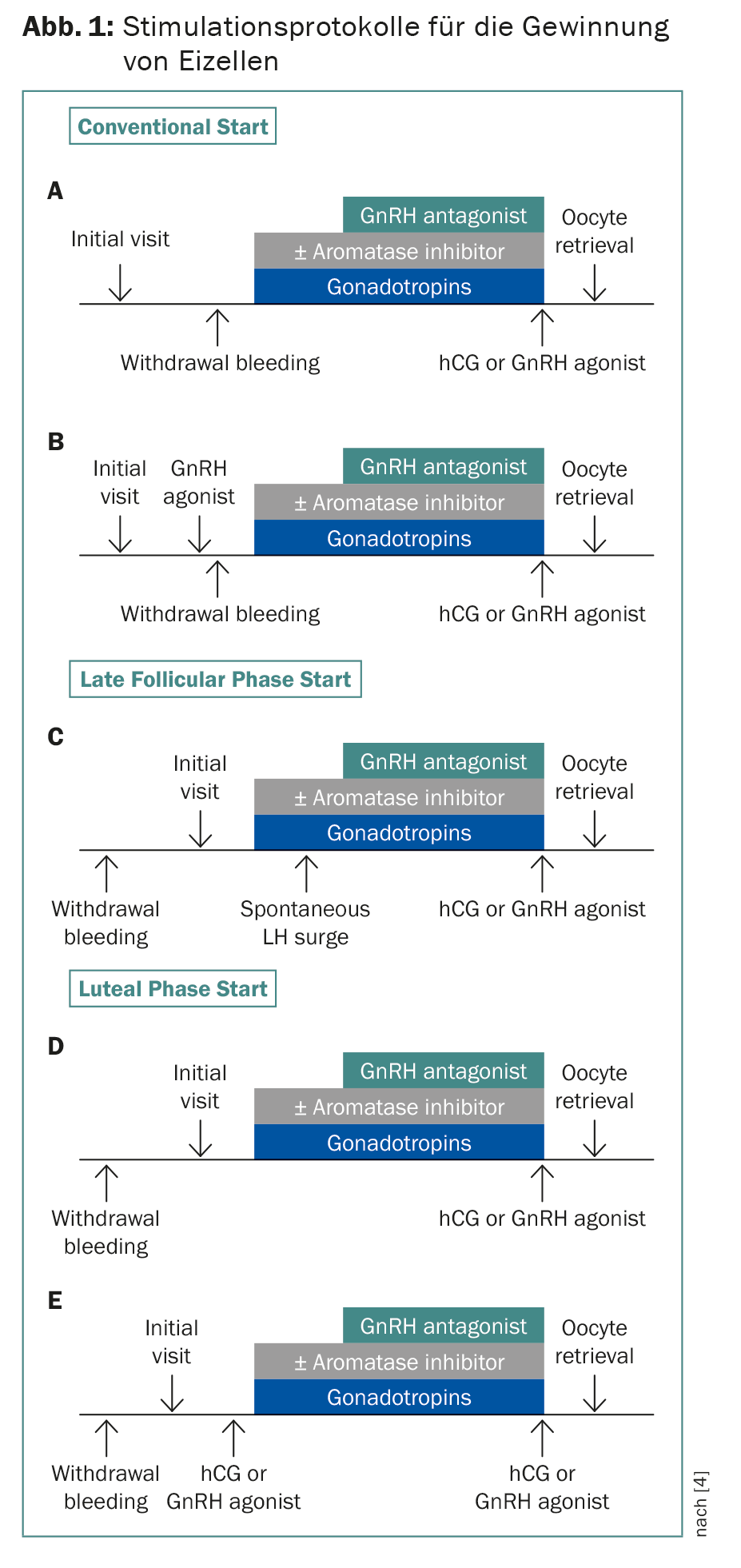
A criopreservação de zigotos e embriões tem sido estabelecida há anos. Graças à técnica de vitrificação, mais de 90% dos oócitos sobrevivem agora. Uma vez que o tempo é geralmente essencial, foram desenvolvidos protocolos de estimulação que começam independentemente do início da menstruação com um atraso de duas a três semanas para a quimioterapia (Fig. 1) . A dupla estimulação também é possível, começando nas fases folicular e luteal. Isto significa que o dobro dos ovos pode ser obtido em quatro semanas. Isto é significativo porque em doentes com menos de 36 anos de idade, são necessários cerca de 12-14 oócitos para o nascimento subsequente de uma criança, e em doentes com 37-39 anos de idade, mais do dobro desse número [4]. A combinação com letrozole baixa os níveis de estrogénio, o que é importante para tumores dependentes de hormonas e para evitar a síndrome de hiperestimulação [5]. Em princípio, aconselho a criopreservação de oócitos em vez de zigotos – mesmo numa relação de casal – para que a mulher mantenha a autonomia reprodutiva.
Criopreservação do tecido ovariano
Já em 2004, Donnez publicou um artigo sobre um nascimento após transplante ortotópico de tecido ovariano [6]. Entretanto, o método abandonou a fase experimental. Laparoscopicamente, um pouco menos de metade de um ovário é removido e criopreservado. Numa análise retrospectiva da rede FertiPROTEKT, foram registadas 21 gravidezes após 95 transplantes para o restovar ou para uma bolsa peritoneal na pequena pélvis [7]. Em 2011, o primeiro bebé suíço nasceu após a retransplantação do tecido ovariano pela equipa do Kinderwunschzentrum Baden. Para a criopreservação do tecido ovariano, devem ser satisfeitas várias condições (Tab. 3).

Analógicos GnRh como terapia adjuvante fertiprotectora
O desenvolvimento de fármacos ovoprotectores é um objectivo urgente para permitir aos doentes manter a fertilidade natural após a terapia citotóxica. Várias substâncias estão a ser avaliadas, mas até agora só foram estabelecidos análogos GnRh. A supressão das gonadotropinas aos níveis pré-puberais e a redução da perfusão utero-ovariana são postulados como mecanismos de protecção. Um grande estudo prospectivo randomizado mostrou que o risco de falha prematura dos ovários pode ser reduzido em 50% [8]. As preocupações de que a terapia com análogos GnRh pudesse reduzir o efeito da quimioterapia foram dissipadas. A terapia pode assim ser generosamente recomendada, também em combinação com outros métodos.
Protecção da fertilidade antes da menarca
Hoje em dia, mais de 80% de todas as crianças que desenvolvem cancro na Suíça sobrevivem. Dois em cada três sofrem de efeitos tardios, incluindo a esterilidade. É claro que a ideia de uma menina de dez anos de idade querer ter filhos mais tarde está longe na altura do diagnóstico do cancro; tudo se resume à sobrevivência. É precisamente por isso que o aconselhamento interdisciplinar dos pais e – na medida do possível – das crianças afectadas é indispensável, para que não se perca nenhuma decisão importante para “a vida após a morte”. Euforicamente, a primeira retransplantação bem sucedida após o congelamento dos ovários na infância foi publicada recentemente [9]. A criopreservação do tecido ovariano é portanto a única opção de protecção da fertilidade em raparigas e mulheres muito jovens, combinada com um procedimento cirúrgico com complicações raras, tais como infecções e hemorragias.
Apenas 8% das raparigas com cancro têm um risco elevado de falha ovariana pós-terapêutica e beneficiam assim da criopreservação do tecido ovariano. Mas mesmo com risco baixo ou médio, pode esperar-se um período fértil encurtado de até dez anos. Isto é ainda mais importante porque ter filhos está a ser cada vez mais adiado para o 4º decénio. A idade média de uma mulher ao nascimento do seu primeiro filho na Suíça é de 31 anos, e a tendência é para aumentar. Como consequência, todas as raparigas sobreviventes na idade adulta jovem precisam de ser aconselhadas relativamente à sua reserva ovariana. A hormona antimuller e o número de folículos anormais são determinados. Isto também é possível sob contracepção oral, os valores são então cerca de 20% mais baixos. Um ciclo espontâneo normal diz pouco sobre uma fase de vida fértil encurtada. A criopreservação de ovos no início dos anos 20 poderia deixar a opção em aberto para a jovem mulher adiar o desejo de ter um filho até à altura desejada – após formação ou universidade.
Protecção da fertilidade em doentes não oncológicos
A protecção da fertilidade tornou-se agora estabelecida em doentes oncológicos. A situação é diferente para as doenças benignas que são tratadas com substâncias gonadotóxicas (Tab. 4) . É também importante saber que doenças auto-imunes como o lúpus eritematoso em si podem ser associadas à redução da reserva ovárica [10]. Em contraste com a situação aguda quando é diagnosticada uma malignidade, estes pacientes têm geralmente tempo suficiente para um aconselhamento diferenciado e criopreservação de um número suficiente de oócitos ou zigotos antes de iniciar a terapia.

O que é que o futuro nos reserva?
Tópicos como a cirurgia de preservação de órgãos para carcinoma epitelial dos ovários em fase inicial, tumores serosos limítrofes dos ovários ou tumores das células estaminais dos ovários, terapia com progestina local e sistémica na fase inicial do carcinoma endometrial ou mesmo transplante do útero após o carcinoma cervical estão em discussão e já foram testados em casos individuais. A maturação in vitro (IVM) de gâmetas imaturas ainda é experimental [11]. Actualmente, muitas questões permanecem sem resposta que precisam de ser esclarecidas por estudos, a fim de se poder oferecer ao doente uma abordagem adequada e segura.
Aspectos legais da protecção da fertilidade
A Lei Federal sobre a Reprodução Assistida Medicamente permite expressamente o armazenamento de células germinais por um período ilimitado no caso de terapia gonadotóxica. No caso de casos malignos, a maioria das pessoas afectadas é informada sobre os métodos de preservação da fertilização; no caso de processos benignos, isto é bastante raro antes da terapia citotóxica. Os casos de responsabilidade vencedora em caso de aconselhamento omitido (ou não documentado) sobre criopreservação de esperma já são conhecidos. Infelizmente, os custos de protecção da fertilidade não são cobertos pelo seguro de saúde.
A entrevista de aconselhamento
Uma rápida avaliação interdisciplinar entre oncologistas e especialistas em fertilidade permite um aconselhamento diferenciado para as pessoas afectadas [12]. Isto envolve questões tais como tipo e fase do tumor, terapia planeada com uma janela de tempo antes de começar, risco de infertilidade após terapia oncológica, condição geral do paciente, mas também resiliência psicológica, situação familiar e ambiente social. A terapia médica reprodutiva nunca deve comprometer o prognóstico do paciente. A discussão com a doente, possivelmente juntamente com o seu parceiro ou pais, é conduzida de acordo com uma lista de verificação (tab. 5).

O exame clínico inclui a sonografia do útero e dos ovários (patologia na pélvis, tamanho uterino e ovariano e número de folículos anormais). A hormona antimulleriana é actualmente considerada o parâmetro prognóstico mais importante no que diz respeito à reserva ovariana.
Para além dos pormenores técnicos de uma possível terapia, a sessão de aconselhamento também se centra nos aspectos emocionais [12]. O paciente e todo o ambiente estão sob o choque de um diagnóstico ameaçador. Termos como perigo de vida, medo de morte, perda, dor, sofrimento, dor e raiva estão na sala. Ao falar da preservação da fertilidade, do desejo de ter filhos mais tarde, podemos estabelecer um contraponto. Queremos dar espaço para a esperança, alegria e sentido na vida, para pensamentos sobre a vida após o cancro.
Literatura:
- von Wolff M, et al: Aconselhamento e tratamento de preservação da fertilidade por razões médicas: dados de uma rede multinacional de mais de 5000 mulheres. Reprod Biomed Online 2015 Nov; 31(5): 605-612.
- Meirow D, et al.: Toxicidade da quimioterapia e da radiação na reprodução feminina. Clin Obstet Gynecol 2010; 53: 727-739.
- Mahajan N: Preservação da fertilidade em doentes com cancro do sexo feminino: Uma visão geral. J Hum Reprod Sci 2015; 8(1): 3-13.
- Cakmak H, et al: Método eficaz para a preservação da fertilidade de emergência: estimulação ovárica controlada de arranque aleatório. Fertil Steril 2013; 100: 1673-1680.
- Rodriguez-Wallberg KA, et al: Preservação da fertilidade e gravidez em mulheres com e sem cancro de mama positivo para mutação BRCA. O Oncologista 2012; 17: 1409-1417.
- Donnez J, et al: Parto vivo após transplante ortotópico de tecido ovariano criopreservado. Lancet 2004; 364: 1405-1414.
- Van der Ven, et al.: Noventa e cinco transplantes ortotópicos de tecido ovariano após tratamento citotóxico numa rede de fertilidade – actividade tecidual, gravidez e taxas de parto. FertiPROTEKT 2015 (em preparação).
- Moore HC, et al: Goserelin para protecção dos ovários durante a quimioterapia adjuvante do cancro da mama. N Eng J Med 2015; 372: 923-932.
- Demeestere I, et al: Nascimento vivo após auto-enxerto de tecido ovariano criopreservado durante a infância. Hum Reprod 2015; 9: 2107-2109.
- Oktem O, et al: Função ovariana e resultados reprodutivos de pacientes do sexo feminino com lúpus eritematoso sistémico e as estratégias para preservar a sua fertilidade. Obsteto Gynecol Surv 2015; 70(3): 196-210.
- Tomao F, et al: Questões especiais na preservação da fertilidade para malignidades ginecológicas. Critério Rev Oncol Hematol 2016 Jan; 97: 206-219.
- Baysal Ö, et al: A tomada de decisão na preservação da fertilidade feminina está a equilibrar o peso esperado do tratamento de preservação da fertilidade e o desejo de conceber. Hum Reprod 2015; 7: 1625-1634.
InFo ONCOLOGy & HEMATOLOGy 2016; 4(1): 30-33