A escolha das modalidades de tratamento do cancro do pulmão depende de vários factores. A preparação precisa, a avaliação da operacionalidade e o conhecimento de factores prognósticos, tais como o número de estações de gânglios linfáticos afectados e a classificação são cruciais. O tratamento padrão para as fases iniciais é a cirurgia primária. Para pacientes em fases avançadas mas ainda operáveis, a quimioterapia neoadjuvante pode melhorar a resectabilidade. Para aumentar as taxas de sobrevivência ao cancro do pulmão, os programas de rastreio devem ser conduzidos em indivíduos em risco.
O cancro do pulmão, com uma taxa de sobrevivência actual de 5 anos de 15,1%, continua a ser uma forma de cancro com uma mortalidade muito elevada. Apesar do financiamento maciço e das melhorias em todas as modalidades de tratamento disponíveis – incluindo terapias de anticorpos de última geração – a mortalidade permaneceu inalterada durante 30 anos [1]. A razão deste desenvolvimento insatisfatório é o facto de o cancro do pulmão só ser geralmente diagnosticado quando a doença já se encontra numa fase avançada.
O cancro do pulmão poderia certamente ser curado, especialmente graças às opções de tratamento cirúrgico, mas na altura do diagnóstico 75% dos doentes afectados já não são curáveis. Esta posição inicial desfavorável só melhorará para os pacientes se for efectuado um rastreio consistente do grupo de risco com TAC de dose baixa de acordo com um algoritmo definido com precisão e se este rastreio for também pago pelos fundos de seguro de saúde. Então o prognóstico poderia realmente ser melhorado, como tem sido documentado cientificamente de forma impressionante [2], e a mortalidade por cancro do pulmão cairia contínua e significativamente. O papel da cirurgia irá mudar à medida que os programas de rastreio surgirem, e os métodos cirúrgicos minimamente invasivos e as ressecções limitadas irão aumentar em conformidade [3].
Encenação
A encenação do cancro do pulmão de células não pequenas (NSCLC) é feita de acordo com a classificação TNM e a encenação clínica de acordo com o AJCC [4]. A encenação é feita após a encenação e é muito relevante para a selecção das modalidades terapêuticas na discussão obrigatória no quadro interdisciplinar de tumores. A preparação adequada do NSCLC inclui a broncoscopia com biopsia e TAC e PET. A determinação da fase exacta do gânglio linfático (fase N) é muito relevante para o planeamento da terapia cirúrgica. O PET tem aqui um grande peso, uma vez que fornece resultados muito fiáveis em termos de valor preditivo negativo (VNP). No entanto, os gânglios linfáticos PET positivos no mediastino devem ser sempre documentados histologicamente (por exemplo, com ultra-sons endobrônquicos, biopsia transbrônquica ou mediastinoscopia), uma vez que a PET é insuficiente em termos de valor preditivo positivo (PPV). Isto também se aplica ao local do tumor primário no parênquima pulmonar. Se nenhuma histologia transbrônquica ou pelo menos citologia de descarga documentar malignidade, punção transtorácica ou ressecção de cunha toracoscópica é recomendada para completar o estadiamento [5–7].
Operabilidade
A maioria dos pacientes com NSCLC são activos ou ex-fumadores com comorbidade pulmonar e cardíaca correspondente (DPOC, enfisema, etc.). A chamada encenação funcional é, portanto, um componente importante antes da indicação de uma intervenção cirúrgica. Os testes chave para isto são o teste de função pulmonar, ergometria e, em casos críticos, espiroergometria em combinação com cintilografia de perfusão. Recomenda-se que se siga as directrizes da OMPE [8]. Para efeitos práticos, uma boa orientação continua a ser o VEF1, que deve ser um mínimo de cerca de 1 litro após a operação.
Factores prognósticos para a indicação
O planeamento de uma intervenção cirúrgica no NSCLC é muito complexo e requer conhecimentos detalhados devido à vasta gama de aparência tumoral. Existem regras metodológicas claras para a indicação e o objectivo é proporcionar ao paciente o tratamento mais adequado ou à medida do seu caso. para oferecer uma terapia cirúrgica individualizada. Enquanto que para as fases iniciais (T1-2, N0, M0 ou AJCC IA-IB) o foco está na poupança de parênquima, métodos de tratamento minimamente invasivos, incluindo a linfadenectomia de estadiamento, para as fases avançadas que ainda podem ser tratadas cirurgicamente (T1-4, N1-2, M0, ou AJCC IIA-IIIB) o foco está na optimização de terapias oncológicas, radioterapêuticas e cirúrgicas multimodais. O cirurgião deve ter um conhecimento detalhado dos factores prognósticos importantes e ser capaz de ajustar a terapia também intra-operatoriamente, utilizando o diagnóstico rápido histopatológico com a maior frequência possível. De acordo com os conhecimentos actuais, os seguintes factores são factores prognósticos independentes para o tratamento cirúrgico do NSCLC, ponderados de acordo com a importância [9–12]:
- Número de estações de gânglios linfáticos afectados
- Classificação e diferenciação histológica
- Lymphangioinvasion na histologia definitiva
- Número total de gânglios linfáticos afectados
- Resposta com terapia neoadjuvante
- O sexo e a idade do paciente
- Tamanho do tumor
Terapia cirúrgica das fases iniciais
Os tumores em fases T1-T2 sem envolvimento dos gânglios linfáticos são referidos como fases iniciais e têm um prognóstico correspondentemente bom (Fig. 1) .
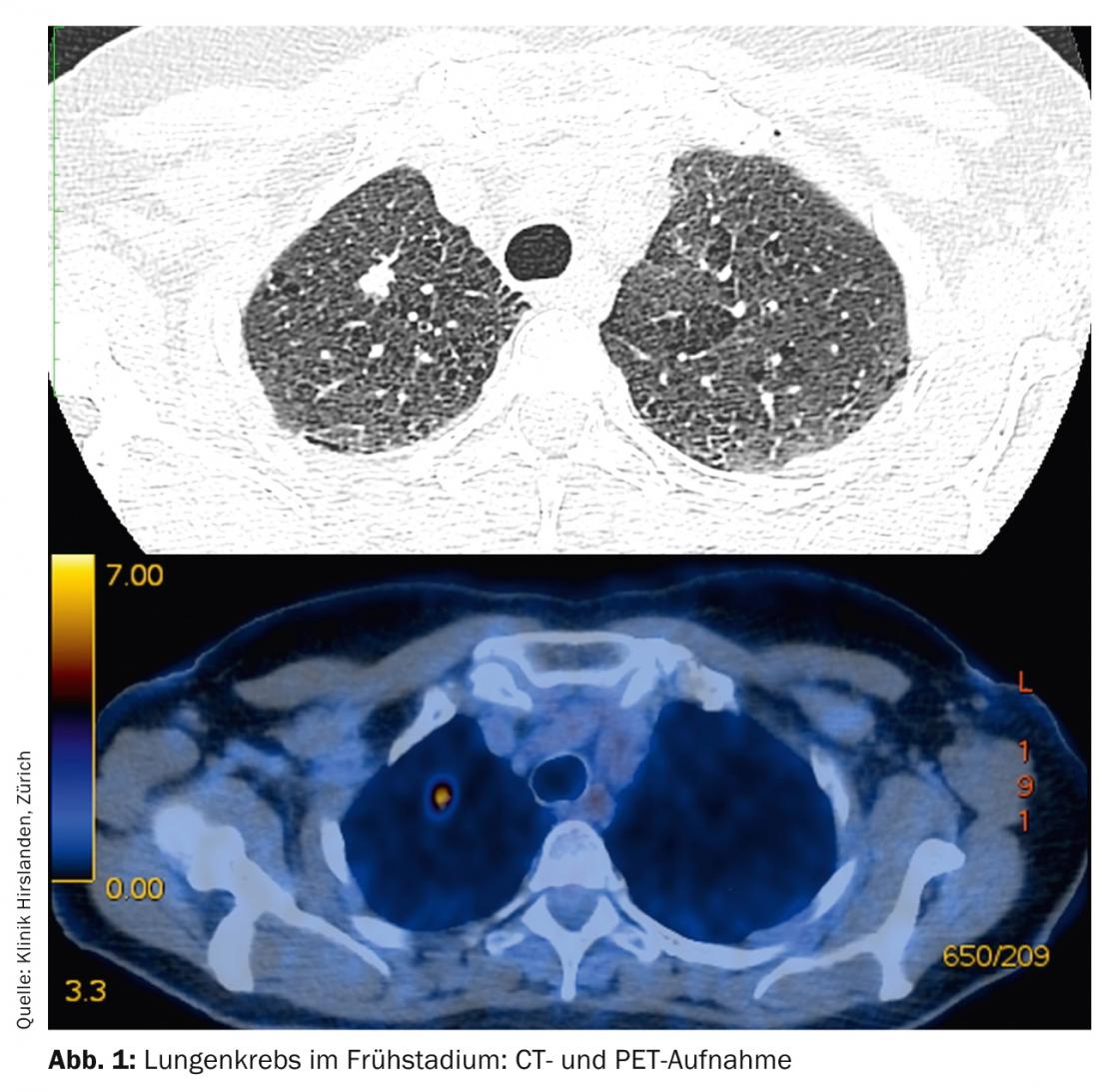
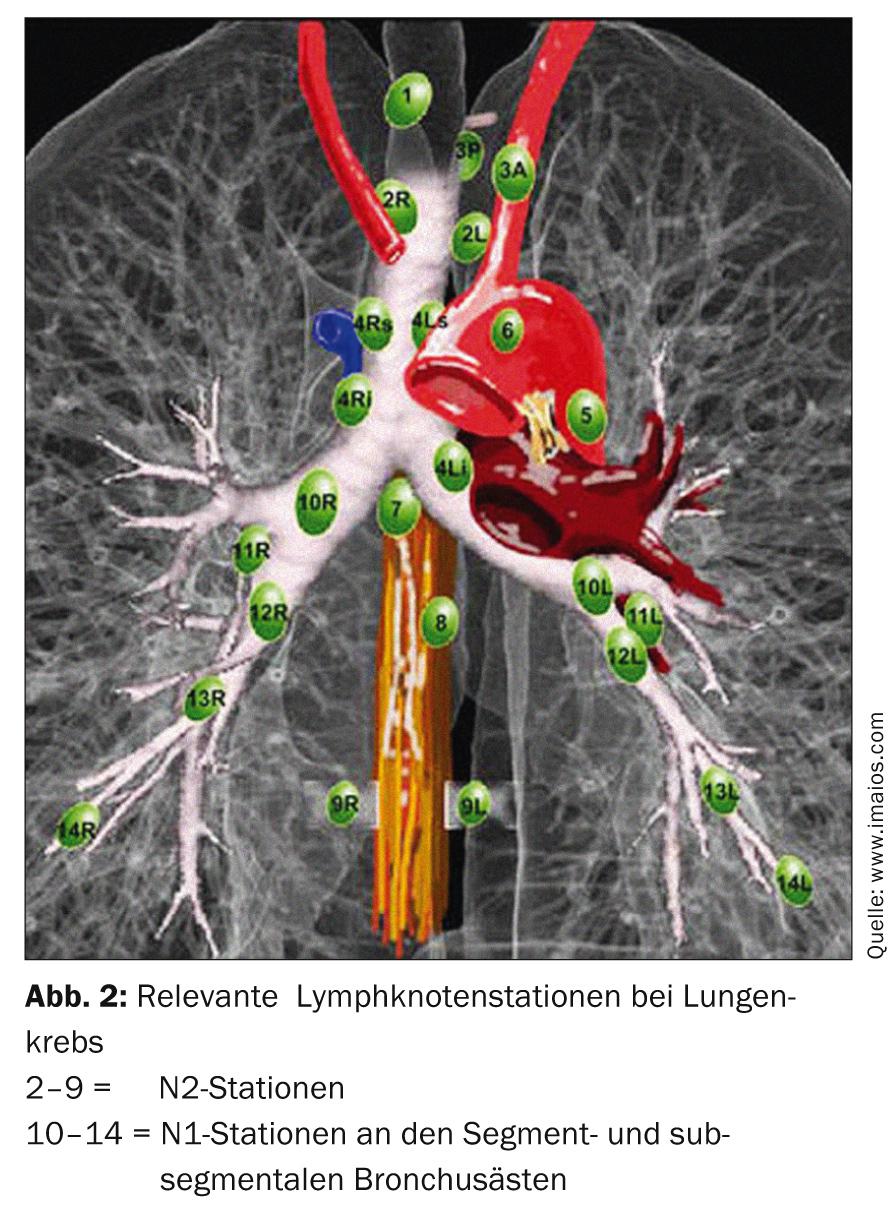
O tratamento padrão é a terapia cirúrgica primária. Dependendo da localização do tumor no lobo pulmonar, pode ser necessária uma ressecção segmentar ou uma lobectomia. A verificação da fase N0 por amostragem sistemática dos gânglios linfáticos no mediastino é obrigatória (Fig. 2). Em caso de mudança intra-operatória de fase (envolvimento surpreendente de N1 ou N2), é necessário um ajustamento imediato da terapia cirúrgica com linfadenectomia radical e lobectomia de conclusão. A idade e o estado de desempenho do paciente também devem ser incluídos como critérios essenciais nesta decisão. Se um paciente tiver sido submetido a uma ressecção de segmento e se verificar no pós-operatório que existem muitos factores de risco prognóstico (linfangioinvasão, envolvimento de gânglios linfáticos submarinos, má classificação, adenocarcinoma em homens, etc.), é necessária uma lobectomia completa no sentido de uma segunda operação e a quimioterapia aditiva deve ser discutida no conselho tumoral [13].
Terapia cirúrgica de fases avançadas
Todas as fases T com envolvimento N1 ou N2 são fases avançadas mas ainda operáveis (IIA-IIIB). Existem morfologias muito diferentes neste grupo de pacientes e o planeamento do tratamento cirúrgico é correspondentemente complexo. Há duas questões cruciais para definir o curso para os conceitos terapêuticos disponíveis:
- Existe uma grande massa tumoral ou linfonodal no centro ou nos gânglios linfáticos? perto da divisão brônquica principal ou perto de outros órgãos mediastinais (aorta, coração)?
- Várias estações de gânglios linfáticos N2 são afectadas? E em caso afirmativo, quais em relação ao lóbulo afectado pelo tumor?
Se uma destas perguntas tiver de ser respondida com “sim”, surge a questão do pré-tratamento neoadjuvante. Se ambas as perguntas puderem ser respondidas em negativo, o paciente é tratado principalmente com cirurgia. O objectivo do pré-tratamento neoadjuvante é melhorar a resectabilidade e suscitar pacientes com um prognóstico intacto. Após geralmente três ciclos de quimioterapia (por exemplo com cisplatina e docetaxel), o restabelecimento tem lugar. Se a resposta for boa, a cirurgia é o passo seguinte. Se não houver resposta ou mesmo progressão da doença, o paciente não se qualifica para terapia cirúrgica; continuará a receber quimioterapia ou radioterapia com intenção paliativa [14,15].
Estudo de caso 1: Etapa IIIA, não volumoso, T3 N1
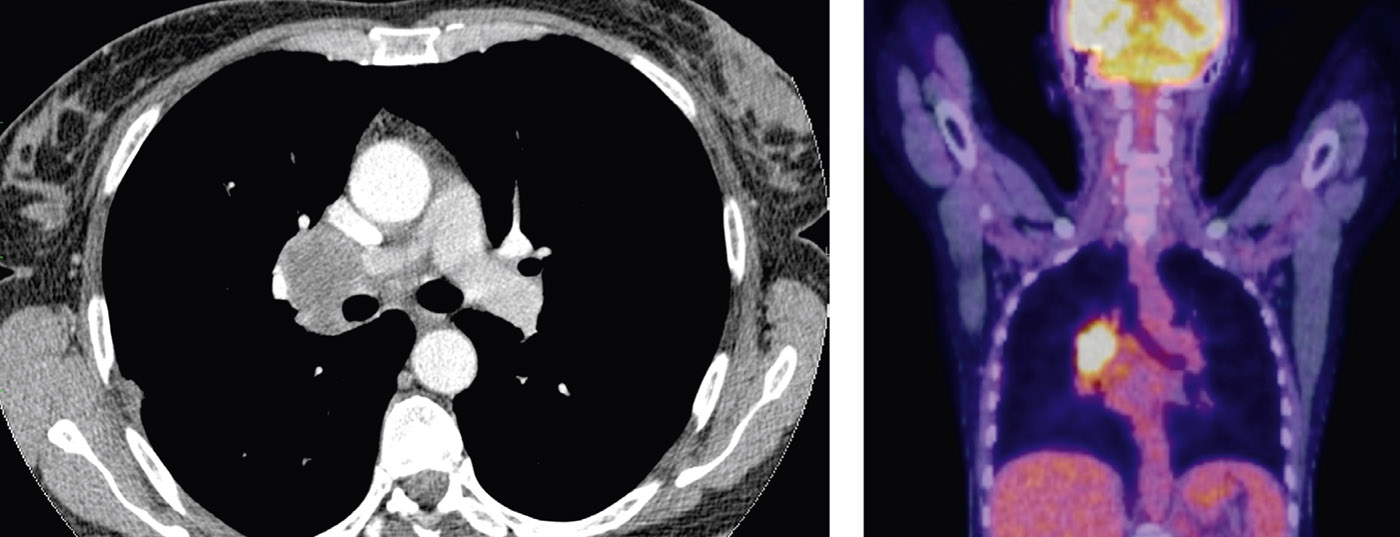
No doente afectado, as imagens mostram um adenocarcinoma originário da língula, com envolvimento de gânglios linfáticos N1 e dois tumores no lobo (T3) (Fig. 3).

O estadiamento pré-operatório com PET e ultra-som endobraquial (EBUS) das estações N2 não revela tumor. Assim, o paciente qualifica-se para a terapia cirúrgica directa. Realiza-se uma ressecção toracoscópica do lobo superior (lobectomia minimamente invasiva do VATS [VATS thoracic surgery]) (Fig. 4) com linfadenectomia mediastinal extensa. Intraoperativamente, a ressecção R0 é confirmada pelo diagnóstico histopatológico rápido das margens de ressecção e dos gânglios linfáticos N2. A fase definitiva do tumor TNM da patologia é pT3, pN1 (3 de 34), L1, V1, Pn0, R0. Devido à situação dos gânglios linfáticos, é recomendada a quimioterapia adjuvante.
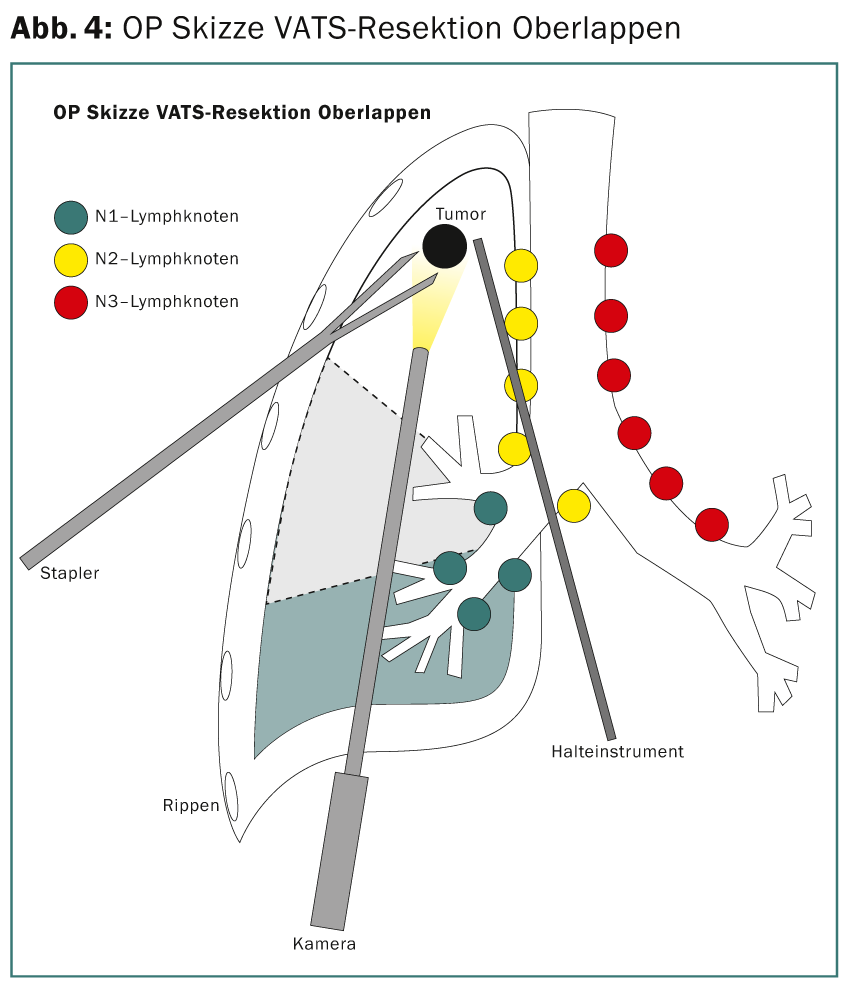
Estudo de caso 2: Fase IIIA, extensa (volumosa), T2 N2
As imagens mostram um adenocarcinoma originário do lobo superior direito com envolvimento de gânglios linfáticos do grupo N2 4R (Fig. 5).
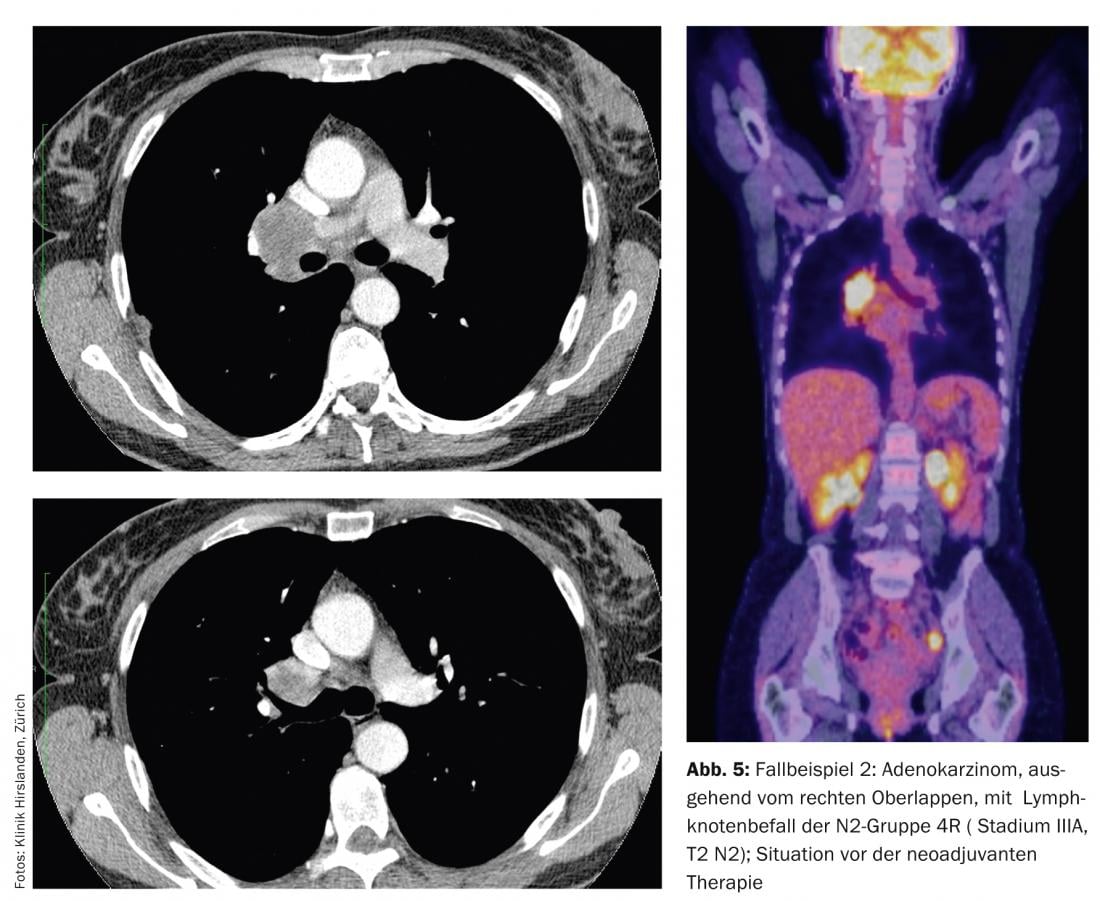
Esta infestação é muito volumosa e estende-se até à carina principal ou para além dela. A cirurgia radical primária não pode ser realizada nesta área. O tumor primário não é volumoso e está a cerca de 5 cm na fase T2. A preparação pré-operatória com PET e EBUS das estações N2 não revela a detecção de tumores noutras estações N2 ou N3 contralaterais. No entanto, este paciente é candidato a pré-tratamento neoadjuvante para reduzir os extensos resultados e seleccionar o paciente para cirurgia. Após três ciclos de quimioterapia, uma nova tomografia mostra uma resposta muito boa (fase descendente) e nenhuma nova manifestação tumoral no sentido de novas ampliações dos gânglios linfáticos, focos redondos ou metástases (Fig. 6) .

Assim, o paciente qualifica-se agora para a terapia cirúrgica secundária. A ressecção aberta do lobo superior com ressecção em bloco do brônquio principal e reconstrução broncoplástica (Fig. 7) resulta em ressecção R0 com confirmação intra-operatória por diagnóstico histopatológico rápido das margens de incisão e linfonodos mediastinais radicalmente desobstruídos. A fase definitiva do tumor TNM da patologia é ypT1a, ypN0 (0 de 29), L0, V0, Pn0, R0 (“y” denota o estado após o pré-tratamento neoadjuvante). Devido à extensão peribrônquica essencialmente muito extensa, recomenda-se neste caso a consolidação da radiação do mediastino para completar o conceito de terapia multimodal.

Perspectivas
O tratamento das fases avançadas do NSCLC é um desafio interdisciplinar e cirurgicamente técnico. O prognóstico médio de sobrevivência de 5 anos para pacientes afectados situa-se entre 23 e um máximo de 55%. A probabilidade de sobrevivência é realmente boa para tumores em fase inicial. A coorte do Programa Internacional de Acção contra o Cancro do Pulmão Inicial (IELCAP) mostra curvas de sobrevivência para doentes rastreados com fases iniciais superiores a 90% (10 anos de sobrevivência!). Actualmente, o prognóstico global para o cancro do pulmão é de apenas 15,1% de sobrevivência de 5 anos para todas as fases, incluindo inoperacional. Todos os esforços para melhorar este número devem concentrar-se na melhoria da prevenção entre os jovens e no rastreio consistente entre os grupos de risco (fumadores activos ou ex-fumadores, com mais de 50 anos, mais de 20 anos de idade). Então a actual situação de pobreza com apenas 15,1% de sobrevivência a 5 anos pode ser significativamente melhorada.
Mensagens Take-home-messages
- Apenas um quarto dos pacientes com cancro do pulmão pode receber terapia cirúrgica e, portanto, uma potencial cura.
- O rastreio do grupo de risco é necessário para detectar as fases iniciais; um programa de rastreio com dose baixa de rastreio CT reduz significativamente a mortalidade.
- O grupo de risco é activo ou ex-fumadores com mais de 50 anos de idade com mais de 20 pack-years.
- O conhecimento profundo dos factores de prognóstico individuais e gerais determina o conceito de terapia à medida, especialmente para casos que requerem tratamento cirúrgico.
Prof. Dr. med. Othmar Schöb
Literatura:
- Ferlay J, et al: Eur J de Cancer 2013; 49: 1374-1403.
- A equipa nacional de investigação do ensaio de despistagem pulmonar: Redução da Mortalidade Pulmonar-Cancerígena com Tomografia Computadorizada de Baixa Dose. N Engl J Med 2011; 365: 395-409.
- Altorki NK, et al: J Thor Cardiovasc Surg 2014; 147(2): 754-764.
- Comité Misto Americano sobre o cancro. 7ª Edição.
- Sahiner I, et al: Quant Imaging Med Surg 2014; 4(3): 195-206.
- Shingyoji M, et al: Ann Thorac Surg 2014, Aug 19. pii: S0003-4975(14)01277-6. doi: 10.1016/j.athoracsur.2014. 05.078. [Epub ahead of print].
- Teran MD, et al: J Thorac Dis 2014; 6(3): 230-236.
- Vansteenkiste J, et al: Ann Onc 2014; 25: 1462-1474.
- Riquet M, et al: Ann Thorac Surg 2014; 98: 224-231.
- Ichinose J, et al: Chest 2014; 146;(3); 644-649.
- Kuo SW, et al: J Thorac Cardiovesc Surg 2014; 148(4): 1200-1207.
- Ito M, et al: Lungcan 2014; 85: 270-275.
- Mediratta N, et al: Cardio-Thoracic Surgery 2014; 46: 267-273.
- Jaklitsch MT, et al: J Surg Oncol 2006: 94(7): 599-606.
- Trodella L, et al: Ann Oncol 2014; 15: 389-398.
InFo ONCOLOGy & HEMATOLOGy 2015; 3(1): 13-17