Como parte do Medidays, o programa de formação de medicina interna do Hospital Universitário de Zurique (USZ), com a duração de uma semana, uma tarde foi também dedicada a vários temas oncológicos. No caso do mieloma múltiplo e do linfoma difuso de grandes células B, novas substâncias activas e modalidades terapêuticas foram desenvolvidas nos últimos anos, o que melhorou o prognóstico dos doentes. O resultado do rastreio do cancro é menos positivo: muito esforço não significa automaticamente muito sucesso.
(ee) O Prof. Dr. med. Bernhard Pestalozzi, Médico Chefe da Clínica de Oncologia da USZ, falou sobre os aspectos contraditórios das medidas para a detecção precoce do cancro.
Começou com um estudo de caso: recebe uma chamada de um bom amigo que lhe diz entusiasticamente que apareceu um achado suspeito na mamografia de rastreio da sua mulher. Qual é o risco de que este achado incidental corresponda realmente a um carcinoma mamário invasivo?
Redução do risco relativo e absoluto no rastreio do cancro da mama
Havia uma grande variedade de opiniões na audiência: alguns disseram que a probabilidade era de 90%, outros assumiram 1%.
Na realidade, o risco é de cerca de 10%: De cada 1000 mulheres que são submetidas a uma mamografia de rastreio de dois em dois anos durante dez anos, cerca de 200 têm de ter um achado anormal esclarecido, o que implica stress físico e psicológico. Cerca de 24 acabam por ser diagnosticados com cancro da mama.
No entanto, o cancro da mama também não é detectado em quatro a sete mulheres, pelo que uma mamografia negativa não significa 100 por cento de certeza de que não há cancro da mama. Num grupo de 1000 mulheres não rastreadas, cinco acabam por morrer de cancro da mama, e num grupo de 1000 mulheres rastreadas, há ainda quatro.
O risco relativo de morrer de cancro da mama é assim reduzido em 20% através do rastreio, mas a redução absoluta do risco é de apenas 0,1% (apenas uma em 1000 mulheres rastreadas beneficia efectivamente da redução do risco). Os números aqui listados podem ser encontrados na ficha informativa da Liga Suíça contra o Cancro, que defende o rastreio (https://assets.krebsliga.ch/downloads/1451.pdf).
Estes números “pobres” da mamografia melhoram para as mulheres com um risco de cancro da mama superior à média e através da utilização de melhores técnicas de rastreio. Por exemplo, a mamografia 3D detecta 30% mais carcinomas e a taxa de recolha é 30% mais baixa. A Mamma MRI, que é recomendada para pacientes com mutações BRCA, tem também uma sensibilidade mais elevada (mas uma especificidade ainda menor).
Determinação de PSA e rastreio do cancro do intestino: o que faz sentido?
No rastreio do cancro da próstata, o equilíbrio não parece ser melhor. Dos 1000 homens que têm rastreio PSA a cada um a quatro anos durante dez anos, 100-120 obtêm um resultado falso-positivo, ou seja, são rastreados por biopsia e não têm cancro da próstata, mas quaisquer efeitos secundários da biopsia, tais como dor e ansiedade. Outros 110 são de facto diagnosticados com cancro da próstata e a maioria são subsequentemente tratados, com os possíveis efeitos secundários na continência urinária e função sexual. Globalmente, no entanto, o rastreio de 1000 homens evita no máximo uma morte devido ao cancro da próstata. O rastreio geral do PSA não é, portanto, recomendado pela Task Force americana. A Sociedade Suíça de Urologia recomenda o teste PSA apenas para pacientes com antecedentes familiares de cancro da próstata (a partir dos 45 anos de idade) e com um pedido correspondente de um homem informado (entre os 50 e 70 anos de idade).
A situação é mais favorável para o rastreio do cancro do cólon, que está coberto por um seguro básico desde Junho de 2013. Um teste de fezes de dois em dois anos e/ou uma colonoscopia de dez em dez anos (para crianças entre os 50-69 anos) são reembolsados. Existem boas provas tanto para o teste de fezes como para a sigmoidoscopia/colonoscopia para reduzir a incidência e mortalidade do cancro colorrectal. Relativamente à redução da mortalidade por colonoscopia, há que extrapolar a partir dos ensaios aleatórios de sigmoidoscopia. Para evitar uma morte por cancro colorrectal, são necessárias 300 a 600 colonoscopias de rastreio.
Actualização sobre linfoma difuso de grandes células B
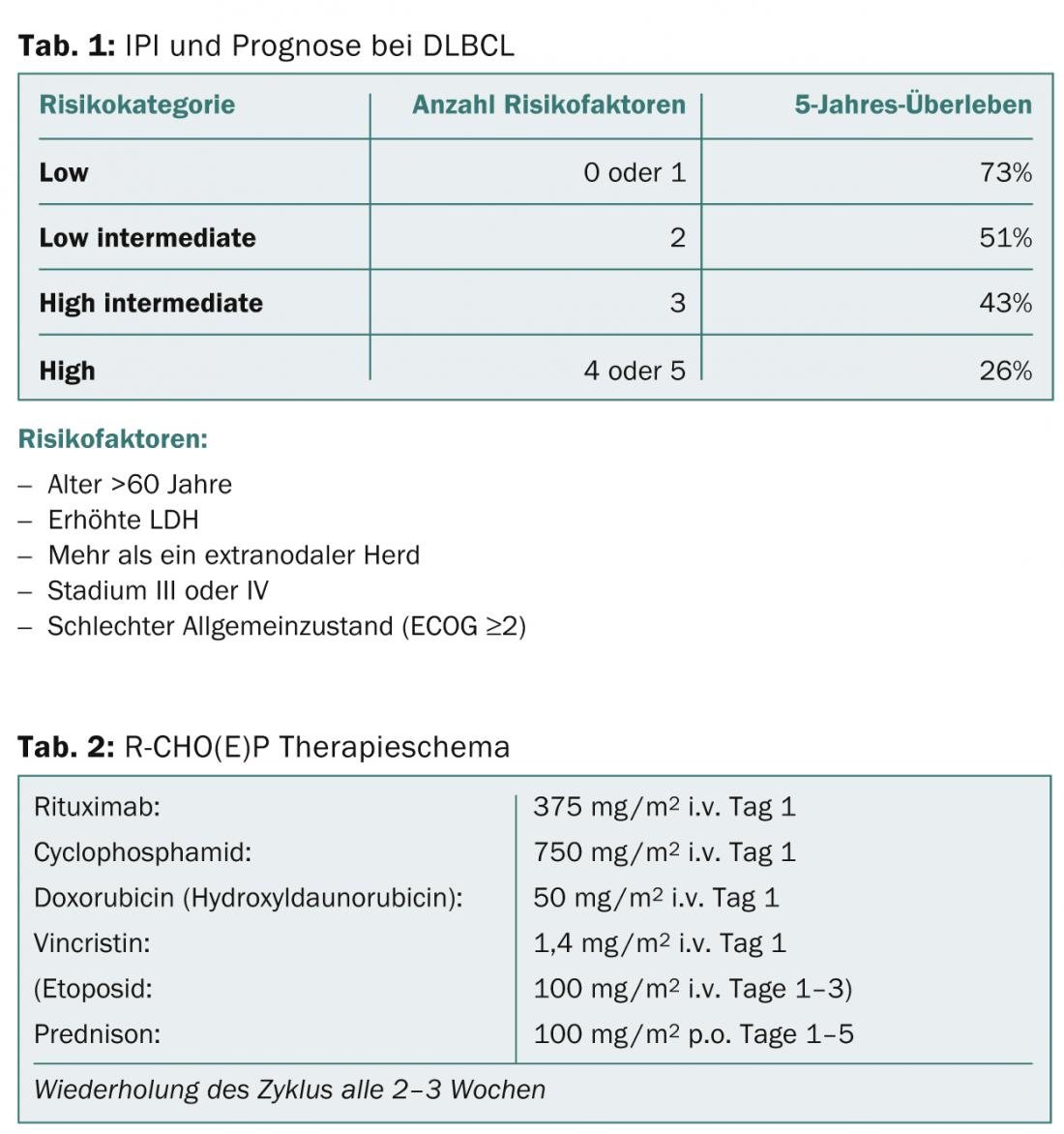
Panagiotis Samaras, MD, médico sénior do Departamento de Oncologia da USZ, deu uma visão geral de duas doenças hematológicas comuns: o linfoma difuso de grandes células B (DLBCL) e o mieloma múltiplo (MM). O DLBCL é o linfoma mais comum de todos. O prognóstico e a terapia dependem fortemente do número de factores de risco avaliados pelo Índice Prognóstico Internacional (IPI) (Tab. 1). Os pacientes entre os 18 e 60 anos de idade com um IPI <2 são considerados jovens e de baixo risco. As suas taxas de sobrevivência são superiores a 90%. Em pacientes com menos de 60 anos de idade com um IPI ≥2, que são classificados como de alto risco, as taxas de sobrevivência são de cerca de 50%. Os pacientes são tratados com o regime R-CHOP (Tab. 2), dependendo da idade do paciente e dos factores de risco com um número variável de ciclos (6-8 ciclos são padrão) e, se necessário, com a adição de etoposida.
Durante a quimioterapia, são efectuados todas as semanas um check-up clínico e um check-up do hemograma. Num regime terapêutico de 14 dias, os doentes recebem antibióticos para controlar a infecção e G-CSF para encurtar a duração da neutropenia. Em caso de efeitos secundários (tab. 3), ambiguidades ou complicações, o paciente ou o médico devem ser informados. o médico de clínica geral pode fazer um contacto de baixo limiar com o oncologista – mesmo à noite ou ao fim-de-semana. Se ocorrer uma recaída de DLBCL, o transplante de células estaminais autólogas é a opção seguinte após quimioterapia de alta dose.
Mieloma múltiplo – novas opções de tratamento
O mieloma múltiplo (MM) é o segundo neoplasma mais comum em hematologia. Os homens são afectados ligeiramente mais frequentemente do que as mulheres (proporção 1,4:1). A MM é hoje uma doença não curável, mas terapias apropriadas podem reduzir os sintomas e parar a progressão da doença. Em MM assintomática (“smoldering” MM), não é dada nenhuma terapia activa, mas o paciente é monitorizado (“observar e esperar”). O tratamento é indicado para MM sintomático (Quadro 4) .

Os sintomas mais comuns são anemia (73%), lesões ósseas (66%), dores ósseas (58%), insuficiência renal (19%) e hipercalcemia (11%). As proteínas monoclonais podem ser detectadas em 97% dos pacientes.
Na terapia, é feita uma distinção entre três objectivos: Tratamento agudo para evitar danos com risco de vida (por exemplo, plasmaferese para síndrome de hiperviscosidade ou diálise para insuficiência renal), alívio dos sintomas e melhoria da qualidade de vida (por exemplo, radioterapia para fracturas instáveis, bisfosfonatos, analgesia), e redução dos sintomas e paragem da progressão (quimioterapia, transplante de células estaminais). Nos últimos anos, as substâncias bortezomib (Velcade®) e lenalidomida (Revlimid®) melhoraram significativamente o prognóstico dos pacientes com MM. Em pacientes mais jovens com menos de 70 anos de idade, existe a opção de transplante de células estaminais, que segue a terapia de indução com bortezomib ou lenalidomida e subsequente quimioterapia de alta dose. Subsequentemente, são dados mais dois ciclos do tratamento inicial e, em pacientes com um perfil de alto risco, é dada uma terapia de manutenção durante mais de um ano. Em pacientes mais velhos, a quimioterapia contendo bortezomib ou lenalidomida é administrada durante pelo menos 12-18 meses – a eficácia depende da duração da terapia.
Fonte: Medidays, Update Oncology, 3 de Setembro de 2014, Zurique
InFo ONCOLOGy & HEMATOLOGy 2014; 2(8): 32-34