A utilização do inibidor VEGF bevacizumab melhora o resultado dos pacientes com cancro colorrectal metastásico independentemente da quimioterapia escolhida. Dados recentes sugerem que a duração da inibição do VEGF desempenha um papel importante no resultado do tratamento.
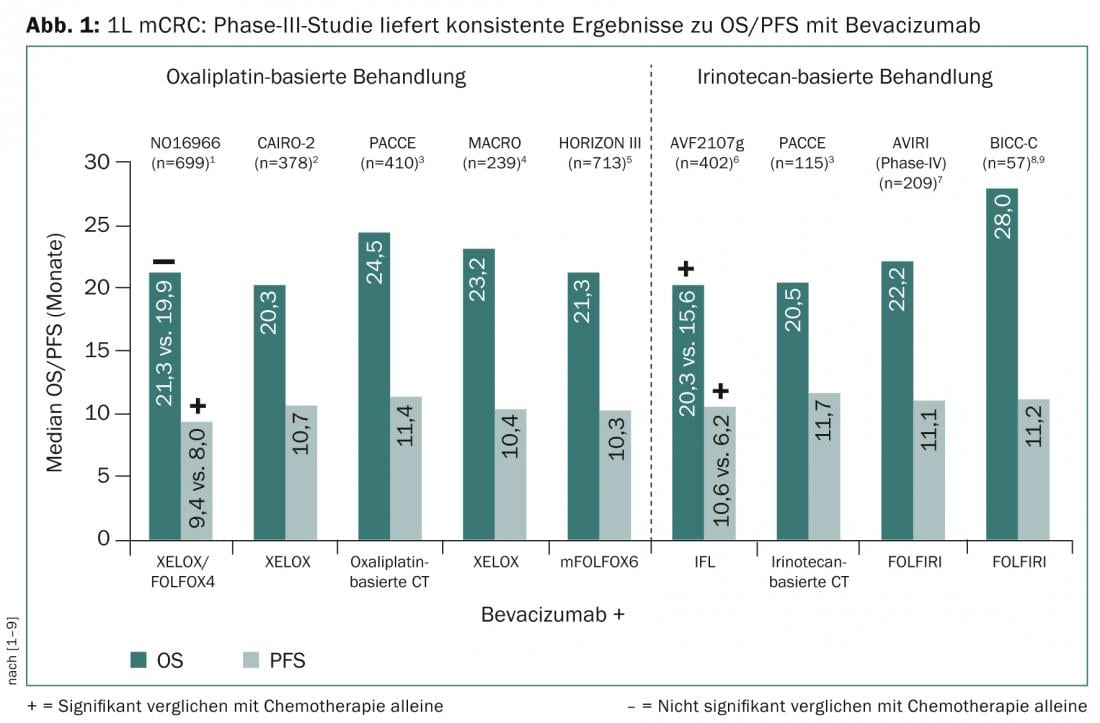
A possibilidade de reduzir as metástases primárias irresecáveis e maximizar o tempo de sobrevivência estão entre os objectivos terapêuticos do cancro colorrectal metastásico (mCRC). Em estudos de tratamento de primeira linha do mCRC, a utilização do inibidor do factor de crescimento endotelial vascular (VEGF) bevacizumab para quimioterapia combinada à base de oxaliplatina ou irinotecan mostrou consistentemente uma sobrevivência sem progressão (PFS) de 10-12 meses e uma sobrevivência global (OS) de 22-28 meses (Fig. 1).
Boas razões para a utilização do inibidor VEGF como monoterapia no mCRC terapeuta foram fornecidas pelo estudo AVEX [10]. Isto mostrou que bevacizumab mais capecitabina levou a um aumento significativo na PFS em comparação com a capecitabina só (9,1 meses vs. 5,1; HR: 0,53; p<0,0001). “Este é um grande passo em frente e uma boa razão para combinar terapias menos intensivas, em particular com um inibidor VEGF”, disse o Prof. Dirk Arnold, MD, Director do Centro de Biologia Tumoral em Freiburg i. Br. na 2ª Conferência do EORTC St. Gallen Gastrointestinal Cancer Conference . O perito respondeu à pergunta sobre a utilização de inibidores VEGF numa combinação tripla baseada nos resultados do TRIBE, um estudo de fase III que comparou bevacizumab em combinação com FOL-FOXIRI (5-FU, ácido folínico, oxaliplatina, irinotecan) ou com FOLFIRI (5-FU, ácido folínico, irinotecan) na terapia de primeira linha do mCRC irresectável [11]. Houve uma melhoria significativa em PFS (12,2 vs. 9,7 mo.; 0,73; p=0,0012) e taxa de resposta (65 vs. 53%) com a combinação tripla mais bevacizumab. “O ensaio TRIBE mostra uma tolerância surpreendentemente boa e os melhores resultados de eficácia de todos os ensaios de fase III no mCRC até à data”, explicou o Prof. Arnold. A estratégia da terapia tripla é apoiada pelos dados do ensaio OLIVIA, que mostrou, entre outras coisas, o dobro da taxa de ressecção R0 (parâmetro secundário; 48,8 vs. 23,1) com FOLFOXIRI mais bevacizumab em comparação com um regime FOLFOX6 modificado mais bevacizumab [12].
Os dados sobre o benefício dos inibidores VEGF na terapia de segunda linha provêm do ensaio E3200 de quimioterapia oxaliplatina (FOLFOX) mais bevacizumab, e do ensaio VELOUR de aflibercept como coadjuvante do FOLFIRI [13,14]. Ambas as estratégias mostraram uma melhoria significativa na sobrevivência global.
As provas de que os inibidores VEGF devem ser utilizados continuamente na terapia de primeira e segunda linha provêm do ensaio das TML. Isto mostrou que a administração contínua de bevacizumab para além da progressão da combinação de quimioterapia de primeira linha em combinação com a terapia de segunda linha melhorou a sobrevivência global dos pacientes [15]. Tal abordagem é apoiada pelos resultados do estudo BEBYP, bem como por uma sub-análise do VELOUR – neste caso com aflibercept [16,17]. Contudo, uma comparação indirecta dos dados dos ensaios TML e VELOUR mostrou que a adição de aflibercept levou a um aumento mais significativo dos efeitos secundários relacionados com a quimioterapia, ao passo que estes não aumentaram com a continuação de bevacizumab [17]. Desde o ano passado, tem também sido discutido se o tratamento com inibidores VEGF deve ser continuado ou interrompido durante o período sem progressão como “terapia de manutenção”. Os resultados da Fase III do ensaio CAIRO-3 apresentado na ASCO GI em Janeiro apoiam o tratamento de ponta a ponta [18]. Mais informações serão fornecidas pelos resultados da AIO 0207, cujos resultados serão apresentados na ASCO 2014.
Fonte: “Biologicals in colorectal cancer – state of the art”, Roche Satellite Symposium at the2nd St. Gallen EORTC (European Organisation for Research and Treatment of Cancer) Gastrointestinal Cancer Conference (GICC) 2014, 7 de Março de 2014, St.
Literatura:
- Saltz, et al: JCO 2008; 26(12): 2013-2019.
- Tol, et al: NEJM 2009; 360(6): 563-572.
- Hecht, et al: JCO 2009; 27(5): 672-680.
- Díaz-Rubio, et al: Oncologista 2012; 17(1):15-25.
- Schmoll, et al: JCO 2012; 30(29): 3588-3595.
- Hurwitz, et al: NEJM 2004; 350(23): 2335-2342.
- Sobrero, et al: Oncology 2009; 77(2): 113-119.
- Fuchs, et al: JCO 2008; 26(4): 689-690.
- Fuchs, et al: JCO 2007; 25(30): 4779-4786.
- Cunningham D, et al: Lancet Oncol 2013; 14(11): 1077-1085.
- Falcone A, et al: JCO 2013 (Suppl. abstr 3505).
- Bridgewater J, et al: European Cancer Congress 2013. Resumo 2159.
- Giantonio BJ, et al: JCO 2007; 25(12): 1539-1544.
- Van Cutsem E, et al: JCO 2012; 30(28): 3499-3506.
- Bennouna J, et al: Lancet Oncol 2013; 14(1): 29-37.
- Masi G, et al: Ann Oncol 2012; 23 (Sup. 9): abstracto LBA17.
- Carmen JA, et al: JCO 2012; 31 (Sup. abstr. 3505).
- Koopman M, et al: JCO 2013; 31 (Sup. abstr. 3502).
InFo ONCOLOGy & HEMATOLOGy 2014; 2(5): 30-31