A ocorrência de dor como resultado de um AVC representa um desafio para a medicina da dor. Embora o conhecimento dos mecanismos fisiopatológicos da dor neuropática após o AVC tenha aumentado significativamente nos últimos anos, o sucesso das abordagens medicamentosas, neurocirúrgicas, intervencionais e outras abordagens terapêuticas é ainda limitado. É portanto obrigatória uma abordagem de terapia multimodal. Este artigo visa fornecer uma visão geral dos aspectos diagnósticos e terapêuticos desta entidade da doença.
A dor crónica moderada a grave é um problema de saúde comum na Suíça, com uma prevalência de 16%, embora se deva notar que poucos pacientes são tratados por especialistas da dor e cerca de metade dos pacientes recebem uma gestão inadequada da dor [1]. A presença de dor neuropática pura é também comum, com uma prevalência que varia entre 3,3% num inquérito à população geral na Áustria [2] e 7% na população geral em França [3].
A incidência de AVC na Europa é de 1,1 milhões por ano, com um aumento previsto para aproximadamente 1,5 milhões por ano até 2025, devido ao aumento da proporção de pessoas idosas na população [4]. A dor crónica associada ao AVC é observada em 11-55% de todos os doentes com AVC [5]. Os tipos comuns de dor que ocorrem após um AVC podem incluir dor neuropática central, dor nociceptiva no ombro, espasticidade dolorosa e também dores de cabeça de tensão. A dor neuropática central ocorre em 8% de todos os pacientes que sofreram um AVC [6]. A dor nociceptiva no ombro é relatada entre 30 e 40% em doentes com AVC com défices sensoriais e motores, subluxações do ombro e restrições de movimento [7]. As dores musculoesqueléticas podem também ocorrer nas costas e extremidades inferiores, especialmente nos joelhos e ancas [8] (Tabela 1).

Dor central após acidente vascular cerebral
A definição de dor neuropática de acordo com a Associação Internacional para o Estudo da Dor (IASP) assume uma lesão ou doença que afecta o sistema somatosensorial [9]. Para diagnosticar a dor neuropática, os critérios de diagnóstico da IASP devem ser utilizados para procurar um histórico de dor que corresponda a uma distribuição neuroanatomicamente circunscrita e para a evidência de uma lesão ou doença relevante do sistema nervoso periférico ou central. O exame clínico deve demonstrar sinais sensoriais positivos e negativos correspondentes a uma distribuição neuroanatomicamente plausível circunscrita e consistente com a área da dor. Além disso, o diagnóstico aparativo deve provar a presença de uma lesão ou doença do sistema somatossensorial [9].
Na literatura em língua inglesa, a dor neuropática central após AVC é referida como “Central Post Stroke Pain” (CPSP). Uma vez que não existem sinais patognomónicos para o CPSP, o Klit et al. seguindo os critérios de diagnóstico do IASP acima mencionados, só recentemente propôs critérios de diagnóstico específicos para o CPSP [10]. Assim, os critérios necessários para o diagnóstico de CPSP são a dor numa região do corpo correspondente a uma lesão do sistema nervoso central. O historial deve indicar que o paciente teve um AVC e que o início da dor deveria ter ocorrido após o AVC. Além disso, é necessária a confirmação de uma lesão do sistema nervoso central através de estudos de imagem (por exemplo, TAC ou RM do crânio) ou a presença de sinais sensoriais negativos ou positivos, compatíveis com uma região do corpo, correspondentes a uma lesão do sistema nervoso central deve ser demonstrada.
Como se trata de um diagnóstico clínico de exclusão, outras causas de dor como a dor neuropática nociceptiva ou periférica devem ser excluídas ou improváveis. O diagnóstico pode ser apoiado por critérios de apoio como a ausência de uma relação primária da dor com o movimento (por exemplo, das extremidades), a ausência de sinais de inflamação local ou sinais de patologia do tecido local que não seja uma causa nociceptiva de dor. Uma descrição típica da dor pode incluir queimadura, formigueiro, pressão, pinos e agulhas, apunhalamento, tiroteio, constrição, dor fria, dor electrificante, embora outras descrições também sejam observadas. A presença de alodinia ou disanestesia ao toque ou frio na zona da dor pode fornecer pistas adicionais (tab. 2).

Características clínicas do CPSP neuropático
A revisão por Klit [10] resume as características clínicas típicas do CPSP. A distribuição da área da dor pode afectar apenas uma pequena área, por exemplo, apenas a mão, ou também extensas áreas do corpo, até à dor de meia-lateral. O rosto e o tronco também podem ser deixados de fora. Os doentes com o chamado enfarte da medula lateral oblongata e a síndrome de Wallenberg resultante podem também apresentar dor facial no lado afectado e dor no tronco e extremidades do lado oposto (síndrome cruzada). As dores periorbitais também são frequentemente relatadas. A hemiplegia ocorre frequentemente após uma lesão talâmica. Os fenómenos sensoriais negativos e positivos são também típicos no CPSP, tal como noutras síndromes neuropáticas. Perturbações térmicas, especialmente da sensação de frio ou também perturbações da sensação de dor ou perturbações da percepção da picada do alfinete ou do espigão ocorrem em mais de 90% dos casos. Os sintomas negativos relativos ao tacto ou vibração ocorrem com menos frequência. Fenómenos positivos como a dor evocada por estímulos térmicos (especialmente estímulos frios) ou mecânicos (estímulos de alfinetes), mas também alodinia para tocar os estímulos são comuns.
A dor central após acidente vascular cerebral não só ocorre tipicamente após uma lesão talâmica (“dor talâmica”), mas também é relatada após hemorragia e isquemia noutras áreas do cérebro [11]. Os próprios dados mostram a ocorrência de dor central após acidente vascular cerebral em doentes com enfartes do tronco cerebral, lesões medulares e lesões do córtex insular. Foram encontradas causas muito diferentes para a génese do AVC, tais como enfarte cerebral microvascular ou embólico, enfarte cerebral após vasoespasmo devido a hemorragia subaracnoídea ou hemorragia intracerebral [12].
O tempo entre o início do AVC e o início do CPSP pode ser variável (início imediato ou início da dor após anos), mas o início da dor dentro de alguns meses é mais típico [13]. Num estudo prospectivo de 16 pacientes [6], a CPSP ocorreu em dez pacientes no primeiro mês, em outros três pacientes no prazo de um a seis meses e em três pacientes após seis meses. Por conseguinte, um início tardio do CPSP deve provocar um diagnóstico diferencial de outras causas de dor ou mesmo a ocorrência de um novo AVC.
Papel dos diagnósticos instrumentais
De acordo com os critérios de diagnóstico da IASP mencionados no início, deve ser realizado um diagnóstico por imagem do cérebro, ou seja, uma ressonância magnética para mostrar as estruturas cerebrais. Se for detectada uma lesão correspondente à dor, não é necessário qualquer outro diagnóstico. Em casos individuais, uma lesão muito pequena pode não ser detectável na imagem. Se o quadro clínico for típico (história de um AVC e evidência de fenómenos negativos e/ou positivos correspondentes), pode ser feito um diagnóstico de CPSP. Além disso, podem ser tentadas provas neurofisiológicas de uma lesão. Somatosensory-evoked [14] e laser-evoked potentials [15], mas também testes sensoriais quantitativos [16] podem ajudar a detectar uma lesão. Os nossos próprios dados mostram resultados patológicos no exame dos potenciais evocados por laser e testes sensoriais quantitativos na maioria dos casos de pacientes com dor neuropática central após um AVC de génese diferente [12].
Mecanismos de desenvolvimento da dor em dor neuropática após acidente vascular cerebral
A recente revisão por Klit et al. [10] dá uma boa visão geral dos possíveis mecanismos de dor no centro da dor após o AVC. A hiperexcitabilidade neuronal ao nível do cérebro desempenha um papel significativo na fisiopatologia da dor neuropática gerada centralmente. Os factores que podem promover a hiperexcitabilidade neuronal incluem activação glial com libertação de quimiocinas e substâncias inflamatórias, enfraquecimento dos sistemas inibitórios GABA-érgicos do tálamo, desequilíbrio entre as vias espinotalâmicas laterais e mediais devido a uma lesão ali existente, ou desapertação do input sensorial. As consequências de tais mecanismos podem ser a detecção de actividade espontânea no núcleo ventrocaudal do tálamo ou também uma alteração do fluxo sanguíneo cerebral no tálamo. São discutidos mecanismos adicionais tais como uma perturbação dos laços de excitação cortico-talamo-corticais ou uma reorganização cortical e também outros mecanismos.
Abordagens terapêuticas para o CPSP
A dor crónica após um AVC pode levar a uma qualidade de vida reduzida que afecta o humor, o sono e o funcionamento social [17]. Em geral, a chamada terapia da dor multimodal com procedimentos somáticos, físicos e psicoterapêuticos é superior a uma terapia monodisciplinar para síndromes de dor crónica. A este respeito, assim como as várias causas possíveis de dor descritas acima, o tratamento da dor após o AVC deve ser sempre interdisciplinar e multimodal. Especialmente em doentes com dor neuropática após um AVC, os tratamentos psicológicos, tais como as estratégias de sobrevivência e as terapias comportamentais, podem conduzir a uma melhoria da dor [17].
No que diz respeito à dor nociceptiva, principalmente ortopédica (por exemplo, terapia de patologias do ombro), fisioterapêutica (por exemplo, tratamento de factores de dor muscular) e medidas de terapia ocupacional são úteis de acordo com a patologia músculo-esquelética. Além disso, pode ser necessário o tratamento da espasticidade dolorosa com baclofeno oral. Em casos especiais, a aplicação de uma bomba de espasticidade intratérmica pode ser útil.
A terapia com medicamentos aproxima-se: As abordagens da terapia medicamentosa para a dor neuropática após acidente vascular cerebral são avaliadas em directrizes internacionais, tais como a directriz do Grupo de Trabalho sobre Dor Neuropática da Sociedade Internacional da Dor (NeuPSIG) [18] e a directriz da Federação Europeia de Sociedades Neurológicas (EFNS) [19]. As opções de terapia medicamentosa disponíveis são limitadas. É possível que a multiplicidade de mecanismos fisiopatológicos mencionados acima a diferentes níveis neuronais seja a razão da resposta frequentemente fraca aos medicamentos disponíveis para o tratamento da dor neuropática após o AVC. Para um grande número dos mecanismos mencionados, ainda não está disponível qualquer terapia.
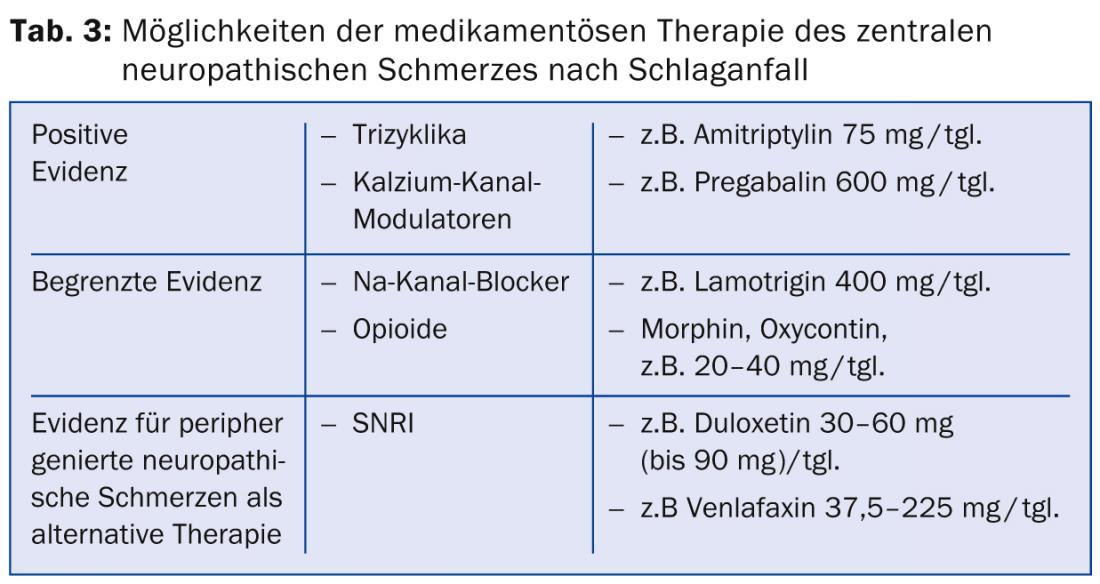
Existem poucos ensaios controlados aleatórios para o tratamento da dor neuropática central após o AVC. Os tricíclicos e os moduladores dos canais de cálcio são considerados os medicamentos de primeira escolha. Estão disponíveis dados de estudo positivos para amitriptilina na dose de 75 mg [20]. O “número necessário para tratar” (NNT), ou seja, o número de pacientes a tratar para conseguir uma redução de 50% na dor, foi dado aqui como 1,7. Foram observados efeitos secundários moderados, tais como fadiga e boca seca.
Relativamente aos anticonvulsivos do grupo modulador do canal de cálcio, um estudo em doentes com dor neuropática central mostrou uma eficácia significativa da pré-gabalina com um NNT de 4,0 [21]. Os efeitos colaterais incluíram tonturas, perturbações cognitivas, fadiga e náuseas. Além disso, o medicamento antiepiléptico lamotrigina do grupo dos bloqueadores dos canais de sódio mostrou uma eficácia moderada com boa tolerância num estudo sobre dor central após acidente vascular cerebral [22]. Noutros distúrbios neuropáticos da dor, a eficácia da lamotrigina não é clara, pelo que, em geral, a sua eficácia é considerada pouco clara [23]. Um estudo com carbamazepina a uma dose de 800 mg/tgl. não mostrou eficácia na dor neuropática após acidente vascular cerebral.
Num estudo sobre dor neuropática de várias etiologias, os opiáceos orais mostraram uma redução média da dor de 23%, embora o número de pacientes com dor neuropática após acidente vascular cerebral fosse baixo, dez em 81, e sete deles abandonaram o estudo por causa dos efeitos secundários [24]. Estudos com administração intravenosa de morfina, lidocaína e propofol mostraram melhorias nas dores pós-infarto durante a infusão. As terapias subsequentes de manutenção oral com morfina e mexiletina foram mal toleradas devido aos efeitos secundários [25–27].
Se não for possível obter uma redução suficiente da dor com os medicamentos acima mencionados, recomenda-se o recurso aos medicamentos de primeira e segunda escolha para a terapia da dor neuropática de origem periférica [18]. Estes incluem os inibidores selectivos de recaptação de serotonina e norepinefrina (SNRIs) como a duloxetina e a venlafaxina como drogas de primeira linha e os opiáceos altamente potentes como o MST, oxicontin e outros opiáceos como drogas de segunda linha (Tabela 3).
Abordagens neurocirúrgicas e terapêuticas intervencionistas: Como demonstrado, as opções de terapia medicamentosa para a dor neuropática após o AVC são limitadas e, portanto, muitas vezes insatisfatórias. De acordo com Dworkin et al. [23], os métodos invasivos podem ser experimentados após esgotar os métodos terapêuticos conservadores ou combinados individuais. A situação actual dos dados relativos às abordagens neurocirúrgicas e de terapia intervencionista é compilada em análises recentes [10,28,29]. Uma vez que as provas para estes procedimentos são limitadas, devem ser reservadas para centros de tratamento experientes.
A estimulação magnética transcraniana repetitiva (rTMS) é um procedimento neuromodulador, não invasivo. Aqui, o efeito é moderado e dura apenas por um curto período de tempo, embora raramente ocorram efeitos secundários graves. Os tratamentos repetidos do córtex motor com rTMS podem mostrar uma melhoria significativa da dor [30,31]. Além disso, esta terapia pode ser usada como um preditor de resposta à estimulação do córtex motor epidural [32].
A eficácia da estimulação do córtex motor epidural para a dor central após o AVC mostrou uma redução da dor de cerca de 45-50% após um ano [28,33]. Raramente são relatadas complicações graves. Perioperativamente, convulsões epilépticas, infecções, além disso, também podem ocorrer problemas técnicos.
A estimulação cerebral profunda (DBS) pode ser considerada como outra terapia invasiva. Aqui, o tálamo sensorial (nervo ventral posterior) ou o cinzento periventricular é estimulado. A eficácia situa-se entre 25 e 67% [34,35]. Em geral, a eficácia não pode ser claramente quantificada, pelo que são necessários mais estudos aqui [28].
Uma nova modalidade de tratamento para pacientes com dor neuropática, incluindo dor neuropática central após acidente vascular cerebral, é o ultra-som de alta intensidade focalizado (HIFUS), que é aplicado transcranialmente, não invasivamente, para ablação térmica de uma área circunscrita do tálamo centro-lateral, o que pode levar ao alívio da dor [36].
Gunther Landmann, MD
Dr Emmanuelle Opsommer
Literatura:
- Breivik H, et al: European Journal of Pain 2006; 10(4): 287-287.
- Gustorff B, et al: Acta Anaesthesiol Scand 2008; 52(1): 132-136.
- Bouhassira D, et al: Pain 2008; 136(3): 380-387.
- Truelsen T, et al: Eur J Neurol 2006; 13: 581-598.
- Jönsson AC, et al: J Neurol Neurosurg Psychiatry 2006; 77: 590-595.
- Andersen G, et al: Pain 1995; 61: 187-193.
- Lindgren I, et al: Stroke 2007; 38: 343-348.
- Kuptniratsaikul V, et al: Am J Phys Med Rehabil 2009; 88: 92-99.
- Treede RD, et al: Neurology 2008; 70(18): 1630-1635.
- Klit H, Finnerup NB, Jensen TS: Lancet Neurol 2009; 8(9): 857-868.
- Weimar C, et al: Cerebrovasc Dis 2002; 14: 261-263.
- Landmann G, Stockinger L, Opsommer E: Dor central pós-acidente explorada por potenciais evocados por laser e testes sensoriais quantitativos: Um estudo de caso múltiplo. 30º Congresso Internacional de Neurofisiologia Clínica (ICCN). Berlim, Alemanha, 2014.
- Tasker R: Estados centrais da dor. In: L JD, editor. Bonica’s management of pain Philadelphia: Lipponcott Williams & Wilkins, 2001; 433-445.
- Holmgren H, et al: Pain 1990; 40: 43-52.
- Garcia-Larrea L, et al: Brain 2002; 125: 2766-2781.
- Boivie J: Eur J Pain 2003; 7: 339-343.
- Widar M, et al: J Pain Symptom Manage 2004; 27: 215-225.
- Dworkin RH: Am J Med 2009; 122(10 Suppl): S1-2.
- Attal N, et al: Eur J Neurol 2010; 17(9): 1113-1188.
- Leijon G: Dor 1989; 36: 27-36.
- Vranken JH, et al: Pain 2008; 136: 150-157.
- Vestergaard K, et al: Neurology 2001; 56: 184-190.
- Dworkin RH, et al: Pain 2007; 132(3): 237-251.
- Rowbotham MC, et al: N Engl J Med 2003; 348: 1223-1232.
- Attal N, et al: Neurology 2000; 54: 564-574.
- Attal N, et al: Neurology 2002; 58: 554-563.
- Canavero S: Clin Neuropharmacol 2004; 27: 182-186.
- Cruccu G, et al: Eur J Neurol 2007; 14: 952-970.
- Kumar B, et al: Anestesia e analgesia 2009; 108(5): 1645-1657.
- Khedr EM, et al: J Neurol Neurosurg Psychiatry 2005; 76(6): 833-838.
- Leung A, et al: J Pain 2009; 10(12): 1205-1216.
- Andre-Obadia N, et al: Clin Neurophysiol 2006; 117(7): 1536-1544.
- Fontaine D, Hamani C: Journal of neurosurgery 2009; 110: 251-256.
- Katayama Y, et al: Stereotact Funct Neurosurg 2001; 77: 183-186.
- Owen SL, et al: Pain 2006; 120: 202-206.
- Martin E, et al: Ann Neurol 2009; 66(6): 858-861.
PRÁTICA DO GP 2014; 9(5): 20-24