As condições crónicas das pernas venosas são comuns e conduzem frequentemente a úlceras venosas crónicas. A terapia baseia-se no tratamento local da úlcera, terapia da insuficiência venosa crónica e profilaxia de recorrência. A úlcera é geralmente tratada principalmente com desbridamento cirúrgico. Seguem-se os pensos para feridas húmidas aplicados por profissionais qualificados. A terapia de compressão é a pedra angular da terapia para a insuficiência venosa crónica. A reabilitação do sistema venoso superficial (veias trunculares e perfuradoras) serve para evitar a recorrência. Métodos mais modernos como a ablação endovenosa de veias truncais e perfurantes competem com a cirurgia clássica das varizes e mostram resultados encorajadores. Apesar de todas as medidas terapêuticas, o potencial de recorrência desta condição é elevado.
Metade da população adulta mostra estigmas de insuficiência venosa crónica (IVC). A prevalência varia de 2-7% nos homens e de 3-7% nas mulheres [1]. Até 1% da população dos países industrializados sofre de uma úlcera na perna no decurso das suas vidas, a maioria da qual é venosa [2]. Para além do longo sofrimento dos doentes, isto também tem um aspecto socioeconómico que não deve ser subestimado.
Etologia
A ulceração venosa crónica (CVU) representa um grupo heterogéneo de defeitos cutâneos desencadeados por hipertensão venosa crónica e deterioração consecutiva da microcirculação. Etiologicamente, é feita uma distinção entre causas primárias e secundárias. As alterações venosas primárias são caracterizadas por mecanismos etiologicamente não identificáveis de disfunção venosa crónica, manifestando-se na maioria das vezes num sistema venoso superficial insuficiente. As patologias venosas secundárias são principalmente pós-trombóticas ou pós-flebíticas, menos frequentemente pós-traumáticas.
Só o refluxo é responsável pela IVC primária, enquanto que a IVC secundária é normalmente uma combinação de obstrução e refluxo [3]. Patofisiologicamente, ambas as alterações têm em comum uma hipertensão venosa superficial. Os doentes com patologia combinada de obstrução e refluxo têm a maior incidência de lesões cutâneas e úlceras crónicas [4]. Uma úlcera é chamada crónica se não cicatrizar no prazo de seis semanas [4].
Diagnósticos
O diagnóstico de úlcera venosa crónica baseia-se no quadro clínico apoiado por outros exames. A distinção de uma úlcera arterial é muito importante. Se a dor for grave, uma causa que não seja venosa deve ser considerada como um diagnóstico diferencial.
A CVU típica não é dolorosa e está localizada na zona medial do tornozelo. Características de uma génese venosa da úlcera são prurido, ardor, cãibras musculares, inchaço, peso ou “pernas inquietas”. A inspecção revela varizes, telangiectasia, edema, alterações da coloração da pele, flebectaticae de corona e possível lipodermatosclerose [5]. Em contraste, a úlcera arterial é frequentemente dolorosa, localizada no maléolo lateral e associada a claudicação intermitente. O diagnóstico suspeito pode ser confirmado através da medição do índice tornozelo-braquial (ABI).
Diagnóstico venoso: A sonografia duplex com código de cores foi estabelecida para o diagnóstico venoso. É seguro, não invasivo, rentável e fiável [6]. Há um acordo generalizado sobre a avaliação do refluxo no sistema venoso superficial. Por outro lado, a questão de quando uma veia perfuradora deve ser descrita como insuficiente é controversa. Não existe um padrão definido na literatura. A maioria dos autores utiliza um fluxo dirigido para a superfície de ≥500 msec como critério de insuficiência venosa perfurante [5]. Outros estudos consideram relevante o diâmetro da veia perfuradora [7, 8]. Yamamoto et al. mostrou que veias perfurantes insuficientes tinham um diâmetro significativamente maior que perfuradores suficientes (3,6±0,9 mm versus 2,6 ±0,9 mm) [8]. De acordo com as directrizes da Society for Vascular Surgery e do American Venous Forum, um diâmetro de ≥3.5 mm é considerado patológico [7].
Classificação
A classificação das IVC pode ser feita de acordo com a classificação simples de Widmer [9]. A fase 1 caracteriza-se por edema reversível e uma flebectatica paraplantaris corona. Na fase 2, o edema persiste e várias alterações cutâneas como a hemossiderose, púrpura, dermatosclerose, lipodermatosclerose, atrofia branca (Fig. 1), eczema de estase e cianose tornam-se aparentes. A fase 3 de acordo com Widmer descreve CVI com cruris ulcus.
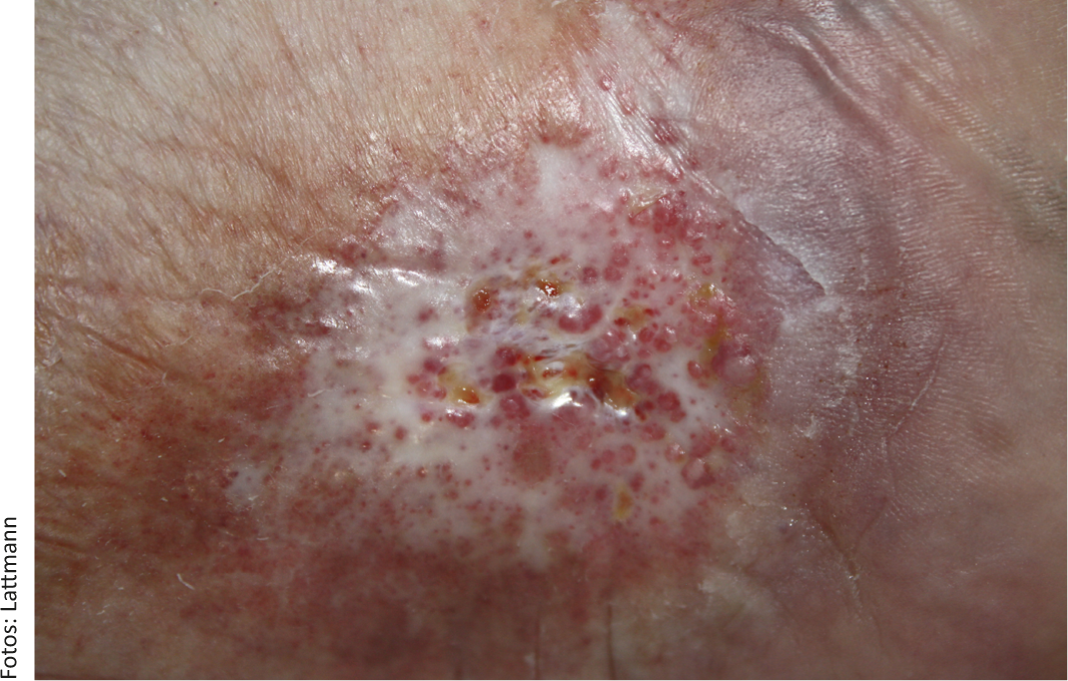
Fig. 1: Úlcera venosa crónica numa paciente do sexo feminino de 63 anos de idade com marcada atrofia blanche. Nenhuma cura espontânea sob terapia de compressão consistente
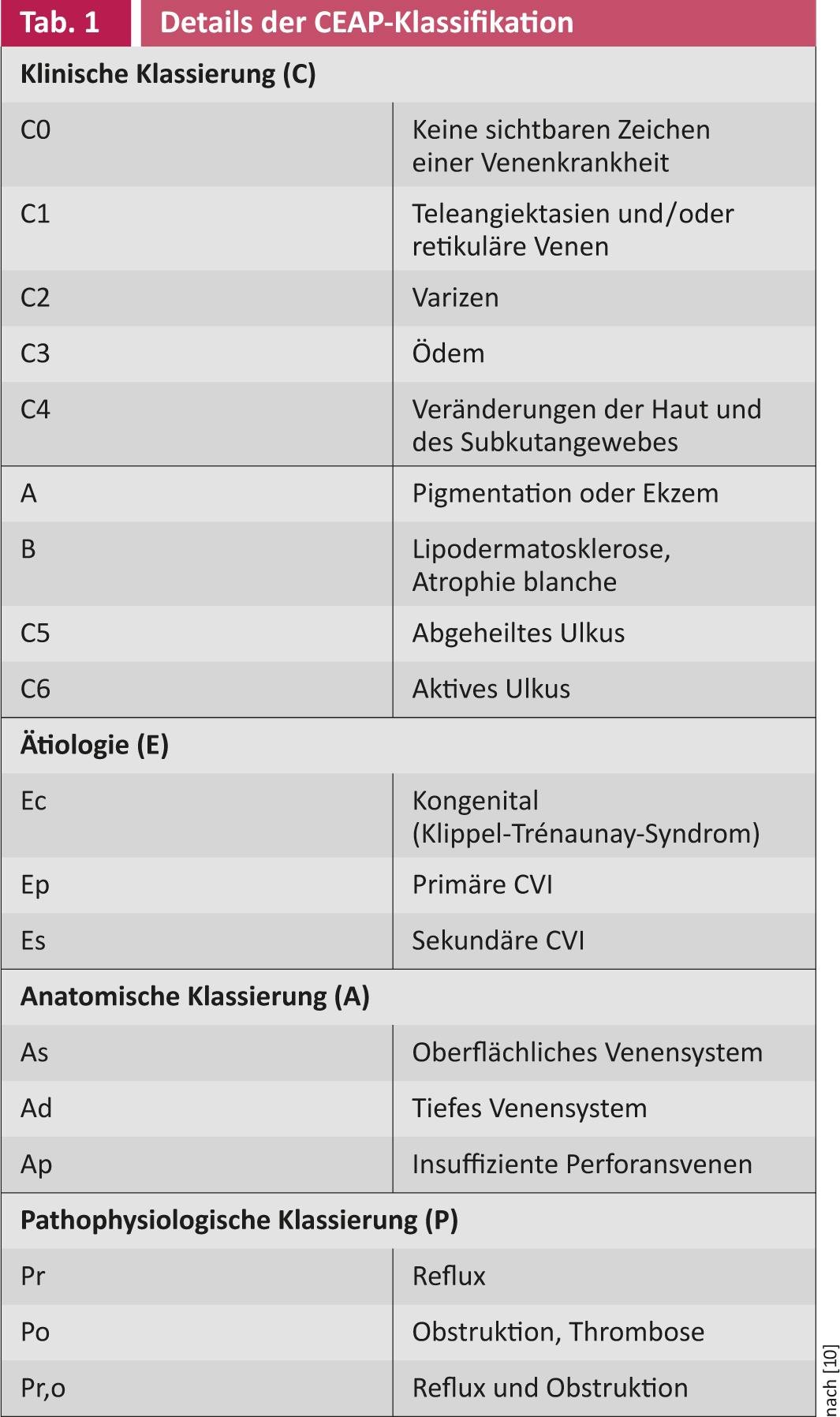
A classificação muito mais precisa e internacionalmente aceite é a classificação CEAP(Tab. 1) [10]. Os princípios da classificação CEAP baseiam-se numa descrição das alterações clínicas (C), da etiologia (E), das alterações anatómicas patológicas das veias (A) e da fisiopatologia subjacente (P). De acordo com a classificação CEAP, as fases C5 e C6 são particularmente relevantes em relação a úlceras crónicas.
Terapia
O tratamento da CVU é baseado em três pilares: tratamento local da úlcera, tratamento da IVC e profilaxia de recidiva.
Terapia local: O tratamento de feridas locais começa geralmente com desbridamento cirúrgico para remover tecido desvitalizado e película de fibrina (Fig. 2).
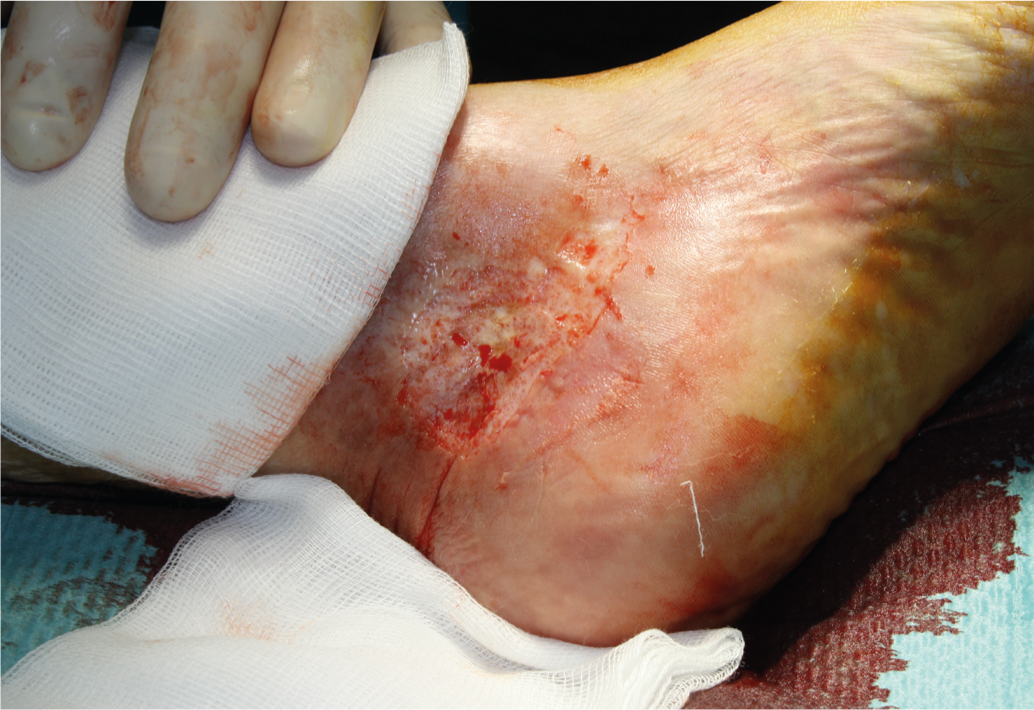
Fig. 2: Tangencial, desbridamento cirúrgico com o dermatoma da mão
Isto trata a infecção normalmente já existente de “baixo grau” e melhora as condições para a cicatrização de feridas. Depois disso, são indicados pensos oclusivos, por exemplo, pensos hidrocolóides, hidrogel ou alginatos. Têm um efeito autolítico, que ajuda a limpar a ferida, e a manter o ambiente da ferida húmido. Os pensos para feridas com prata ionizada como ingrediente activo destinam-se a conter a colonização bacteriana. Num ensaio aleatório (ensaio VULCAN), não foi possível encontrar nenhum efeito positivo dos produtos que contêm prata em termos de taxa de cicatrização de feridas e tempo de cicatrização, razão pela qual a sua utilização de rotina não é recomendada [11].
Uma ferida com uma redução de área de pelo menos 40% após três semanas de tratamento adequado da ferida é muito susceptível de sarar completa e rapidamente sem qualquer alteração na terapia [14]. Para acelerar a cicatrização da ferida ou para o encerramento definitivo, enxerto de pele com espessura dividida (Fig. 3 e 4), que deve ser aplicado com um sistema assistido por vácuo, uma vez que isso aumenta significativamente a taxa de crescimento [12]. Como alternativa à cobertura cutânea dividida, estão disponíveis métodos modernos de tratamento de feridas (equivalentes de pele autóloga a partir de queratinócitos [Epidex®], equivalentes de pele alogénicos cultivados de fibroblastos e queratinócitos [Apligraf®], sobreposições de matriz extracelular [Oasis®]fibrina enriquecida com plaquetas [Vivostat PRF®]factores de crescimento, etc.). Estes métodos devem ser considerados se a redução da área da ferida após três semanas for inferior a 40% [13, 14]. Os ensaios aleatórios comparando estes produtos com cobertura de pele dividida ou taxas de cicatrização espontânea são em grande parte inexistentes.
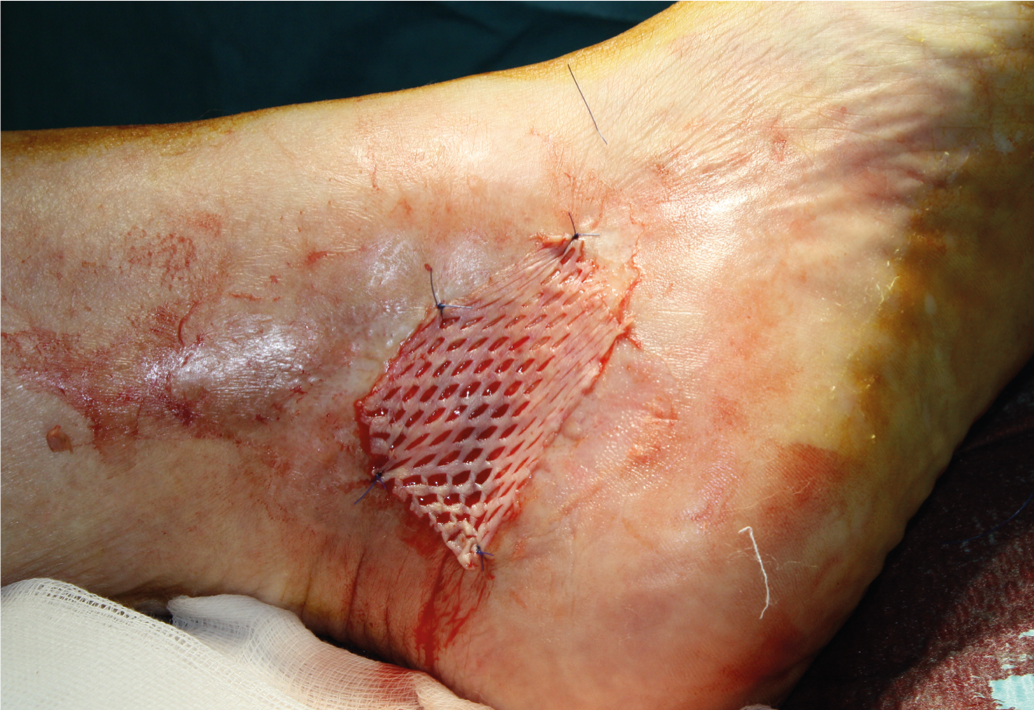
Fig. 3: Enxerto cutâneo dividido
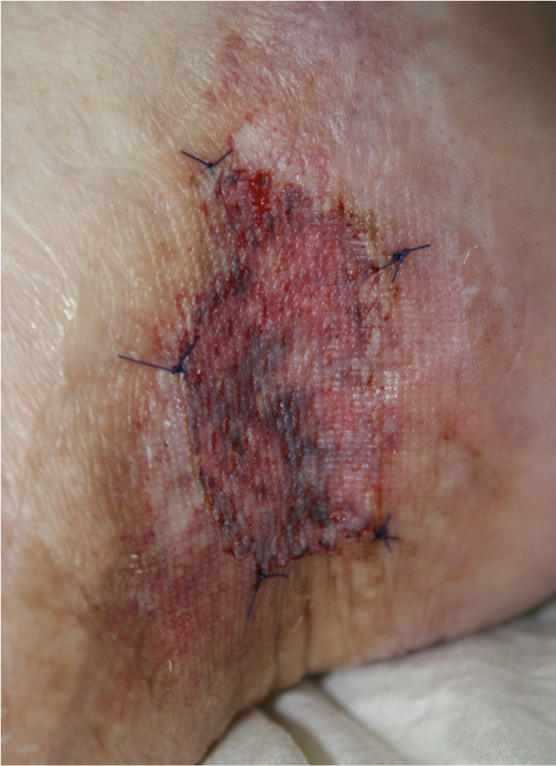
Fig. 4: Úlcera cicatrizada com pele gretada cicatrizada
Terapia de IVC: A terapia de compressão provou ser eficaz no tratamento de IVC. Conduz a um aumento significativo da taxa de cura [15, 16]. Na primeira fase, que dura cerca de três semanas, o descongestionamento é o objectivo principal. Isto é feito com a vantagem de ligaduras de compressão. Após esta fase, as meias de compressão devem ser preferidas às ligaduras de compressão, uma vez que mais úlceras cicatrizam em menos tempo com meias [15]. As razões para tal não estão claramente demonstradas. A terapia de compressão deve ter uma pressão de 40 mmHg, uma vez que esta alcança uma taxa de cura superior a 20 mmHg (corresponde à classe de compressão 2 a 3) [2, 16].
No tratamento da síndrome pós-trombótica, a terapia endovascular das veias pélvicas por meio de um stent é útil, no melhor dos casos, [23]. A reconstrução do sistema venoso profundo por reconstrução ou transplante de válvulas está reservada para situações especiais.
Prevenção de recaídas: Devido à elevada taxa de recaídas (30% após 1 ano, 78% após 2 anos [17]), deve ser dada alta prioridade à prevenção de recaídas. Como o tratamento de um sistema venoso superficial insuficiente e veias perfurantes insuficientes leva a uma redução significativa da taxa de recorrência [7, 18, 19], elas são de importância central.
As veias trunculares insuficientes devem ser tratadas com a realização de cruzectomia e desnudamento da veia safena magna até cerca do nível da articulação do joelho ou ligadura e desnudamento da veia safena (nível de evidência 2B ou 1B) [7]. Alternativamente, a ablação endovenosa utilizando radiofrequência ou laser pode ser considerada [19]. A terapia endovenosa das veias trunculares e também das veias perfurantes ganhou enorme importância nos últimos anos e mostra resultados muito bons [20]. No futuro, irá competir ferozmente com a cirurgia tradicional das veias varicosas. A escleroterapia das veias trunculares insuficientes parece ser inferior à terapia cirúrgica e endovenosa [20].
Os dados sobre a terapia de perfuradores insuficientes são actualmente insuficientes, uma vez que não estão disponíveis estudos aleatórios. Numa revisão sistemática das directrizes, O’Donnell recomenda que o foco principal do tratamento do refluxo sejam as veias trunculares [21]. Grandes perfuradores insuficientes (>3,5 mm) com grande volume de refluxo na área da úlcera podem ser tratados. São possíveis procedimentos cirúrgicos abertos, ligação de perfurador endoscópico (“Subfascial Endoscopic Perforator Surgery”, SEPS) e também ablações endovenosas percutâneas (térmicas ou químicas). Não há estudos randomizados sobre o valor destes três métodos. As directrizes da Sociedade de Cirurgia Vascular recomendam o tratamento de perfuradores insuficientes na área de uma úlcera na fase C5 e C6 [7] por meio de ligadura cirúrgica, SEPS, escleroterapia guiada por ultra-sons ou ablação térmica, especialmente se a terapia conservadora da UV falhar. Lawrence et al. mostrou que na CVU não cicatrizante, a ablação endovenosa de pelo menos uma veia perfurante foi capaz de cicatrizar 90% das úlceras [22].
Previsão
Mesmo quando uma úlcera cicatrizou, a taxa de recorrência é muito elevada, até 78% [17]. Nos doentes que foram submetidos a reparação cirúrgica das varizes após a cura, para além da terapia conservadora com compressão, a taxa de recorrência é significativamente mais baixa do que apenas com compressão (31 vs. 56%) [18]. Isto é verdade não só para pacientes com insuficiência venosa extrafascial, mas também para pacientes com refluxo venoso combinado extrafascial e profundo [18].
Thomas Lattmann, MD
Literatura:
- Callam MJ: Br J Surg 1994; 81(2): 167-173.
- O’Meara S, Cullum NA, Nelson EA: Compressão de úlceras nas pernas venosas. Cochrane Database Syst Rev. 2009; (1): CD000265.
- McAree BJ, Berridge DC: Phlebology 2010; 25(suppl 1): 20-27.
- Abbade LP, Lastória S: Int J Dermatol 2005; 44(6): 449-456.
- Gloviczki P: J Vasc Surg 2011; 53(5 Suppl): 1S.
- Coleridge-Smith P, et al: Eur J Vasc Endovasc Surg 2006; 31(1): 83-92.
- Gloviczki P, et al: J Vasc Surg 2011; 53(5 Suppl): 2S-48S.
- Yamamoto N, et al: J Vasc Surg 2002; 36(6): 1225-1230.
- Widmer LK, et al: Langenbecks Arch Chir 1978; 347: 203-207.
- Porter JM, Moneta GL: J Vasc Surg 1995; 21(4): 635-645.
- Michaels JA, et al: British Journal of Surgery 2009; 96(10): 1147-1156.
- Körber A, et al: Dermatology 2008; 216(3): 250-256.
- Gelfand JM, Hoffstad O, Margolis DJ: J Invest Dermatol 2002; 119(6): 1420-1425.
- Phillips TJ, et al: J Am Acad Dermatol 2000; 43(4): 627-630.
- Amsler F, Willenberg T, Blättler W: J Vasc Surg 2009; 50(3): 668-674.
- O’Meara S, et al: Compressão de úlceras de perna venosa. Cochrane Database Syst Rev. 2012; 11: CD000265.
- Mayer W, Jochmann W, Partsch H: Wien Med Wochenschr 1994; 144(10-11): 250-252.
- Gohel MS, et al: BMJ 2007; 335(7610): 83.
- Harlander-Locke M, Let al: J Vasc Surg 2012; 55(2): 458-464.
- Rasmussen LH, et al: Br J Surg 2011; 98(8): 1079-1087.
- O’Donnell TF: Phlebology 2010; 25(1): 3-10.
- Lawrence PF, et al: J Vasc Surg 2011; 54(3): 737-742.
- Rosales A, Sandbaek G, Jorgensen JJ: Eur J Vasc Endovasc Surg 2010; 40(2): 234-240.
CARDIOVASC 2013, No. 4: 14-17










