As células T dotadas de especificidade tumoral através da expressão de um recetor de antigénio quimérico (CAR) estão a tornar-se cada vez mais importantes. São já cada vez mais utilizadas na terapia celular adotiva na luta contra o cancro. A principal vantagem da transferência de um CAR, por oposição à transferência de um recetor de células T (TCR) normal, é que um CAR pode reconhecer o tumor independentemente do MHC.
As células T dotadas de especificidade tumoral através da expressão de um recetor de antigénio quimérico (CAR) estão a tornar-se cada vez mais importantes. São já cada vez mais utilizadas na terapia celular adotiva na luta contra o cancro. O conceito CAR foi originalmente desenvolvido no final da década de 1980 por Zelig Eshhar (Weizmann Institute of Science, Rehovot, Israel) [1,2]. A maioria dos CAR é constituída por uma construção scFv derivada de anticorpos que se ligam ao antigénio tumoral (fragmento variável de cadeia simples, que é uma proteína de fusão produzida artificialmente, constituída por uma parte variável de uma cadeia leve e uma cadeia pesada de uma imunoglobulina) e a parte intracelular da cadeia CD3ζ, a em dó sustenido está ligado a um ou mais domínios coestimuladores [3]. Esta estrutura semelhante a um bloco de construção permite a ativação de células T específicas de antigénio em resposta ao reconhecimento específico de antigénios na superfície de células malignas, iniciado pela ligação de scFv, e subsequente sinalização através da cadeia CD3ζ e do domínio coestimulador [3]. A co-estimulação ocorre geralmente através de CD28 (superfamília de imunoglobulinas) ou através de 4-1BB (superfamília de receptores de TNF) [3]. No entanto, existem também muitos outros formatos. A principal vantagem da transferência de um CAR, por oposição à transferência de um recetor de células T (TCR) normal, é que um CAR pode reconhecer o tumor independentemente do MHC.
Até agora, esta tecnologia tem sido utilizada para desenvolver CARs que visam vários antigénios de superfície celular em tumores sólidos ou hematológicos. As células CAR-T, específicas para antigénios-alvo como o CD19 nas células B ou o antigénio de maturação das células B (BCMA) nos plasmócitos, conduziram a regressões clínicas impressionantes em leucemias, linfomas ou mielomas em vários estudos clínicos [4–6]. Resultados como estes levaram, entre outras coisas a aprovação do tisagenlecleucel para o tratamento da leucemia linfoblástica aguda de células B (LLA), do axicabtagene-ciloleucel para o tratamento do linfoma não-Hodgkin agressivo de células B Brexucabtagene-Autoleucel para o tratamento do linfoma das células do manto, Lisocabtagene-Maraleucel para o tratamento do linfoma das grandes células B e Idecabtagene-Vicleucel e Ciltacabtagene-Autoleucel para o tratamento do mieloma múltiplo pela Administração de Alimentos e Medicamentos dos EUA (FDA) e a Agência Europeia de Medicamentos (EMA) [3].
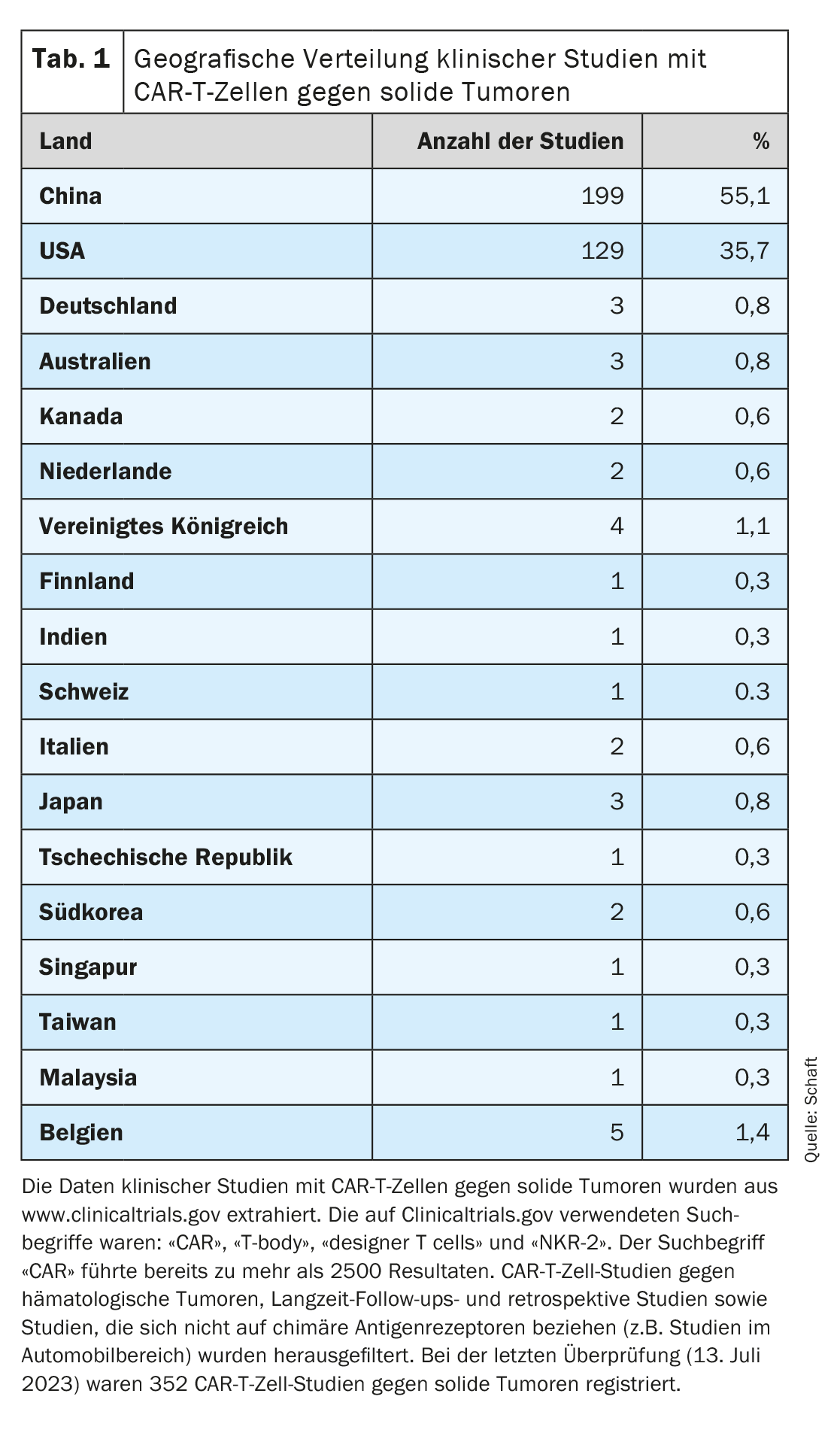
Uma vez que a maioria dos ensaios clínicos se centra na eliminação de tumores hematológicos, o desenvolvimento de células CAR-T contra tumores sólidos está a ficar para trás (ver resumo pormenorizado em [7–11]). Analisando a distribuição geográfica dos ensaios clínicos com células CAR-T contra tumores sólidos registados no Clinicaltrials.gov (n=352; última avaliação em 13 de julho de 2023), é evidente que a maioria destes ensaios está a ser realizada na China (n=199; 55,1%). Os EUA estão em segundo lugar (n=129; 35,7%). Apenas um número muito reduzido de estudos foi efectuado na Europa (Alemanha n=3, Suíça n=1), na Austrália e no resto da Ásia (combinado n=33; 9,2%) (Quadro 1).
Formatos CAR
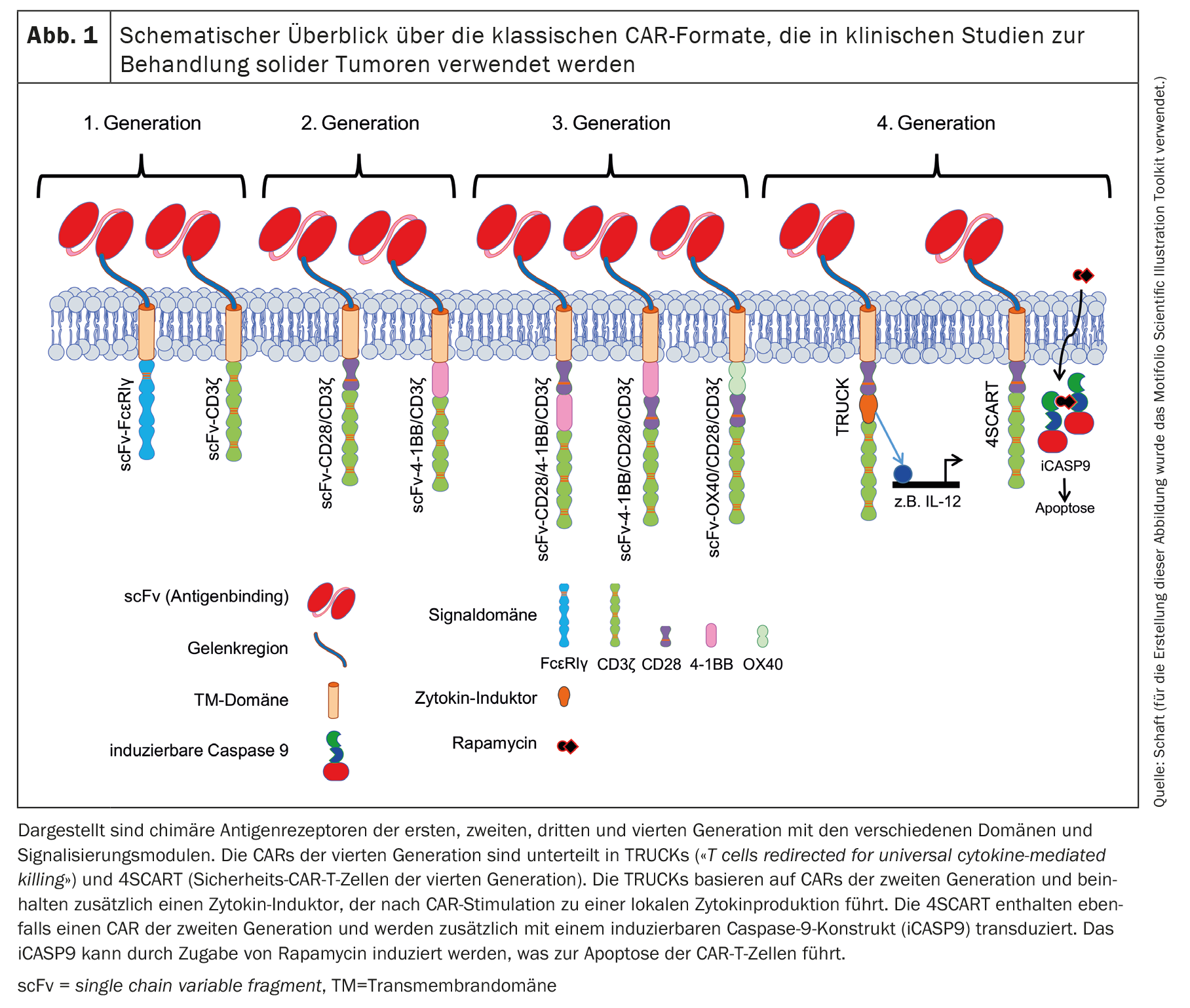
Desde a publicação do primeiro conceito de CAR por Zelig Eshhar em 1989 [1,2], os CAR têm sido continuamente desenvolvidos. Isto levou a várias gerações de CAR baseadas no quadro básico do conceito original de CAR. O CAR clássico contém sempre um scFv baseado num anticorpo que pode ligar-se ao antigénio do tumor. Nos CAR de primeira geração (Fig. 1), o scFv está ligado ao domínio de sinalização intracelular do FcεRIγ ou do CD3ζ através de um ligante flexível e de um domínio transmembranar [11,12].
A maioria dos ensaios clínicos registados com células CAR-T contra tumores sólidos utiliza um CAR de segunda geração [11,12], que também contém um domínio coestimulador (Fig. 1). A co-estimulação é geralmente efectuada por CD28 ou 4-1BB [3]. A co-estimulação de CD28 apoia fisiologicamente a produção de IL-2, -6, -10 e outras interleucinas, bem como a progressão do ciclo celular, a sobrevivência, a diferenciação e a função citolítica das células T [13]. Em muitos estudos em que foram utilizados CARs com um domínio de sinalização CD28, observaram-se efeitos antitumorais eficazes e rápidos. No entanto, estes foram apenas de curta duração e foram associados a uma sobrevivência limitada in vivo em comparação com os CAR com um domínio de sinalização 4-1BB, por exemplo [14]. A sinalização 4-1BB fisiológica nas células T aumenta a progressão e a proliferação do ciclo celular, a secreção de citocinas, o potencial citolítico das células T e inibe a eliminação clonal ea morte celular induzida pela ativação (AICD) [15,16]. Os CAR que contêm 4-1BB como domínio de sinalização não só permitiram uma ativação celular mais robusta, aumentaram a persistência in vivo, como também promoveram a diferenciação das células CAR-T emcélulas de memória central [4,14,17–24].
Os CAR de terceira geração [11,12] contêm combinações de domínios coestimuladores: CD28/4-1BB, 4-1BB/CD28 ou OX40/CD28 (Fig. 1) [25,26]. Os veículos automóveis de quarta geração são basicamente veículos automóveis de segunda geração com características adicionais. As TRUCK (células T redireccionadas para a morte universal mediada por citocinas) são modificadas de modo a produzirem citocinas de forma localizada e muito limitada [27]. Os efeitos induzidos dependem do tipo de citocinas libertadas: A IL-12, por exemplo, pode ativar uma resposta imune inata contra o tumor [28], provoca uma redução da suscetibilidade aos efeitos inibitórios das células T reguladoras (Tregs) [29] e aumenta a secreção de citocinas e a proliferação de células T [30,31]. A IL-15, por outro lado, aumenta a atividade antitumoral das células CAR-T [32].
Outra variante da quarta geração é o 4SCART (células CAR-T de segurança). Estas células T são transduzidas simultaneamente com um CAR e uma caspase 9 induzível (iCASP9) como precaução de segurança contra eventos adversos. O iCASP9 pode ser induzido pela adição de rapamicina, o que leva à apoptose das células CAR-T.
Transferir tecnologias
Um requisito essencial na produção de células T CAR é encontrar um método adequado para transferir o CAR para as células T. Para o efeito, podem ser utilizados vários métodos existentes. A maioria dos ensaios clínicos utiliza um método de transferência viral (retroviral ou lentiviral) para introduzir de forma estável o CAR nas células T. Durante este processo, um gene codificador de CAR é transportado do vírus para a célula T, onde é integrado de forma estável no ADN genómico. A descendência destas células transduzidas é portadora do gene CAR e pode expressar o recetor na sua superfície celular. As desvantagens da transdução viral são a integração aleatória no genoma da célula hospedeira, que pode levar à destruição ou ativação de alguns genes (ou seja, mutagénese insercional), bem como a introdução de material/genes virais. Este método pode provocar efeitos secundários graves nos doentes tratados com células CAR-T. Lamers et al. descreveram, por exemplo, o desenvolvimento de respostas imunitárias ao transgene que codifica o recetor e ao vetor retroviral [33].
Alguns ensaios clínicos utilizam um sistema de entrega de genes não viral ou um método de transferência que integra o gene CAR num local específico (por exemplo, sistema de transposão Sleeping Beauty [34–37], sistema de transposão PiggyBac [36,37], CRISPR-Cas9 [38]). A transfecção de ADN ou ARN são outros sistemas de transferência [39], que, no entanto, não conduzem à integração da sequência codificadora CAR no genoma da célula hospedeira. A expressão transitória do CAR daí resultante tem algumas vantagens.
Células CAR-T contra tumores sólidos – seleção de antigénios e precauções de segurança
Tal como acima descrito, a utilização clínica de células CAR-T no tratamento de tumores sólidos está a ficar para trás em relação ao sucesso das células CAR-T no tratamento de tumores hematológicos. Uma das razões para tal é que o CD19 e o BCMA são antigénios alvo que são especificamente expressos por células B ou plasmócitos e a sua eliminação completa é relativamente inofensiva. Outros antigénios, especialmente em tumores sólidos, são frequentemente também expressos em tecidos saudáveis, o que torna difícil a seleção de um antigénio alvo adequado.
Seleção do antigénio
Os antigénios alvo ideais em tumores sólidos combinam três propriedades essenciais:
- Expressão uniforme na superfície das células malignas, o que reduz o risco de variantes de fuga negativas para o antigénio.
- Ausência de expressão em células não malignas (ou seja, expressão exclusiva nas células tumorais), evitando assim o risco de efeitos secundários graves e potencialmente fatais decorrentes da atividade on-target/off-tumour das células CAR-T [40,41].
- Um papel crucial como condutor oncogénico nas células cancerígenas que impede a desregulação dos antigénios devido a uma vantagem selectiva de sobrevivência das células malignas.
- Além disso, a co-expressão do antigénio em células vizinhas no microambiente tumoral (por exemplo, em vasos associados ao tumor, fibroblastos e macrófagos) é outra caraterística positiva de um antigénio alvo ideal, uma vez que a estrutura de fornecimento do tumor pode ser atacada pela terapia específica do antigénio.
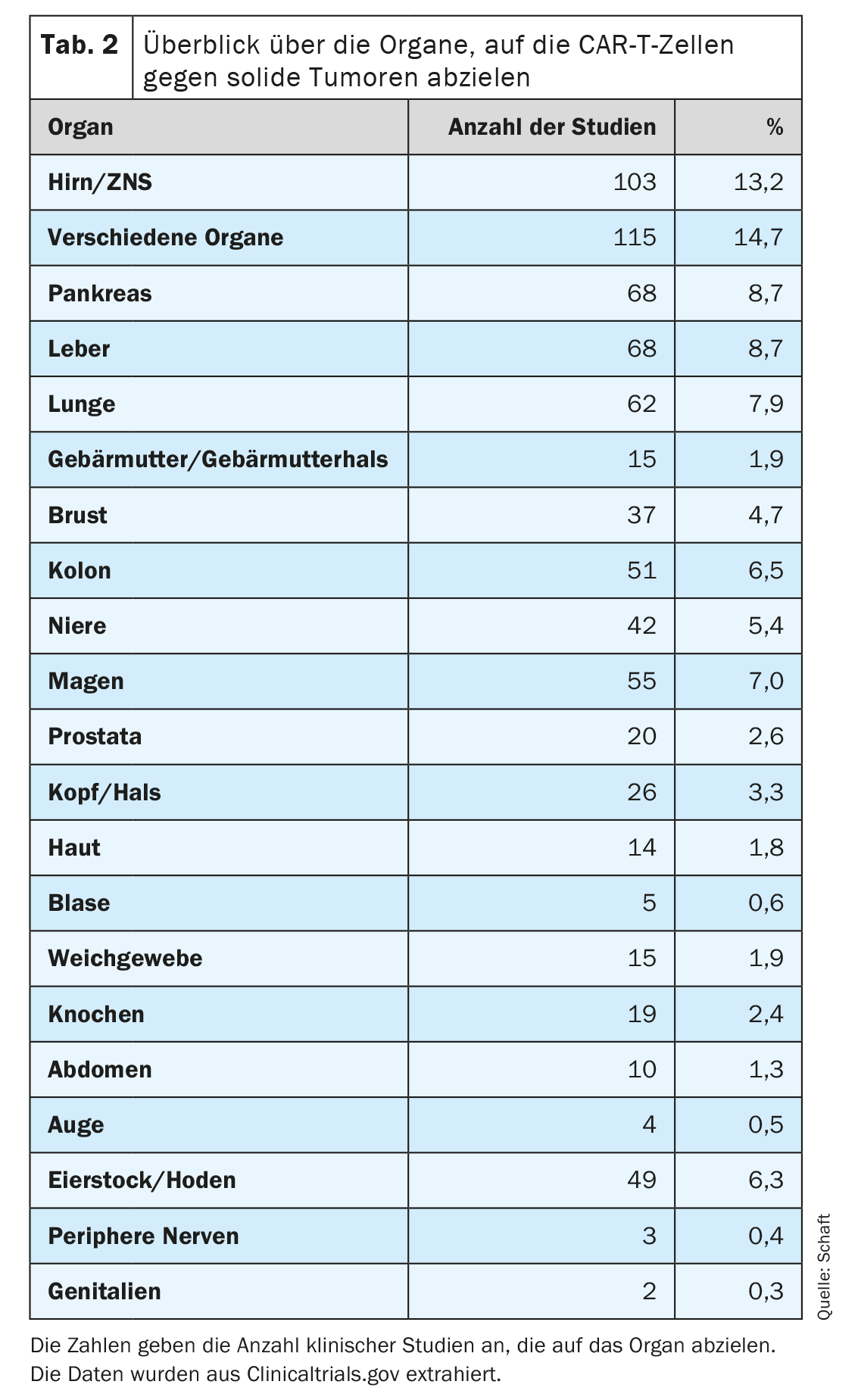
O segundo ponto, em particular, coloca o maior problema para o desenvolvimento de células CAR-T contra tumores sólidos, uma vez que a maioria dos antigénios expressos em tumores sólidos são também expressos em tecidos saudáveis importantes. Isto pode levar a uma reação indesejável no alvo/fora do tumor e a efeitos secundários associados. No entanto, muitos tipos diferentes de tumores sólidos (81 entidades cancerígenas no total) num total de 20 órgãos estão a ser alvo de células CAR-T específicas para 63 antigénios diferentes (Quadro 2). Em muitos estudos clínicos, estão a ser investigados, em particular, tumores do cérebro/CNS, do fígado, do pâncreas e do pulmão (n=103, 68, 68 e 62, respetivamente; Tab. 2). Tal pode dever-se à elevada necessidade médica e/ou à falta de terapias alternativas eficazes para os tumores nos órgãos correspondentes.
Precauções de segurança
Se um antigénio alvo for reconhecido pelas células CAR-T transferidas em tecidos saudáveis, podem ocorrer efeitos secundários indesejáveis e graves. Foram desenvolvidas várias estratégias para desativar as células CAR-T o mais rapidamente possível em caso de toxicidade no doente. A rapamicina, uma molécula capaz de induzir a dimerização dos constructos, pode ser utilizada, por exemplo, para ativar uma caspase 9 induzível. No 4SCART, estas construções induzíveis são transferidas para as células T em simultâneo com o CAR, como o chamado interrutor suicida (Fig. 1). Após a dimerização induzida pela rapamicina, a caspase 9 induz a apoptose das células T CAR. Isto também elimina a atividade indesejada/inesperada das células T contra o tecido saudável(efeitos no alvo/fora do tumor) [42,43]. Outros comutadores possíveis, como a estratégia timidina quinase/ganciclovir do vírus do herpes simplex (HSV-tk/GCV) [44,45] já estão a ser utilizados [11].
Uma medida de segurança especial para contornar a autoimunidade prolongada induzida por uma reação on-target/off-tumoral do CAR é a transfecção do CAR por electroporação do ARNm [11]. Já demonstrámos em várias publicações que a transfecção transiente de células T com CARs utilizando a electroporação de mRNA pode ser uma ferramenta eficaz e segura na imunoterapia do cancro [46-50]. O processo de electroporação baseia-se em mecanismos físico-químicos complexos que conduzem à perfuração da membrana plasmática através da aplicação de campos eléctricos e permitem a subsequente entrada do ARNm no citosol [51]. A utilização de células CAR-T transfectadas com ARN oferece a vantagem de a expressão do recetor ser limitada no tempo, pelo que a potencial toxicidade fora do alvo e no alvo/fora do tumor é também limitada. A estratégia de transferência de CAR-RNA é particularmente atractiva em ensaios clínicos de fase 0/1 que investigam novos antigénios tumorais para a terapia com células T CAR com um perfil de segurança clínica desconhecido.
Células CAR-T clinicamente testadas contra o melanoma uveal
Surpreendentemente, apenas quatro estudos clínicos com células T CAR contra tumores sólidos se centram no olho (Quadro 2) . Destes, dois estudos são dirigidos contra o retinoblastoma e dois estudos contra o melanoma uveal. O melanoma da úvea é o tipo mais comum de cancro do olho e provoca metástases em até 50% dos doentes. As metástases ocorrem predominantemente no fígado e estão associadas a um tempo de sobrevivência mediano fraco de cerca de 12 meses. Apesar dos enormes progressos no tratamento do melanoma cutâneo metastizado com o bloqueio do ponto de controlo imunitário (ICB), este não é eficaz no melanoma uveal. Apenas o recém-aprovado iniciador de células T biespecífico Tebentafusp (um scFv específico de CD3 ligado a um TCR solúvel que reconhece um péptido gp100 apresentado pelo HLA-A2) pode atenuar a progressão e prolongar a sobrevivência global num subconjunto de doentes com melanoma uveal metastático. Os efeitos positivos observados do Tebentafusp são de curta duração, com um tempo de sobrevivência global mediano de 22 meses e uma taxa de sobrevivência a três anos de 24%. Além disso, apenas 50% dos doentes com metástases são elegíveis para esta opção de tratamento devido à restrição do HLA-A2. Por conseguinte, existe também uma grande necessidade médica de abordagens de tratamento alternativas para esta entidade tumoral.
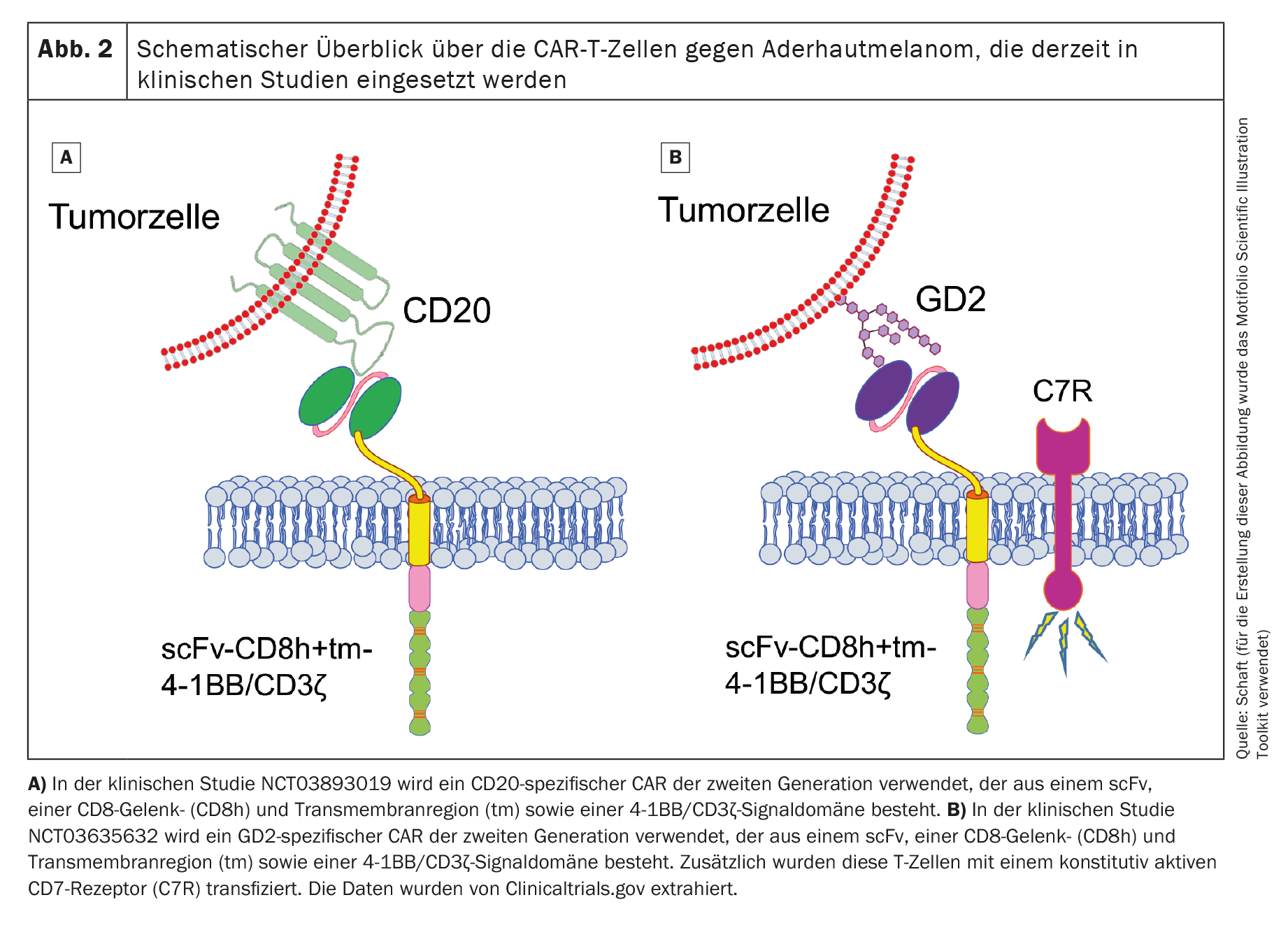
Dois ensaios clínicos com células CAR-T constantes da lista internacional da US National Library of Medicine (www.clinicaltrials.gov) estão atualmente a recrutar doentes com melanoma uveal (NCT03893019 contra o cluster of differentiation 20 [CD20] e NCT03635632 contra o disialogangliosídeo GD2 [GD2]). Ambos os estudos utilizam células CAR-T que visam antigénios não específicos do melanoma.
O primeiro ensaio clínico (fase 1; NCT03893019), que utiliza células CAR-T específicas para CD20 de segunda geração (Fig. 2A), é patrocinado pela Miltenyi Biomedicine GmbH (Investigador Principal [PI]: Peter Borchmann; Hospital Universitário de Colónia) e está a recrutar principalmente doentes com melanoma cutâneo. Alguns doentes com melanoma uveal também são tratados. O CD20 é um antigénio alvo que é expresso em células B normais e é normalmente utilizado como antigénio alvo no linfoma não Hodgkin de células B [52]. No entanto, também é expresso num pequeno subconjunto de células de melanoma [53,54]. No entanto, o tratamento orientado de um antigénio que só é expresso num pequeno subgrupo de células cancerígenas poderia levar a que o tumor escapasse facilmente à terapia com células CAR-T. Infelizmente, o estado atual deste ensaio clínico não é conhecido.
O segundo ensaio clínico (também de fase 1; NCT03635632) utiliza células CAR-T específicas para GD2 (Fig. 2B) e está a recrutar doentes com neuroblastoma, sarcoma, melanoma uveal, cancro da mama ou outros cancros que expressem GD2. Este estudo, patrocinado pelo Baylor College of Medicine (PI: Bilal Omer; Baylor College of Medicine), está atualmente ativo, mas não estão a ser recrutados quaisquer doentes.
Para além do CAR de segunda geração, os investigadores também transduziram um recetor de IL-7 constitutivamente ativo nas células T, a fim de prolongar a sobrevivência das células CAR-T após a transferência adotiva. A GD2 é expressa, embora em níveis muito baixos, no cerebelo e nos nervos periféricos [55], o que torna o tratamento com células CAR-T específicas da GD2 muito arriscado se for induzida uma reação on-target/off-tumor. Também ainda não foram publicados dados relativos a este ensaio clínico.
Em resumo, existe um grande potencial para ensaios clínicos com células CAR-T contra antigénios específicos do melanoma (úvea) em que o risco de uma reação no alvo/fora do tumor é baixo.
A procura de um melhor antigénio tumoral no melanoma uveal
A prevenção ou redução de uma possível reação on-target/off-tumour é, como já foi referido na secção “Células CAR-T contra tumores sólidos”, um requisito básico na procura de novos antigénios. Em termos pré-clínicos, a atenção centra-se atualmente em dois antigénios expressos nos melanomas uveais: o recetor 2 do fator de crescimento epidérmico humano (HER2) e o proteoglicano de sulfato de condroitina 4 (CSPG4).
HER2
O HER2 é um membro da família ErbB de receptores tirosina-quinases (EGFR [ErbB-1], HER2 [/neu] [ErbB-2], Her 3 [ErbB-3] e Her 4 [ErbB-4]). As mutações no HER2 levam a uma sobreexpressão, resultando numa ativação constitutiva e numa divisão celular descontrolada. Isto aplica-se sobretudo ao cancro da mama, mas também a outros tipos de cancro, como o cancro do ovário ou os gliomas [56–58].
Como já foi referido, a utilização de células CAR-T é uma faca de dois gumes, uma vez que a eficácia destas células pode também virar-se contra o doente [59]. Nunca se pode excluir que um tipo de célula raro mas essencial expresse o antigénio em tecidos saudáveis. Investigadores do Instituto Nacional do Cancro relataram um caso que ilustra o potencial mortal da toxicidade on-target/off-tumoral do antigénio HER2. Pouco depois da infusão de células CAR-T específicas de HER2, foram observados sintomas clínicos de síndrome de dificuldade respiratória aguda que exigiram respiração artificial num doente com cancro colorrectal metastático [60]. Infelizmente, o doente morreu cinco dias após o início da angústia respiratória aguda [60]. A causa da morte foi provavelmente o resultado de toxicidade on-target/off-tumoral causada por baixos níveis de HER2 nas células epiteliais dos pulmões. Notavelmente, o CAR foi baseado no anticorpo monoclonal trastuzumab aprovado pela FDA, que tem sido utilizado extensivamente sem causar toxicidade pulmonar grave [61]. Isto sublinha a necessidade de uma seleção muito cuidadosa do antigénio alvo para a terapia com células T CAR.
CSPG4
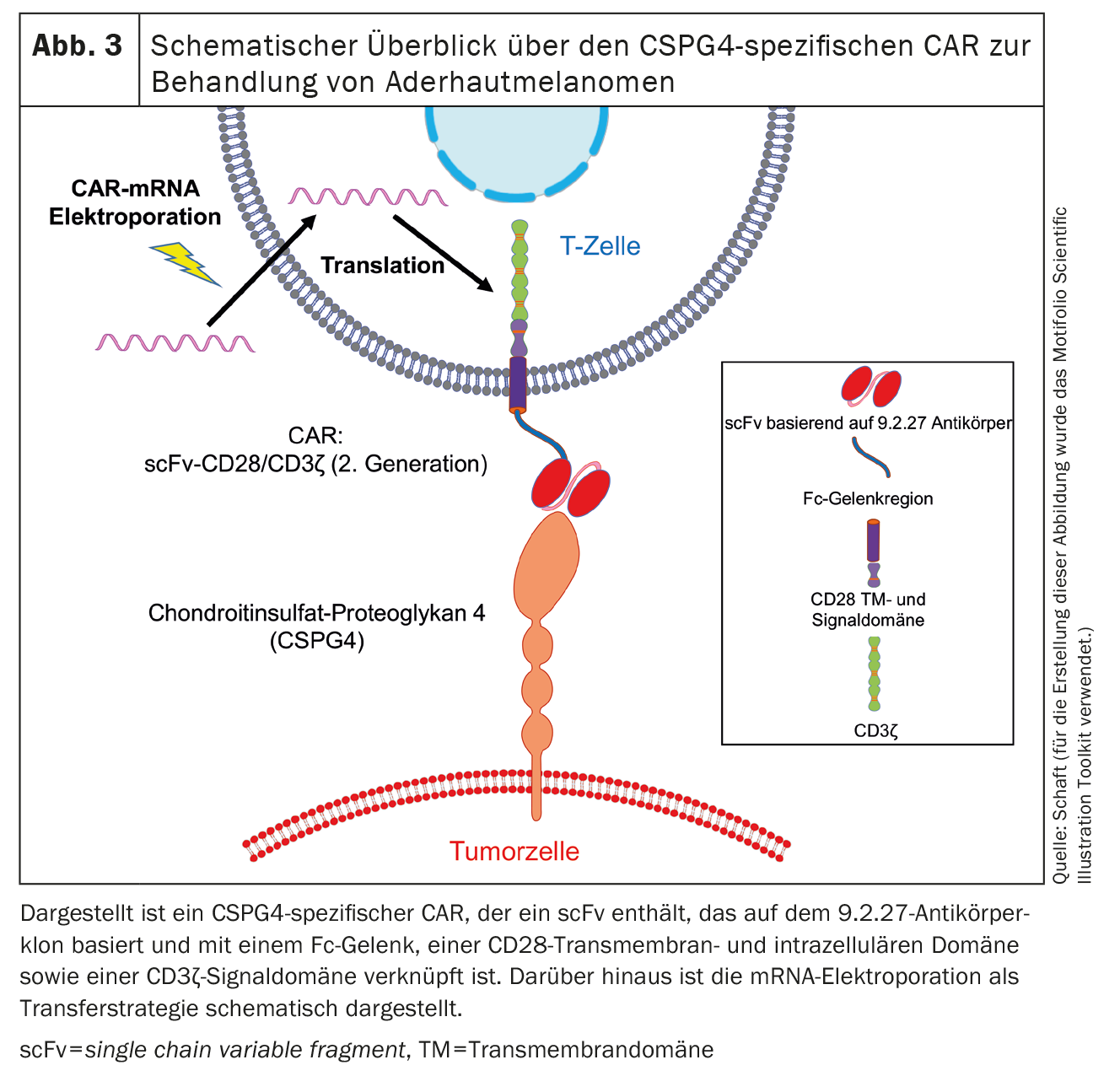
O segundo antigénio expresso nos melanomas uveais é o proteoglicano de sulfato de condroitina 4 (CSPG4) (Fig. 3), anteriormente também conhecido como proteoglicano de sulfato de condroitina associado ao melanoma (MCSP) ou antigénio associado ao melanoma de elevado peso molecular (HMW-MAA). A CSPG4 é uma proteína transmembranar de passagem única do tipo 1 e foi descoberta por Ralph Reisfeld [72]. Nós e outros grupos de trabalho [47-50, 62-71] trabalhámos principalmente no CSPG4. A expressão de CSPG4 está associada a um aumento da proliferação e da sobrevivência das células tumorais. Este processo é iniciado pela ativação da via de sinalização MAPK e pela apresentação cruzada de factores de crescimento [73]. Além disso, a CSPG4 desempenha um papel na motilidade celular e na infiltração de tecidos devido à sua associação com o citoesqueleto de actina e à ligação a várias integrinas e componentes da matriz extracelular [74]. Além disso, a CSPG4 está envolvida na formação da placenta [75], na angiogénese [76], na formação de redes neuronais [77], na renovação dos queratinócitos e na homeostasia das células estaminais epidérmicas [78].
Várias publicações descreveram a expressão de CSPG4 em tecidos não patológicos, tais como precursores do folículo piloso e células epidérmicas, células endoteliais e pericitos activados (mas não em vasos maduros) [79,80], condrócitos da cartilagem articular [81], células musculares lisas [82] e células da sinapse neuromuscular do músculo esquelético humano pós-natal [83]. No entanto, a expressão de CSPG4 é significativamente menor nos tecidos saudáveis do que nas células tumorais [62,73,84].
Beard et al. mostraram que a CSPG4 podia ser detectada ao nível do ARN numa variedade de tecidos normais, incluindo o sistema nervoso central, o olho, a pele, o tecido adiposo, os vasos sanguíneos, a bexiga, o trato gastrointestinal, o útero, a próstata, o baço e o timo [85]. Em média, o ARN do CSPG4 está sobreexpresso 6,6 vezes no tecido maligno (melanoma) em comparação com o tecido saudável [85]. Estes resultados confirmam trabalhos anteriores de Erfurt et al. que demonstraram que, embora o ARNm da CSPG4 tenha sido detectado em algumas amostras de tecido normal, a expressão estava significativamente aumentada em amostras de melanoma cutâneo e melanoma uveal [86].
A coloração imuno-histoquímica e as matrizes proteicas de fase reversa mostraram que a expressão específica de CSPG4 a nível proteico só podia ser detectada em algumas amostras do intestino delgado [63]. Não foi detectada a expressão da proteína CSPG4 nos seguintes tecidos: Cérebro, nervos periféricos, pele, mesotélio, mama, coração, rim, glândulas supra-renais, fígado, pulmão, gânglios linfáticos, músculos, ovários, pâncreas, esófago, próstata, baço, estômago, útero e tiroide [62,63]. Em contrapartida, a CSPG4 é expressa em quase todas as células de melanoma cutâneo [87–90]. Os melanomas coroidais [91,92] e alguns outros tumores como sarcomas, astrocitomas, gliomas, neuroblastomas [93-96], leucemias [97–101] e cancro da mama triplo-negativo também expressam CSPG4 [102]. Em muitas destas doenças malignas, a expressão de CSPG4 está associada a um mau prognóstico e a um crescimento agressivo do tumor [103].
Além disso, o CSPG4 é considerado um antigénio alvo primário dos tumores [84], uma vez que desempenha um papel na metástase do melanoma [104] e é expresso em pericitos activados durante a angiogénese nos tumores e na hipoxia [105–107]. Este último permite a seleção da vasculatura do tumor. Mais importante ainda, a CSPG4 actua como um motor oncogénico no melanoma e promove o crescimento e a sobrevivência das células malignas após a ativação de várias vias de sinalização [73]. Por conseguinte, o tumor não pode simplesmente reduzir a regulação da CSPG4 para escapar à terapia direccionada para a CSPG4.
Por este motivo, o CSPG4 já foi selecionado como antigénio alvo por vários grupos e os CAR específicos do CSPG4 foram introduzidos nas células T através de vários mecanismos. CARs específicos de CSPG4 de diferentes formatos, que foram transduzidos de forma viral em células T, resultaram numa forte citotoxicidade das células T in vitro . Em modelos animais, as células T transferidas adotivamente reagiram a vários tumores que expressam CSPG4, como o melanoma, o cancro da mama, o mesotelioma, o glioblastoma e o osteossarcoma [47–50,62–71]. Geldres et al. transduziram retroviralmente um CAR específico para CSPG4 de segunda geração em células T. In vitro, estas células T CAR específicas de CSPG4 foram capazes de reconhecer e lisar células de melanoma de uma forma específica para o antigénio [65]. Além disso, a ligação do antigénio ao CAR levou a uma secreção pronunciada de IL-2 e IFNγ. In vivo , a transferência de células CAR-T específicas de CSPG4 para ratinhos portadores de células de melanoma levou a um abrandamento significativo do crescimento do tumor e a uma melhoria da sobrevivência global dos ratinhos [65]. Na mesma publicação, foi descrita a ausência de reatividade positiva das células CAR-T específicas de CSPG4 a tecido normal com ARN de CSPG4 detetável mas sem expressão da proteína CSPG4 [65]. Conseguiram demonstrar que as células CAR-T específicas de CSPG4 não exerciam uma citotoxicidade significativa contra linhas celulares epiteliais primárias da próstata, do pulmão e do rim [65]. Por conseguinte, as análises de expressão efectuadas por Beard et al. [63,85] atenuam as preocupações acima descritas relativamente àtoxicidade no alvo/fora do tumor induzida pelas células CAR-T específicas de CSPG4, uma vez que a expressão de CSPG4 a nível proteico é necessária para induzir uma reatividade indesejada das células CAR-T.
Até agora, utilizámos o método de transfecção de ARNm por electroporação para introduzir CARs nas células T. Neste contexto, já testámos vários CAR específicos para a CSPG4 e observámos que as células CAR-T transfectadas com mRNA são capazes de eliminar as células tumorais de uma forma específica para o antigénio. A cinética de expressão dos CAR transferidos por electroporação depende da espinha dorsal do CAR [47]. Foi identificado um CAR que apresenta uma elevada expressão nas células T e uma elevada reatividade anti-células tumorais. Este CAR contém um scFv baseado no clone de anticorpo 9.2.27 ligado a um espaçador Fc, um domínio transmembranar e intracelular CD28 e um domínio de sinalização CD3ζ [47](Fig. 3). Experiências in vivo com ratinhos imunodeficientes Rag-/-/common γ-chain-/- mostraram que as células CAR-T específicas de CSPG4 transfectadas prolongaram significativamente o tempo médio de sobrevivência dos ratinhos [47].
A fim de transferir as células CAR-T específicas de CSPG4 para a aplicação clínica, a produção de células CAR-T à escala clínica foi estabelecida em laboratório por transfecção de mRNA de um CAR em total conformidade com as BPF [50]. Isto demonstrou que é possível a produção repetida de um número suficiente de células T altamente puras, específicas de CSPG4, transfectadas com CAR. Estas células T modificadas apresentam uma eficiência de transfecção muito elevada, uma elevada expressão de CAR e uma elevada eficácia na destruição das células alvo do melanoma [50].
Embora o CSPG4 seja um antigénio alvo tumoral primário, particularmente no melanoma cutâneo, também descobrimos que não era expresso em várias linhas celulares de melanoma uveal que testámos. Por conseguinte, estabelecemos uma plataformacombinada in silico/in vitropara identificar novos antigénios de superfície celular específicos de tumores de melanomas uveais. Utilizando esta plataforma, identificámos uma proteína candidata como um antigénio alvo adequado no melanoma uveal para o desenvolvimento de outros CAR. Os CARs gerados que podem ligar-se a esta proteína candidata estão atualmente a ser testados quanto à sua funcionalidade e especificidade.
Perspectivas
A utilização de células CAR-T no tratamento de tumores sólidos tem um grande potencial. São necessários mais estudos pré-clínicos e ensaios clínicos para responder à elevada necessidade médica de tratamento de entidades cancerígenas sólidas (como o melanoma uveal).
Os futuros ensaios clínicos devem centrar-se no teste de novos formatos de CAR. Para além de testar novos domínios extracelulares de ligação a antigénios e novos domínios de sinalização intracelular [109], isto inclui também testar formatos que aumentem a segurança da utilização das células CAR-T [108]. Além disso, novos veículos celulares para transferência de CAR [109,110] prometem alargar o leque de aplicações. Por exemplo, a possibilidade de utilizar células CAR-NK [111] ou células CAR-T alogénicas [112] como padrão pode reduzir os custos da terapia com células CAR e, assim, tornar a terapia acessível a mais doentes.
Além disso, devem ser encontrados mais antigénios específicos do tumor, a fim de evitar reacções no alvo/fora do tumor. Os antigénios que são expressos no estroma tumoral e que podem ser aí atacados pelas células CAR-T são muito promissores nesta área [113]. A orientação de múltiplos antigénios por uma célula CAR-T (ou seja, a expressão de diferentes CAR específicos para diferentes antigénios numa única célula) pode aumentar a especificidade do tumor e reduzir o risco de efeitos fora do alvo. Isto também se aplica ao modelo em que os módulos de sinalização intracelular são divididos entre os diferentes CAR, a fim de aumentar o perfil de segurança das células CAR-T. Isto também torna menos provável o desenvolvimento de variantes de perda de antigénio dos tumores.
Além disso, já estão a ser testadas clinicamente em muitos tumores hematológicos terapias combinadas de células CAR-T com várias pequenas moléculas ou anticorpos monoclonais para impedir os mecanismos de escape dos tumores e aumentar a atividade antitumoral (ver síntese pormenorizada em [114,115]). Estas combinações são igualmente prometedoras para o tratamento de tumores sólidos e devem ser testadas em ensaios clínicos num futuro próximo.
N.S. realizou a pesquisa no clinicaltrials.gov, reviu as figuras e redigiu o manuscrito. S.H. editou o manuscrito. N.S. e S.H. redigiram conjuntamente as perguntas da formação CME.
Literatura:
- Gross G, Gorochov G, Waks T, Eshhar Z: Generation of effector T cells expressing chimeric T cell recetor with antibody type-specificity. Transplant Proc 1989; 21(1 Pt 1): 127-130.
- Gross G, Waks T, Eshhar Z: Expressão de moléculas quiméricas de receptores de imunoglobulina de células T como receptores funcionais com especificidade do tipo anticorpo. Proc Natl Acad Sci U S A. 1989; 86(24): 10024-10028.
- June CH, Sadelain M: Chimeric Antigen Recetor Therapy (Terapia do Recetor de Antigénio Quimérico). N Engl J Med 2018; 379(1): 64-73.
- Maude SL, Laetsch TW, Buechner J, et al: Tisagenlecleucel em Crianças e Jovens Adultos com Leucemia Linfoblástica de Células B. N Engl J Med 2018; 378(5): 439-448.
- Neelapu SS, Locke FL, Go WY: Terapia com células T CAR no linfoma de grandes células B. N Engl J Med 2018; 378(11): 1065.
- Schuster SJ, Bishop MR, Tam CS, et al: Tisagenlecleucel no Linfoma Difuso de Grandes Células B em Adultos Recaídos ou Refractários. N Engl J Med 2019; 380(1): 45-56.
- Wang Z, Guo Y, Han W: Situação atual e perspectivas das células T modificadas por receptores de antigénios quiméricos para o tratamento do cancro. Protein Cell 2017; 8(12): 896-925.
- Han S, Latchoumanin O, Wu G, et al: Ensaios clínicos recentes que utilizam terapias com células T de recetor de antigénio quimérico contra tumores sólidos. Cancer Lett 2017; 390: 188-200.
- Yeku O, Li X, Brentjens RJ: Adoptive T-Cell Therapy for Solid Tumours. Am Soc Clin Oncol Educ Book 2017; 37: 193-204.
- Arabi F, Torabi-Rahvar M, Shariati A, et al: Alvos antigénicos da terapia com células T CAR. Uma visão retrospetiva dos ensaios clínicos. Exp Cell Res 2018; 369(1): 1-10.
- Schaft N: The Landscape of CAR-T Cell Clinical Trials against Solid Tumours-A Comprehensive Overview (O panorama dos ensaios clínicos com células CAR-T contra tumores sólidos – uma visão global). Cancros (Basileia) 2020; 12(9).
- Holzinger A, Abken H: CAR T Cells: A Snapshot on the Growing Options to Design a CAR. Hemasphere 2019; 3(1): e172.
- Boomer JS, Green JM: Uma cauda enigmática da sinalização CD28. Cold Spring Harb Perspect Biol 2010; 2(8): a002436.
- Kawalekar OU, O’Connor RS, Fraietta JA, et al: A sinalização distinta dos coreceptores regula as vias específicas do metabolismo e tem impacto no desenvolvimento da memória nas células T CAR. Immunity 2016; 44(2): 380-390.
- Cannons JL, Choi Y, Watts TH: Role of TNF recetor-associated fator 2 and p38 mitogen-activated protein kinase activation during 4-1BB-dependent immune response. J Immunol 2000; 165(11): 6193-6204.
- Lee HW, Nam KO, Park SJ, Kwon BS: 4-1BB aumenta a expansão das células T CD8+ regulando a progressão do ciclo celular através de alterações na expressão das ciclinas D e E e do inibidor da quinase dependente de ciclina p27kip1. Eur J Immunol 2003; 33(8): 2133-2141.
- Zhao Z, Condomines M, van der Stegen SJC, et al: O desenho estrutural da costimulação projectada determina a cinética de rejeição do tumor e a persistência das células T CAR. Cancer Cell 2015; 28(4): 415-428.
- Milone MC, Fish JD, Carpenito C, et al: Os receptores quiméricos que contêm domínios de transdução de sinal CD137 medeiam uma maior sobrevivência das células T e uma maior eficácia antileucémica in vivo. Mol Ther 2009; 17(8): 1453-1464.
- Lim WA, June CH: Os princípios da engenharia das células imunitárias para tratar o cancro. Cell 2017; 168(4): 724-740.
- Roselli E, Frieling JS, Thorner K, et al: Engenharia CAR-T: Otimização da transdução de sinais e dos mecanismos efectores. BioDrugs 2019; 33(6): 647-659.
- Hombach AA, Holzinger A, Abken H.: O bem e o mal da costimulação na terapia adotiva do câncer com células T redirecionadas para o recetor de antígeno quimérico (CAR). Curr Mol Med 2013; 13(7): 1079-1088.
- Sadelain M, Brentjens R, Riviere I: Os princípios básicos da conceção de receptores de antigénios quiméricos. Cancer Discov 2013; 3(4): 388-398.
- Redeker A, Arens R: Improving Adoptive T Cell Therapy: The Particular Role of T Cell Costimulation, Cytokines, and Post-Transfer Vaccination (Melhorar a terapia com células T adoptivas: o papel particular da co-estimulação das células T, das citocinas e da vacinação pós-transferência). Front Immunol 2016; 7: 345.
- Weinkove R, George P, Dasyam N, McLellan AD: Seleção de domínios coestimulatórios para receptores de antigénios quiméricos: considerações funcionais e clínicas. Clin Transl Immunology 2019; 8(5): e1049.
- Ceppi F, Rivers J, Annesley C, et al: Aférese de linfócitos para fabrico de células T com recetor de antigénio quimérico em crianças e jovens adultos com leucemia e neuroblastoma. Transfusão 2018; 58(6): 1414-1420.
- Li W, Guo L, Rathi P, et al: Redirecionar as células T para Glypican-3 com receptores de antigénio quimérico 4-1BB Zeta resulta em polarização Th1 e atividade antitumoral potente. Hum Gene Ther 2017; 28(5): 437-448.
- Chmielewski M, Hombach AA, Abken H: Of CARs and TRUCKs: chimeric antigen recetor (CAR) T cells engineered with an inducible cytokine to modulate the tumour stroma. Immunol Rev 2014; 257(1): 83-90.
- Chmielewski M, Kopecky C, Hombach AA, Abken H.: A libertação de IL-12 por células T modificadas que exprimem receptores de antigénios quiméricos pode modelar eficazmente uma resposta de macrófagos independente de antigénios em células tumorais que tenham desligado a expressão de antigénios tumorais. Cancer Res 2011; 71(17): 5697-5706.
- Pegram HJ, Lee JC, Hayman EG, et al: Tumour-targeted T cells modified to secrete IL-12 eradicate systemic tumours without need for prior conditioning. Blood 2012; 119(18): 4133-4141.
- Koneru M, Purdon TJ, Spriggs D, et al: Células T de recetor de antigénio quimérico secretoras de IL-12 que visam tumores erradicam tumores ovarianos in vivo. Oncoimmunology 2015; 4(3): e994446.
- Koneru M, O’Cearbhaill R, Pendharkar S, Spriggs DR, Brentjens RJ: Um ensaio clínico de fase I de terapia com células T adotivas usando receptores de antígenos quiméricos secretores de IL-12 MUC-16 (ecto) direcionados para câncer de ovário recorrente. J Transl Med 2015; 13: 102.
- Xu A, Bhanumathy KK, Wu J, et al: A sinalização IL-15 promove a sobrevivência de células T efectoras adoptivas e a formação de memória na linfopenia induzida por irradiação. Cell Biosci 2016; 6: 30.
- Lamers CH, Willemsen R, van Elzakker P, et al: Respostas imunitárias ao transgene e ao vetor retroviral em doentes tratados com células T criadas ex vivo. Blood 2011; 117(1): 72-82.
- Magnani CF, Tettamanti S, Alberti G, et al: Transposon-Based CAR T Cells in Acute Leukaemias: Where are We Going? Células 2020; 9(6).
- Hudecek M, Ivics Z: Engenharia de células terapêuticas não virais com o sistema de transposão Sleeping Beauty. Curr Opin Genet Dev 2018; 52: 100-108.
- Tipanee J, VandenDriessche T, Chuah MK: Transposões: Avançando de estudos pré-clínicos para ensaios clínicos. Hum Gene Ther 2017; 28(11): 1087-1104.
- Vargas JE, Chicaybam L, Stein RT, et al: Vectores retrovirais e transposons para terapia genética estável: avanços, desafios actuais e perspectivas. J Transl Med 2016; 14(1): 288.
- Ran FA, Hsu PD, Wright J, et al: Engenharia do genoma utilizando o sistema CRISPR-Cas9. Nat Protoc 2013; 8(11): 2281-2308.
- Birkholz K, Hombach A, Krug C, et al.: A transferência de mRNA que codifica imunorreceptores recombinantes reprograma as células T CD4+ e CD8+ para utilização na imunoterapia adotiva do cancro. Gene Ther 2009; 16(5): 596-604.
- Lamers CH, Sleijfer S, et al: Tratamento do carcinoma de células renais metastático com células T de engenharia CAIX CAR: avaliação clínica e gestão da toxicidade no alvo. Mol Ther 2013; 21(4): 904-912.
- Morgan RA, Yang JC, Kitano M, et al: Relato de caso de um evento adverso grave após a administração de células T transduzidas com um recetor de antigénio quimérico que reconhece ERBB2. Mol Ther 2010; 18(4): 843-851.
- Stavrou M, Philip B, Traynor-White C, et al: Um gene de suicídio baseado em caspase 9 ativado por rapamicina. Mol Ther 2018; 26(5): 1266-1276.
- Di Stasi A, Tey SK, Dotti G, et al: Inducible apoptosis as a safety switch for adoptive cell therapy. N Engl J Med 2011; 365(18): 1673-1683.
- Moolten FL.: Quimiossensibilidade tumoral conferida por genes de herpes timidina quinase inseridos: paradigma para uma estratégia prospetiva de controlo do cancro. Cancer Res 1986; 46(10): 5276-5281.
- Beltinger C, Fulda S, Kammertoens T, et al: Herpes simplex virus thymidine kinase/ganciclovir-induced apoptosis involves ligand-independent death recetor aggregation and activation of caspases. Proc Natl Acad Sci U S A 1999; 96(15): 8699-8704.
- Harrer DC, Simon B, Fujii SI, et al: Transfecção por RNA de células T gama/delta com um recetor de antigénio quimérico ou um recetor de células T alfa/beta: uma alternativa mais segura às células T alfa/beta geneticamente modificadas para a imunoterapia do melanoma. BMC Cancer 2017; 17(1): 551.
- Krug C, Birkholz K, Paulus A, et al: A estabilidade e a atividade dos receptores de antigénio quiméricos específicos de MCSP (CARs) dependem do domínio de ligação ao antigénio scFv e da espinha dorsal da proteína. Cancer Immunol Immunother 2015; 64(12): 1623-1635.
- Dörrie J, Babalija L, Hoyer S, et al: Inibidores de BRAF e MEK influenciam a função das células T reprogramadas: consequências para a terapia adotiva com células T. Int J Mol Sci 2018; 19(1).
- Harrer DC, Schuler G, Dörrie J, Schaft N: CSPG4-Specific CAR T Cells for High-Risk Childhood B Cell Precursor Leukaemia. Int J Mol Sci 2019; 20(11).
- Wiesinger M, Marz J, Kummer M, et al: Produção em escala clínica de células CAR-T para o tratamento de pacientes com melanoma por transfecção de mRNA de um CAR específico para CSPG4 em total conformidade com GMP. Cancros (Basileia) 2019; 11(8).
- Shi J, Ma Y, Zhu J, et al: Uma revisão sobre a entrega intracelular baseada em eletroporação. Moléculas 2018; 23(11).
- Ernst M, Oeser A, Besiroglu B, et al: Terapia com células T de recetor de antigénio quimérico (CAR) para pessoas com linfoma difuso de grandes células B recidivante ou refratário. Cochrane Database Syst Rev 2021; 9(9): Cd013365.
- Pinc A, Somasundaram R, Wagner C, et al: Direcionamento do CD20 em doentes com melanoma com elevado risco de recorrência da doença. Mol Ther 2012; 20(5): 1056-1062.
- Schmidt P, Kopecky C, Hombach A, et al.: Eradication of melanomas by targeted elimination of a minor subset of tumor cells. Proc Natl Acad Sci U S A 2011; 108(6): 2474–2479.
- Brignole C, Marimpietri D, Pagnan G, et al: Atuação contra o neuroblastoma através de oligonucleótidos anti-sentido selectivos para c-myb, envolvidos em imunolipossomas anti-GD2: actividades antitumorais mediadas por células imunitárias. Cancer Lett 2005; 228(1-2): 181-186.
- Mitri Z, Constantine T, O’Regan R: The HER2 Recetor in Breast Cancer: Pathophysiology, Clinical Use, and New Advances in Therapy (O Recetor HER2 no Cancro da Mama: Fisiopatologia, Utilização Clínica e Novos Avanços na Terapia). Chemother Res Pract 2012; 2012: 743193.
- Slamon DJ, Godolphin W, Jones LA, et al: Studies of the HER-2/neu proto-oncogene in human breast and ovarian cancer. Science 1989; 244(4905): 707-712.
- Zhang JG, Kruse CA, Driggers L, et al: Tumour antigen precursor protein profiles of adult and pediatric brain tumors identify potential targets for immunotherapy. J Neurooncol 2008; 88(1): 65-76.
- Casucci M, Hawkins RE, Dotti G, Bondanza A: Overcoming the toxicity hurdles of genetically targeted T cells. Cancer Immunol Immunother 2015; 64(1): 123-130.
- Morgan RA, Yang JC, Kitano M, et al: Relato de caso de um evento adverso grave após a administração de células T transduzidas com um recetor de antigénio quimérico que reconhece ERBB2. Mol Ther 2010; 18(4): 843-851.
- Slamon DJ, Leyland-Jones B, Shak S, et al: Utilização de quimioterapia e de um anticorpo monoclonal contra HER2 para o cancro da mama metastático que sobreexpressa HER2. N Engl J Med 2001; 344(11): 783-792.
- Wang Y, Geldres C, Ferrone S, Dotti G: Chondroitin sulfate proteoglycan 4 as a target for chimeric antigen recetor-based T-cell immunotherapy of solid tumours. Expert Opin Ther Targets 2015; 19(10): 1339-1350.
- Beard RE, Zheng Z, Lagisetty KH, et al: Múltiplos receptores de antigénio quiméricos visam com sucesso o proteoglicano de sulfato de condroitina 4 em várias histologias de cancro diferentes e células estaminais cancerígenas. J Immunother Cancer 2014; 2: 25.
- Pellegatta S, Savoldo B, Di IN, et al: Expressão constitutiva e induzida por TNFalfa do proteoglicano de sulfato de condroitina 4 em glioblastoma e neuroesferas: Implicações para a terapia com células CAR-T. Sci Transl Med 2018; 10(430).
- Geldres C, Savoldo B, Hoyos V, et al: Os linfócitos T redireccionados contra o proteoglicano-4 de sulfato de condroitina controlam o crescimento de múltiplos tumores sólidos tanto in vitro como in vivo. Clin Cancer Res 2014; 20(4): 962-971.
- Abken H, Hombach A, Heuser C, Reinhold U.: Uma nova estratégia para a eliminação de células de melanoma disseminadas: os receptores quiméricos conferem às células T especificidade tumoral. Recent Results Cancer Res 2001; 158: 249-264.
- Burns WR, Zhao Y, Frankel TL, et al: Um recetor de antigénio quimérico específico para o antigénio associado ao melanoma de elevado peso molecular redirecciona os linfócitos para o alvo dos melanomas humanos. Cancer Res 2010; 70(8): 3027-3033.
- Losch FO, Muller R, Mutschler B, et al: Ativação de células T através de receptores quiméricos específicos de antigénios tumorais: o papel do domínio de sinalização intracelular. Int J Cancer 2003; 103(3): 399-407.
- Reinhold U, Liu L, Ludtke-Handjery HC, et al: A lise específica de células de melanoma por células T enxertadas no recetor é reforçada por anticorpos monoclonais anti-idiotípicos dirigidos ao domínio scFv do recetor. J Invest Dermatol 1999; 112(5): 744-750.
- Schmidt P, Kopecky C, Hombach A, et al: Erradicação de melanomas através da eliminação selectiva de um subconjunto menor de células tumorais. Proc Natl Acad Sci U S A 2011; 108(6): 2474-2479.
- Harrer D, Simon B, Fujii SI, et al: Transfecção de RNA de células T γ / δ com um recetor de antígeno quimérico ou um recetor de células T α / β: uma alternativa mais segura para células T α / β geneticamente modificadas para a imunoterapia do melanoma. BMC Cancer 2017; 17: 551.
- Bumol TF, Reisfeld RA: Complexo único de glicoproteína-proteoglicano definido por anticorpo monoclonal em células de melanoma humano. Proc Natl Acad Sci USA 1982; 79(4): 1245-1249.
- Ilieva KM, Cheung A, Mele S, et al: Proteoglicano de sulfato de condroitina 4 e seu potencial como alvo de imunoterapia de anticorpos em diferentes tipos de tumores. Front Immunol 2017; 8: 1911.
- Schiffer D, Mellai M, Boldorini R, et al: O significado do proteoglicano de sulfato de condroitina 4 (CSPG4) em gliomas humanos. Int J Mol Sci 2018; 19(9).
- Van Sinderen M, Cuman C, Winship A, et al: O proteoglicano de sulfato de condroitina (CSPG4) regula a função do trofoblasto humano. Placenta 2013; 34(10): 907-912.
- Fukushi J, Makagiansar IT, Stallcup WB: O proteoglicano NG2 promove a motilidade das células endoteliais e a angiogénese através do envolvimento da galectina-3 e da integrina alfa3beta1. Mol Biol Cell 2004; 15(8): 3580-3590.
- Sakry D, Neitz A, Singh J, et al: As células precursoras de oligodendrócitos modulam a rede neuronal através da clivagem do ectodomínio dependente da atividade da glia NG2. PLoS Biol 2014; 12(11): e1001993.
- Legg J, Jensen UB, Broad S, et al: Role of melanoma chondroitin sulphate proteoglycan in patterning stem cells in human interfollicular epidermis. Development 2003; 130(24): 6049-6063.
- Ferrone S, Chen ZJ, Liu CC, et al: Mimetização de antigénios humanos de elevado peso molecular associados ao melanoma por anticorpos monoclonais anti-idiotípicos de ratinho MK2-23. Estudos experimentais e ensaios clínicos em doentes com melanoma maligno. Pharmacol Ther 1993; 57(2-3): 259-290.
- Schlingemann RO, Rietveld FJ, de Waal RM, et al: Expression of the high molecular weight melanoma-associated antigen by pericytes during angiogenesis in tumours and in healing wounds. Am J Pathol 1990; 136(6): 1393-1405.
- Midwood KS, Salter DM: Expressão do proteoglicano NG2/melanoma humano em condrócitos articulares humanos adultos. Osteoarthritis Cartilage 1998; 6(5): 297-305.
- Tordsson JM, Ohlsson LG, Abrahmsen LB, et al: Anticorpos de primatas seleccionados por fagos fundidos com superantigénios para imunoterapia de melanoma maligno. Cancer Immunol Immunother 2000; 48(12): 691-702.
- Petrini S, Tessa A, Carrozzo R, et al: Human melanoma/NG2 chondroitin sulphate proteoglycan is expressed in the sarcolemma of postnatal human skeletal myofibers. Expressão anormal nas distrofias musculares merosina-negativa e de Duchenne. Mol Cell Neurosci 2003; 23(2): 219-231.
- Campoli MR, Chang CC, Kageshita T, et al: Antigénio humano associado ao melanoma de elevado peso molecular (HMW-MAA): um proteoglicano de sulfato de condroitina (MSCP) de superfície das células do melanoma com significado biológico e clínico. Crit Rev Immunol 2004; 24(4): 267-296.
- Beard RE, Abate-Daga D, Rosati SF, et al: Perfil de expressão génica utilizando a contagem digital de RNA de nanoestruturas para identificar potenciais antigénios alvo para a imunoterapia do melanoma. Clin Cancer Res 2013; 19(18): 4941-4950.
- Erfurt C, Sun Z, Haendle I, et al: Tumour-reactive CD4+ T cell responses to the melanoma-associated chondroitin sulphate proteoglycan in melanoma patients and healthy individuals in the absence of autoimmunity. J Immunol 2007; 178(12): 7703-7709.
- Natali PG, Giacomini P, Russo C, et al: Perfil antigénico de células de melanoma humano. Análise com anticorpos monoclonais para antigénios de histocompatibilidade e para antigénios associados ao melanoma. J Cutan Pathol 1983; 10(4): 225-237.
- Berd D, Herlyn M, Koprowski H, Mastrangelo MJ: Determinação citométrica de fluxo da frequência e heterogeneidade da expressão de antigénios associados ao melanoma humano. Cancer Res 1989; 49(23): 6840-6844.
- Morgan AC Jr, Galloway DR, Reisfeld RA: Produção e caraterização de um anticorpo monoclonal contra uma glicoproteína específica de melanoma. Hybridoma 1981; 1(1): 27-36.
- Morgan AC Jr, Woodhouse C, Bartholemew R, Schroff R: Antigénios associados ao melanoma humano: análise da heterogeneidade antigénica por abordagens moleculares, serológicas e de citometria de fluxo. Mol Immunol 1986; 23(2): 193-200.
- Li Y, Madigan MC, Lai K, et al: Human uveal melanoma expresses NG2 immunoreactivity. Br J Ophthalmol 2003; 87(5): 629-632.
- Li Y, Wang J, Rizvi SM, Jager MJ, et al: A identificação in vitro do antigénio NG2 pelo imunoconjugado 213Bi-9.2.27 alfa induz citotoxicidade em células de melanoma uveal humano. Invest Ophthalmol Vis Sci 2005; 46(12): 4365-4371.
- Chekenya M, Rooprai HK, Davies D, et al: The NG2 chondroitin sulfate proteoglycan: role in malignant progression of human brain tumours. Int J Dev Neurosci 1999; 17(5-6): 421-435.
- Godal A, Bruland O, Haug E, et al: Expressão inesperada do antigénio associado ao melanoma de 250 kD em células de sarcoma humano. Br J Cancer 1986; 53(6): 839-841.
- Shoshan Y, Nishiyama A, Chang A, et al: Expressão de antigénios de células progenitoras de oligodendrócitos por gliomas: implicações para a histogénese de tumores cerebrais. Proc Natl Acad Sci U S A 1999; 96(18): 10361-10366.
- Yadavilli S, Hwang EI, Packer RJ, Nazarian J: The Role of NG2 Proteoglycan in Glioma. Transl Oncol 2016; 9(1): 57-63.
- Behm FG, Smith FO, Raimondi SC, et al.: Human homologue of the rat chondroitin sulfate proteoglycan, NG2, detected by monoclonal antibody 7.1, identifies childhood acute lymphoblastic leukemias with t(4;11)(q21;q23) or t(11;19)(q23;p13) and MLL gene rearrangements. Blood 1996; 87(3): 1134–1139.
- Hilden JM, Smith FO, Frestedt JL, et al: Rearranjo do gene MLL, anomalias citogenéticas 11q23 e expressão da molécula NG2 na leucemia mieloide aguda infantil. Sangue 1997; 89(10): 3801-3805.
- Schwartz S, Rieder H, Schlager B, et al: Expressão do homólogo humano do NG2 do rato na leucemia linfoblástica aguda do adulto: associação estreita com o rearranjo MLL e um fenótipo de células B CD10(-)/CD24(-)/CD65s(+)/CD15(+). Leucemia 2003; 17(8): 1589-1595.
- Smith FO, Rauch C, Williams DE, et al: O homólogo humano do NG2 do rato, um proteoglicano de sulfato de condroitina, não é expresso na superfície celular de células hematopoiéticas normais, mas é expresso por blastos de leucemia mieloide aguda de doentes com mau prognóstico e com anomalias na banda cromossómica 11q23. Blood 1996; 87(3): 1123-1133.
- Wuchter C, Harbott J, Schoch C, et al: Deteção de células de leucemia aguda com rearranjos do gene da leucemia de linhagem mista (MLL) por citometria de fluxo utilizando o anticorpo monoclonal 7.1. Leukemia 2000; 14(7): 1232-1238.
- Wang X, Osada T, Wang Y, et al: A proteína CSPG4 como um novo alvo para a imunoterapia baseada em anticorpos do cancro da mama triplo-negativo. J Natl Cancer Inst 2010; 102(19): 1496-1512.
- Nicolosi PA, Dallatomasina A, Perris R: Theranostic impact of NG2/CSPG4 proteoglycan in cancer (Impacto terapêutico do proteoglicano NG2/CSPG4 no cancro). Theranostics 2015; 5(5): 530-544.
- de Vries JE, Keizer GD, te Velde AA, et al: Characterisation of melanoma-associated surface antigens involved in the adhesion and motility of human melanoma cells. Int J Cancer 1986; 38(4): 465-473.
- Ozerdem U: Targeting pericytes diminishes neovascularisation in orthotopic uveal melanoma in nerve/glial antigen 2 proteoglycan knockout mouse. Ophthalmic Res 2006; 38(5): 251-254.
- Ozerdem U: Targeting of pericytes diminishes neovascularisation and lymphangiogenesis in prostate cancer. Prostate 2006; 66(3): 294-304.
- Ampofo E, Schmitt BM, Menger MD, Laschke MW: Os mecanismos reguladores da expressão de NG2/CSPG4. Cell Mol Biol Lett 2017; 22: 4.
- Stoiber S, Cadilha BL, Benmebarek MR, et al: Limitações no Desenho de Receptores de Antigénio Quiméricos para a Terapia do Cancro. Cells 2019; 8(5).
- Sievers NM, Dörrie J, Schaft N: CARs: Beyond T Cells and T Cell-Derived Signalling Domains (CARs: Para além das células T e dos domínios de sinalização derivados das células T). Int J Mol Sci 2020; 21(10).
- Harrer DC, Dörrie J, Schaft N: Receptores de Antigénios Quiméricos em Diferentes Tipos de Células: Novos veículos juntam-se à corrida. Hum Gene Ther 2018; 29(5): 547-558.
- Montagner IM, Penna A, Fracasso G, et al: Anti-PSMA CAR-engineered NK-92 Cells: An Off-the-shelf Cell Therapy for Prostate Cancer. Células 2020; 9(6).
- Van Cutsem E, Machiels J, Van den Eynde M, et al: SO-009 – Estudos de fase 1 que avaliam a segurança e a atividade clínica da terapia CAR-T autóloga e alogénica baseada em NKG2D no cancro colorrectal metastático. Annals of Oncology 2019; 30: iv124-iv125.
- Santoro SP, Kim S, Motz GT, et al: As células T portadoras de um recetor de antigénio quimérico contra o antigénio de membrana específico da próstata medeiam a rutura vascular e resultam na regressão do tumor. Cancer Immunol Res 2015; 3(1): 68-84.
- Bansal R, Reshef R: Revving the CAR – Combination strategies to enhance CAR T cell effectiveness (Reforçar o CAR – Estratégias de combinação para aumentar a eficácia das células T CAR). Blood Reviews 2020: 100695.
- Harrer DC, Dorrie J, Schaft N: CARs and Drugs: Pharmacological Ways of Boosting CAR-T-Cell Therapy (CARs e Fármacos: Formas Farmacológicas de Reforçar a Terapia com Células CAR-T). Int J Mol Sci 2023; 24(3).
InFo ONKOLOGIE & HÄMATOLOGIE 2024; 12(1): 6–13