A anemia aplástica está associada à hipocelularidade da medula óssea e à pancitopenia. A adição de um agonista oral do recetor da trombopoietina à terapêutica imunossupressora padrão demonstrou ser benéfica em doentes com anemia aplástica imunomediada grave ou muito grave para os quais o transplante de medula óssea não é uma opção.
Na anemia aplástica, há uma falta total de eritrócitos, leucócitos e trombócitos devido à insuficiência da medula óssea. Isto resulta numa medula óssea hipo ou aplástica, uma vez que as células estaminais hematopoiéticas CD34-positivas são deslocadas pela medula gorda. Dependendo da causa, existem diferentes mecanismos fisiopatológicos subjacentes, explicou o Dr. Neal S. Young do National Heart, Lung and Blood Institute of the National Institutes of Health, Bethesda (EUA), na Reunião Anual da Associação Europeia de Hematologia (EHA) [1]. Os três patomecanismos mais importantes são
- Danos químicos ou físicos, por exemplo, através de quimioterapia ou radioterapia
- Defeito constitucional em genes que são importantes para a manutenção da integridade celular e regulação imunitária
- danos imunomediados nas células hematopoiéticas.
Esta última ocorre mais frequentemente e é também designada por “anemia aplástica idiopática”. Pensa-se que se trata de uma reação autoimune causada por linfócitos T activados contra células estaminais e progenitoras hematopoiéticas. O hemograma revela uma anemia normocítica (VCM normal) com reticulocitopenia, trombocitopenia acentuada e leucopenia com neutropenia. O aspirado da medula óssea contém poucos ou nenhuns precursores e a biopsia da medula óssea caracteriza-se por uma grande redução da celularidade com proliferação de medula gorda. O quadro clínico caracteriza-se por anemia (palidez, fadiga), neutropenia (infeção) e trombocitopenia (hemorragia) [2].
Opções de tratamento em resumo
O transplante de células estaminais hematopoiéticas é uma opção de tratamento potencialmente curativa. Este é o tratamento de eleição, sobretudo para os doentes mais jovens com um dador adequado. Por esta razão, os irmãos são analisados quanto à compatibilidade do antigénio leucocitário humano assim que o diagnóstico é feito.
Para os doentes que não são adequados para um transplante ou que não têm um dador, o tratamento imunossupressor com globulina antitimócito equino (ATG) em combinação com ciclosporina está disponível como alternativa. Esta opção de tratamento é eficaz na maioria dos doentes, mas não em todos, segundo o Dr. Young [1]. Cerca de dois terços dos doentes respondem-lhe [3]. Durante muitos anos, vários métodos foram tentados, sem sucesso, para melhorar os resultados do tratamento imunossupressor padrão (TSI). Finalmente, foi alcançado um avanço quando um estudo aberto e não aleatório de fase I/II demonstrou que a adição de Eltrombopag a ATG mais ciclosporina resultou em taxas de resposta consideráveis em doentes sem tratamento com anemia aplástica grave ou muito grave [4].
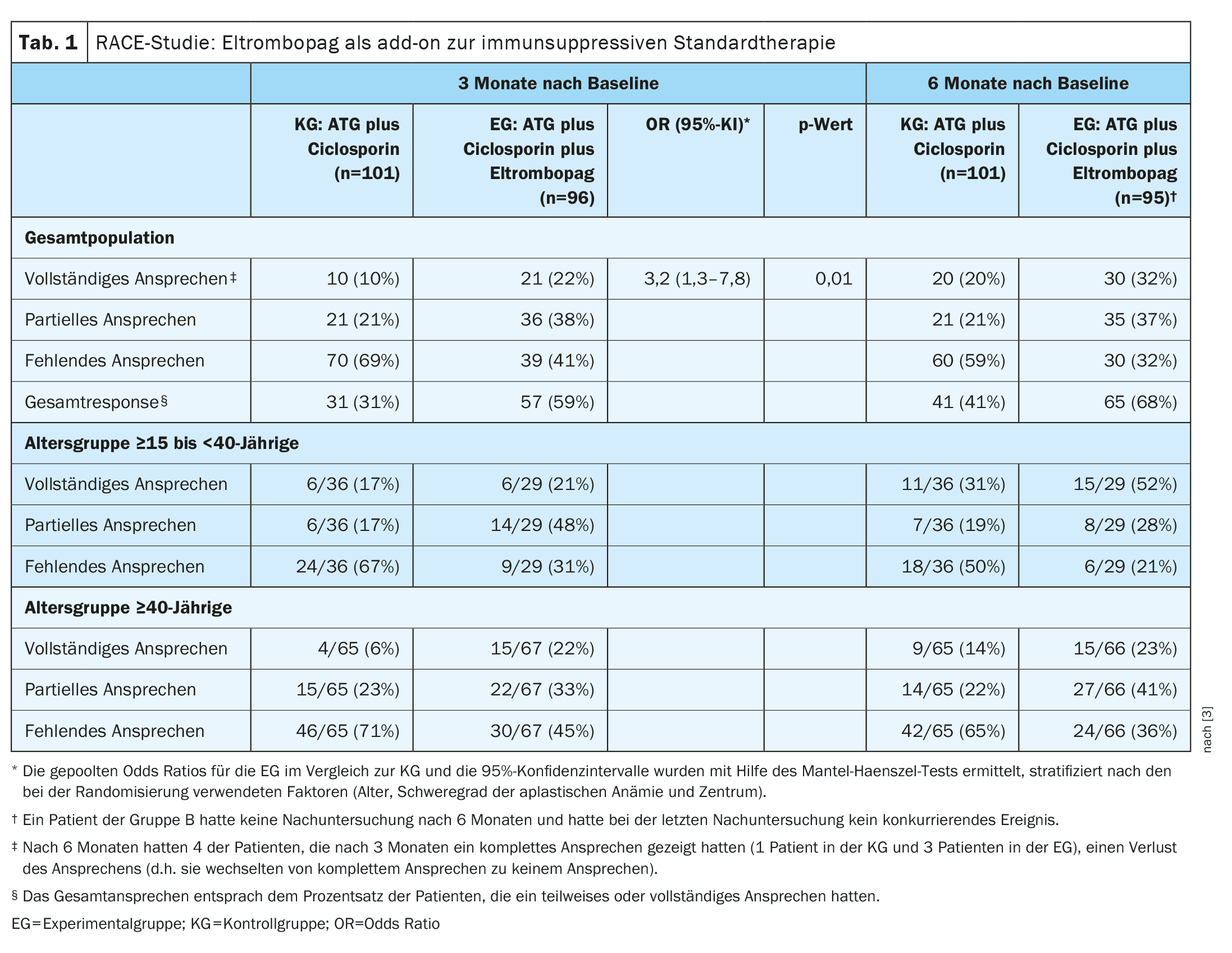
| O endpoint primário do estudo foi uma resposta hematológica completa após três meses, definida como um nível de hemoglobina superior a 10 g por dl, uma contagem absoluta de neutrófilos superior a 1000 por mm3 e uma contagem de plaquetas de 100 000 por mm3 em doentes que não tinham recebido transfusões. Os critérios para uma resposta parcial foram a independência de transfusões (tanto de glóbulos vermelhos como de plaquetas), com um grupo sanguíneo que não satisfazia os critérios para anemia aplástica grave, mas que era insuficiente para uma resposta completa. |
O eltrombopag estimula a hematopoiese a nível das células estaminais
Este agonista oral do recetor da trombopoietina tem um efeito no controlo da formação de células estaminais hematopoiéticas e de plaquetas. O medicamento ativa a trombopoietina, que controla a formação de trombócitos e de sangue (hematopoiese). No estudo aleatório controlado de fase III RACE (Randomized, Multicenter Trial Comparing Horse ATG plus Cyclosporine with or without Eltrombopag as First-Line), a TSI isolada (ATG mais Ciclosporina) foi comparada com a TSI mais Eltrombopag como terapêutica de primeira linha em doentes com anemia aplástica grave ou muito grave [3]. O tempo médio para a primeira resposta e para a resposta completa foi mais curto no braço do estudo com TSI mais eltrombopag (grupo experimental, GE) em comparação com o braço do estudo em que foi prescrita apenas TSI (grupo de controlo, KG). Estes tempos de resposta mais curtos explicam porque é que o GE era anteriormente independente de transfusões de glóbulos vermelhos e plaquetas.
- Os doentes do KG receberam TSI que consistiu em ATG (40 mg por kg de peso corporal diariamente durante quatro dias consecutivos) mais ciclosporina oral (5 mg por kg de peso corporal diariamente desde o primeiro dia durante pelo menos 12 meses). A ciclosporina foi então reduzida ao longo dos 12 meses seguintes e descontinuada após 24 meses.
- Os doentes do GE receberam a terapêutica experimental que consistiu em TSI mais eltrombopag (150 mg diários a partir do 14.º dia). As caraterísticas demográficas e clínicas dos participantes em ambos os grupos foram comparáveis. O período mediano de seguimento foi de 24 meses.
- A percentagem de doentes que responderam totalmente ao tratamento após três meses foi de 10% no GC e de 22% no CE (odds ratio [OR] combinado, 3,2; IC 95%: 1,3-7,8; p=0,01), Tab. 1).
- A taxa de resposta global aos 3 meses foi inferior no grupo de controlo (31%) do que no CE (59%) e o tempo médio para a primeira resposta foi de 8,8 meses no grupo de controlo e de 3,0 meses no CE. Após 12 meses, a taxa de resposta completa foi de 33% no grupo de controlo e de 52% no CE. A mediana do tempo até à primeira resposta foi de 3,0 meses no braço do eltrombopag e de 8,8 meses no braço do CE.
A incidência de efeitos adversos graves foi comparável em ambos os grupos; as interrupções de tratamento relacionadas com o tratamento foram raras. Foram detectadas mutações somáticas em 31% no GE e 29% no KG antes do início do estudo. Estas percentagens aumentaram para 55% no GE e 66% no KG no mês 6 após o início do estudo, sem qualquer efeito na resposta hematológica e nas taxas de sobrevivência a 2 anos (90% no GE vs. 85% no KG).
Os transplantes haploidênticos de medula óssea são também promissores para alargar o acesso ao transplante de células estaminais hematopoiéticas, referiu o orador [1,5].
Congresso: EHA2024
Literatura:
- “Immune aplastic anemia: Update on Pathophysiology and New Treatments”, Dr. Neal S. Young, EHA2024, Madrid, 13.6.-16.6.2024.
- Lauten M, Erlacher M, Knöfler R: Hematologia. Pediatria 2019: 541-570.
- Peffault de Latour R, et al: Eltrombopag adicionado à imunossupressão na anemia aplástica grave. N Engl J Med 2022; 386(1): 11-23.
- Townsley DM, et al: Eltrombopag adicionado à imunossupressão padrão para anemia aplástica. N Engl J Med 2017; 376: 1540-1550.
- DeZern A, et al: BMT de dador alternativo com ciclofosfamida pós-transplante como terapia inicial para anemia aplástica grave adquirida [publicado online antes da impressão, 2023 Abr 21]. Blood 2023; blood.2023020435. doi:10.1182/blood.2023020435.
HAUSARZT PRAXIS 2024; 19(11): 34–35 (publicado em 25.11.24, antes da impressão)
InFo ONKOLOGIE & HÄMATOLOGIE 2024; 12(6): 26–27