A radiochemoterapia combinada com citotoxicos clássicos e inibidores específicos de estruturas-alvo moleculares aumenta a amplitude terapêutica e faz parte da rotina clínica em muitas entidades tumorais. Os citotóxicos clássicos aumentam os danos no ADN quantitativa e qualitativamente em combinação com a radiação ionizante; inibidores específicos de alvos moleculares aumentam a eficiência dos danos no ADN estabelecidos pela radiação. Tanto as cascatas de transdução de sinal específico de células tumorais como o meio tumoral (hipoxia, sistema imunitário) são alvos interessantes para o tratamento combinado moderno.
A radioterapia clínica mudou durante os últimos 100 anos de uma aplicação experimental de raios X para uma modalidade terapêutica complexa, tecnologicamente altamente sofisticada e amplamente aplicada. Provavelmente os avanços tecnológicos mais importantes que moldaram o desenvolvimento da radioterapia foram a introdução da TC e da RM, que permitem a localização precisa do tumor em 3D, e o maior desenvolvimento da tecnologia do acelerador linear, que hoje em dia permite a irradiação precisa do tumor real com redução simultânea do volume de irradiação e, assim, a economia de tecidos saudáveis. Este desenvolvimento levou à tecnologia IMRT (Intensity-Modulated Radiation Therapy) e SBRT (Stereotactic Body Radiation Therapy) utilizada hoje em dia em radioterapia clínica. Apesar destes avanços técnicos, no entanto, uma escalada ilimitada da dose sem mais, as grandes toxinas normais dos tecidos dificilmente serão possíveis no futuro [1].
Radiochemoterapia combinada
Paralelamente a estas conquistas tecnológicas, foram feitos enormes progressos no campo da compreensão biológica dos efeitos da radiação, que hoje em dia se manifesta na clínica no campo da radiochemoterapia combinada. Enquanto a combinação com a quimioterapêutica clássica visa aumentar os danos do ADN na célula cancerosa, as classes de substâncias modernas são concebidas para aumentar a eficácia dos danos do ADN induzidos pela radiação e o programa de stress na célula cancerosa e no meio tumoral, o que, em última análise, leva à morte do tumor.
Actualmente, compreendemos o efeito da radiação em diferentes entidades tumorais não só ao nível dos danos no ADN, mas reconhecemos que a diferente sensibilidade à radiação no tumor e no tecido normal se deve a uma complexa rede de cascatas de transdução de sinal intra e intercelular. Estas descobertas levaram ao desenvolvimento de novas estratégias para superar a resistência intrínseca e adquirida à radiação, como parte da radiochemoterapia combinada com radiosensibilizadores. Estas estratégias incluem tanto as substâncias de pequenas moléculas que inibem especificamente as cascatas de sinalização orientadas pelo oncogénio como os modernos moduladores de pontos de controlo imunitário com o objectivo de aumentar a amplitude terapêutica no contexto da radiochemoterapia combinada [2,3].
Actualmente, mais de 50% de todos os pacientes com um tumor sólido são tratados ou apenas com radioterapia ou como parte de uma terapia combinada com cirurgia e/ou quimioterapia. Actualmente, 40% de todos os doentes com cancro para os quais se pode obter uma cura também recebem radioterapia como parte de uma terapia combinada.
Embora o carcinoma espinocelular (avançado) de cabeça e pescoço (HNSCC) afecte apenas uma pequena proporção de todos os doentes com cancro, o desenvolvimento de radiochemoterapia combinada pode ser muito bem ilustrado por esta entidade tumoral. Ao nível da investigação pré-clínica, inúmeras combinações de radioterapia com inibidores de pequenas moléculas de várias estruturas-alvo foram testadas ao longo dos últimos 20 anos. No entanto, até à data, apenas muito poucas estratégias foram implementadas com sucesso na clínica.
Hipoxia tumoral
A hipoxia, que se deve principalmente à vascularização não estruturada do tumor, é um dos principais mecanismos de resistência à radiação no HNSCC. Uma meta-análise de nível 1a baseada em evidências de 2011 mostra claramente que várias estratégias de modificação da hipoxia (fornecimento de oxigénio hiperbárico, respiração carbogénica em combinação com nicotinamida e radiosensibilizadores, etc.) levam a uma melhor sobrevivência sem progressão e sobrevivência global em HNSCC [4]. Por conseguinte, é ainda mais surpreendente que tais estratégias de modificação da hipoxia não tenham feito parte da rotina clínica até à data – excepto na Dinamarca, utilizando o nimorazol.
O nimorazol pertence à classe dos chamados mimetistas do oxigénio (misonidazol, etanidazol, pimonidazol), que foram clinicamente testados durante décadas como protótipos de hipoxia radio-sensibilizadores. No entanto, a maioria destes derivados nitroimidazólicos causam neurotoxicidade grave em doses elevadas e são, portanto, utilizados apenas clinicamente como marcadores diagnósticos de hipoxia tumoral. Contudo, o nimorazol parece estar a encontrar o seu caminho na rotina clínica, em parte devido à experiência adquirida em ensaios clínicos com os chamados “hidratos de hipoxia” (tirapazaminas, evofosfamida) [5,6]. Estes estudos mostram que a caracterização do estado de hipoxia e estratificação apropriada deve ser realizada quando se faz radiochemoterapia combinada com radiosensibilizadores de hipoxia. Em geral, há grandes esforços para determinar tanto o estado de hipoxia antes do início do tratamento como a dinâmica da hipoxia tumoral sob radioterapia de forma preditiva por meio de hipoxia PET (por exemplo, com misonidazol marcado com F18). Ao mesmo tempo, foi também identificada uma chamada assinatura de expressão de 15 genes para classificação de hipoxia. Esta assinatura caracteriza os tumores como mais ou menos hipóxicos e irá complementar a determinação directa convencional da pressão parcial de oxigénio no tumor no que diz respeito à caracterização da hipoxia. Por exemplo, um ensaio prospectivo EORTC multicêntrico fase III (EORTC-1219) está actualmente a investigar o efeito do nimorazol em combinação com radiochemoterapia cisplatina em HNSCC localmente avançado, HPV/p16-negativo. Também será determinado se esta assinatura de 15 genes é adequada como classificador preditivo. Está em preparação outro grande ensaio de fase III do nimorazol (DAHANCA30).
O receptor EGF como alvo terapêutico
Vários estudos randomizados e rotina clínica demonstraram durante mais de 15 anos que a administração simultânea de cisplatina em combinação com radioterapia aumenta tanto o tempo sem progressão como a sobrevivência global em comparação com a radioterapia apenas. Mecanisticamente, este efeito baseia-se predominantemente na modificação combinada do ADN por cisplatina e radicais de oxigénio reactivos gerados por radiação, que juntos levam a danos complexos no ADN. Ao mesmo tempo, contudo, esta combinação resulta também em graves efeitos secundários agudos e crónicos [7]. Isto estimulou a investigação intensiva em terapias alternativas, o que levou à combinação da radioterapia com o cetuximab monoclonal de anticorpos específicos do EGFR (Erbitux®).
A sobreexpressão do EGFR (epidermal growth factor receptor) é um factor de prognóstico forte e independente no HNSCC. O Cetuximab liga-se com grande afinidade ao seu domínio extracelular, bloqueando assim a ligação dos ligandos de activação de receptores. O Cetuximab em combinação com a radioterapia foi clinicamente testado no conhecido estudo de Bona em comparação com a radioterapia isolada e caracterizou-se por uma melhor sobrevivência sem progressão e sobrevivência global (49 vs 29 meses), bem como por uma grande redução das toxiciidades normais dos tecidos [8].
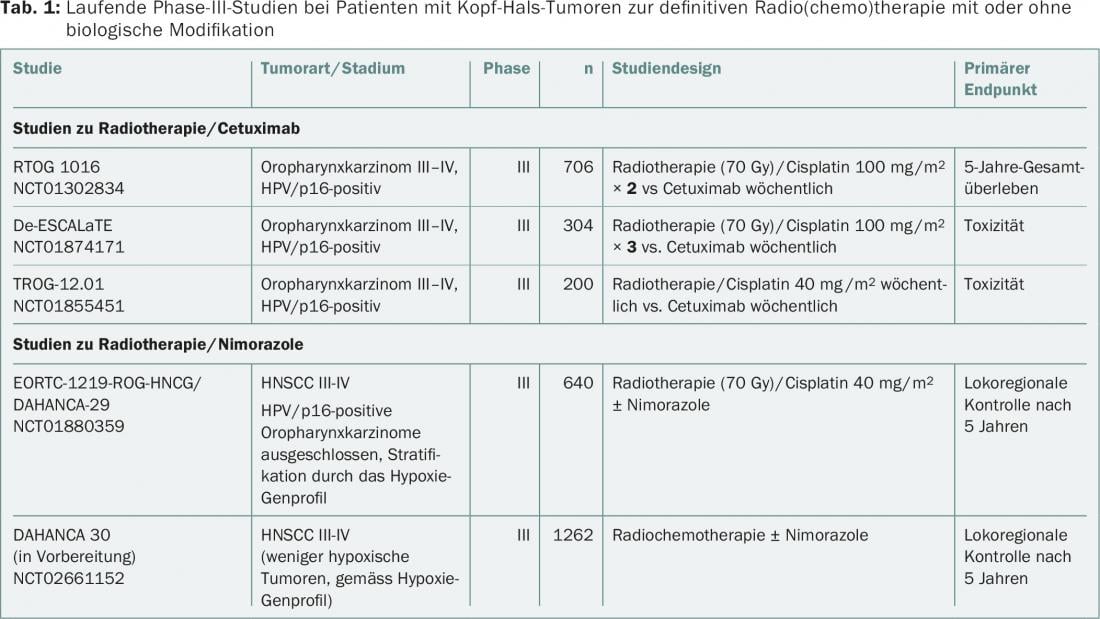
Uma comparação directa das duas formas de combinação (cisplatina/radioterapia vs cetuximab/radioterapia) não foi documentada até à data. Em termos de desescalonamento do tratamento, três ensaios aleatórios da fase III estão actualmente a investigar o valor da radioterapia/cetuximab versus radioterapia/cisplatina em HPV/p16-carcinoma orofaríngeo positivo (RTOG 1016, De-ESCALaTE, TROG-12.01) (separador. 1) . Em parte devido ao número esmagador de ensaios cisplatina/radioterapia – em comparação com os ensaios combinados cetuximab/radioterapia – o cisplatina continua a ser o padrão de cuidados em combinação com a radioterapia. O Cetuximab/radioterapia é hoje em dia utilizado principalmente para pacientes de HNSCC em situações de alto risco, por exemplo, intolerância à cisplatina ou mau estado geral. Curiosamente, a forma de combinação tripla de cetuximab/cisplatina/radioterapia não melhorou a sobrevivência sem progressão ou a sobrevivência global num ensaio aleatório [9].
Embora vários aspectos do estudo de Bona tenham sido criticados no passado, ele representa um marco no desenvolvimento da radiochemoterapia combinada. A nível pré-clínico e clínico, poderia ser demonstrado pela primeira vez que a inibição de uma estrutura-alvo (EGFR) molecularmente definida na célula tumoral leva à radiosensibilização. A investigação sobre os mecanismos de acção desta forma combinada também mostrou que os mecanismos clássicos e clinicamente relevantes de resistência à radioterapia são ultrapassados (repovoamento do tumor, capacidade intrínseca de reparação, elevado limiar de apoptose). Curiosamente, o cetuximab pode mesmo controlar processos imunomoduladores que também influenciam a resposta global.
Imunoterapia
A investigação pré-clínica e clínica intensiva centra-se hoje em dia em processos imunológicos radioterapêuticos relevantes. A radioterapia tem sido caracterizada há muito tempo como imunossupressora, uma vez que as células hematopoiéticas são particularmente sensíveis à radiação. No entanto, foi demonstrado que a irradiação do tumor também tem um efeito imuno-estimulador.
A radiação ionizante leva à activação de células assassinas naturais, infiltração de células T CD8 positivas, aumento da apresentação antigénica em células dendríticas e produção de citocinas imunoestimuladoras no tumor. No entanto, a nossa compreensão destes processos induzidos por radiação é apenas rudimentar [10]. Por exemplo, vemos padrões de reacção completamente diferentes após irradiação fraccionada de dose baixa e irradiação com doses únicas elevadas – isto, por sua vez, torna a investigação radiobiológica e translacional muito atractiva.
O foco é a investigação sobre a morte de células imunogénicas induzida por radiação ou a activação do chamado efeito abscopal por radioterapia. Isto refere-se a um efeito sistémico da irradiação no tecido tumoral em locais não irradiados, que é mediado por processos imunológicos. Há um grande interesse em melhorar o efeito clinicamente raro do abscópio no contexto da radiochemoterapia combinada com imunomoduladores. Também existem protocolos de radiochemoterapia combinados correspondentes com inibidores de pontos de controlo imunitários para HNSCC. Contudo, existem ainda muitos pontos de interrogação e não foram concluídos ensaios clínicos conclusivos nesta promissora área de aplicação.
Vários ensaios fase I/II em doentes com HNSCC para radiochemoterapia em combinação com imunoterapia estão actualmente registados no sítio web do NCI (https://clinicaltrials.gov) e estão em preparação ensaios aleatórios fase III.
Conclusão
A radioterapia moderna é uma forma de terapia oncológica de alta tecnologia em que cada paciente recebe um plano de terapia individual baseado nos parâmetros clínicos (incluindo a entidade tumoral, volume, localização). Os agentes quimioterápicos clássicos aumentam a eficácia da radioterapia. No contexto da “medicina personalizada”, a amplitude terapêutica desta forma individualizada de terapia pode ser ainda melhorada com substâncias específicas e definidas molecularmente. O objectivo é ultrapassar o perfil de radioresistência, que se baseia no fundo genético individual do tumor.
Literatura:
- Baumann M, et al: Radiação oncológica na era da medicina de precisão. Nat Rev Cancer 2016; 16(4): 234-249.
- Begg AC, et al: Estratégias para melhorar a radioterapia com medicamentos específicos. Nat Rev Cancer 2011; 11(4): 239-253.
- Morris ZS, et al: Interacção da radioterapia com agentes alvo moleculares. J Clin Oncol 2014; 32(26): 2886-2893.
- Overgaard J: Modificação hipóxica da radioterapia no carcinoma escamoso da cabeça e pescoço – uma revisão sistemática e meta-análise. Radiother Oncol 2011; 100(1): 22-32.
- Ahn GO, et al: Apontar tumores com citotoxinas activadas por hipoxia. Front Biosci 2007; 12: 3483-3501.
- Brown JM, et al: Exploração de hipoxia tumoral no tratamento do cancro. Nat Rev Cancer 2004; 4(6): 437-447.
- Pignon JP, et al.: Meta-análise da quimioterapia no cancro da cabeça e pescoço (MACH-NC): uma actualização sobre 93 ensaios aleatórios e 17.346 pacientes. Radiother Oncol 2009; 92(1): 4-14.
- Bonner JA, et al: Radioterapia mais cetuximab para cancro locoregionalmente avançado da cabeça e pescoço: dados de sobrevivência de 5 anos de um ensaio aleatório de fase 3, e relação entre erupção cutânea induzida por cetuximab e sobrevivência. Lancet Oncol 2010; 11(1): 21-28.
- Ang KK, et al: Estudo aleatório da fase III de radiação acelerada simultânea mais cisplatina com ou sem cetuximab para carcinoma de cabeça e pescoço de fase III a IV: RTOG 0522. J Clin Oncol 2014; 32(27): 2940-2950.
- Salama AK, et al: Irradiação e imunoterapia: Do conceito à clínica. Cancro 2016; 122(11): 1659-1671.
InFo ONcOLOGIA & HaEMATOLOGIA 2016; 4(7-8): 12-15.











