Os tratamentos disponíveis para a fibrose pulmonar idiopática (FPI) retardam a progressão da doença, mas não melhoram os sintomas nem a qualidade de vida. A maioria dos doentes com FPI refere uma tosse associada a uma rápida progressão da doença. As opções de tratamento baseadas em evidências para a tosse na FPI são escassas. Um estudo britânico demonstrou agora, pela primeira vez, um benefício da morfina na tosse relacionada com a FPI.
Existe uma grande necessidade não satisfeita de terapias que melhorem a qualidade de vida das pessoas com FPI e tratem os sintomas muito comuns e frequentemente incapacitantes, como a tosse. Os estudos que investigaram o impacto do peso da tosse na qualidade de vida na FPI demonstraram a estabilidade deste sintoma ao longo do tempo. A falta de clareza sobre os mecanismos patogénicos que causam a tosse na FPI limita as opções terapêuticas para os doentes e os médicos, escrevem o Dr. Zhe Wu do National Heart and Lung Institute, Imperial College, Londres, e Royal Brompton and Harefield Hospitals, Londres, e os seus colegas [1].
Realizaram um estudo prospetivo, multicêntrico, aleatório, em dupla ocultação, controlado por placebo e cruzado em três centros especializados no Reino Unido. Foram incluídos neste estudo doentes com idades compreendidas entre os 40 e os 90 anos, com um diagnóstico de FPI nos últimos cinco anos e uma tosse persistente auto-relatada durante pelo menos oito semanas e uma pontuação de tosse na escala visual analógica (VAS, 0-100 mm) de 30 mm ou mais. Os doentes foram distribuídos aleatoriamente (1:1) por placebo duas vezes por dia ou morfina oral de libertação controlada duas vezes por dia numa dose de 5 mg durante 14 dias. Seguiu-se uma fase de washout de sete dias antes de passarem para o outro tratamento num cruzamento. A ordem de administração da morfina e do placebo foi aleatorizada de acordo com um calendário gerado por computador. O parâmetro primário foi a frequência da tosse durante a vigília, que foi registada nos dias 0 e 14.
A morfina foi administrada sob a forma de um comprimido encapsulado, e tanto a morfina como a cápsula de placebo correspondente foram coloridas da mesma forma para manter a máscara. Os doentes, os investigadores, os enfermeiros do estudo e o pessoal da farmácia foram mascarados antes da atribuição do tratamento. Em caso de emergência, a máscara pode ser cancelada através do sistema de base de dados eletrónica (Sealed Envelope, EDC) se o conhecimento do tratamento for necessário para uma gestão clínica adequada ou para o bem-estar dos participantes.
A morfina reduziu a frequência da tosse em pelo menos 20%
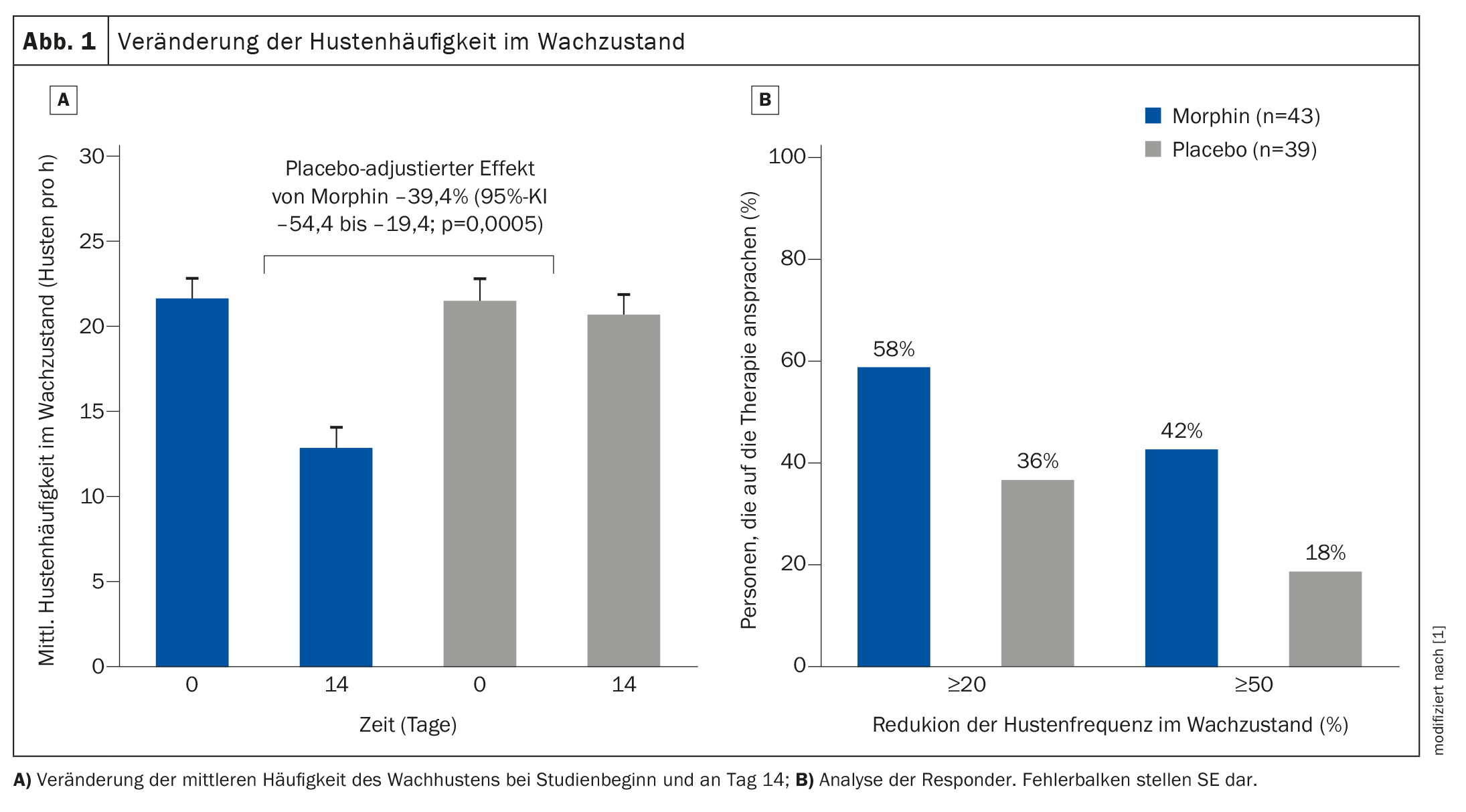
Dos 44 doentes aleatorizados, 43 completaram o tratamento com morfina e 41 completaram o tratamento com placebo. Na análise por intenção de tratar, a morfina reduziu a frequência objetiva da tosse durante a vigília em 39,4% (intervalo de confiança de 95% (IC) -54,4 a -19,4; p=0,0005) em comparação com o placebo (Fig. 1) . A frequência média de tosse por dia diminuiu de 21,6 (SE 1,2) tosses por hora na linha de base para 12,8 (SE 1,2) por hora com a morfina, enquanto as taxas de tosse por hora não se alteraram com o placebo (21,5; SE 1,2 vs. 20,6; SE 1,2). A qualidade de vida (avaliação subjectiva através de um questionário) e os sintomas da FPI também melhoraram. Globalmente, a adesão ao tratamento foi de 98% tanto no grupo da morfina como no grupo do placebo. Foram observados acontecimentos adversos em 17 (40%) de 43 participantes no grupo da morfina e em seis (14%) de 42 pacientes no grupo do placebo. [14%] [21%] Os principais efeitos secundários da morfina foram náuseas (seis em 43 participantes) e obstipação (nove em 43). Ocorreu um evento adverso grave (morte) no grupo do placebo.
Em resumo, os investigadores descobriram que a morfina de libertação controlada em dose baixa reduziu a frequência da tosse durante o dia em pelo menos 20% nos doentes com FPI com tosse relacionada com os pulmões e melhorou a impressão geral da alteração da tosse em mais de metade dos doentes. O número objetivo de ataques de tosse durante um período de 14 dias foi também significativamente reduzido em comparação com o placebo.
Preocupações com os efeitos secundários
A utilização de opiáceos em doentes com doença respiratória crónica é frequentemente limitada devido a preocupações com os efeitos secundários e o potencial de dependência e abuso. Num estudo recente, a nalbufina de libertação prolongada, um antagonista de opiáceos κ ou μ de dupla ação, reduziu a incidência de tosse torácica em pessoas com FPI em 51,6%. No entanto, quase um quarto dos participantes interrompeu o tratamento durante a utilização da nalbufina devido a efeitos secundários. São necessários mais estudos para determinar uma dose que mantenha o benefício clínico com uma tolerabilidade óptima.
Em contrapartida, o Dr. Zhe Wu e os seus colegas sublinharam que, no seu estudo, apenas um participante interrompeu o tratamento com morfina de libertação controlada de baixa dose e que uma proporção menor de participantes sofreu efeitos secundários do que no estudo da Nalbuphine. As avaliações de segurança efectuadas durante as visitas de estudo foram tranquilizadoras. Além disso, a estabilidade das pontuações na Escala de Hospitalidade e Depressão e no Domínio de Energia dos Sintomas do L-IPF indicou que não houve alterações de humor induzidas pela morfina ou fadiga excessiva, escrevem os autores.
O tratamento com doses baixas de morfina de libertação controlada melhorou significativamente as medições objectivas e subjectivas da tosse em doentes com tosse relacionada com FPI e mostrou-se promissor como medicamento antitússico eficaz nestes doentes. Tendo em conta os efeitos negativos da tosse nos doentes com FPI, estes resultados são favoráveis à utilização do medicamento a curto prazo na prática clínica, segundo os autores. A investigação futura deve centrar-se em estudos a longo prazo.
Literatura:
- Wu Z, et al.: Morphine for treatment of cough in idiopathic pulmonary fibrosis (PACIFY COUGH): a prospective, multicentre, randomised, double-blind, placebo-controlled, two-way crossover trial. Lancet Resp Med 2024; 12: 273–280; doi: 10.1016/S2213-2600(23)00432-0.
InFo PNEUMOLOGIE & ALLERGOLOGIE 2024; 6(2): 20–21