Em homens com carcinoma de próstata avançado sob privação de androgénio, a osteodensitometria deve ser realizada inicialmente e, se a osteopenia/osteoporose for comprovada, ou se houver um risco acrescido de fractura, deve ser considerada a terapia anti-reabsortiva da osteoporose. Os bisfosfonatos ou denosumab não são indicados para o tratamento de metástases ósseas em homens com cancro da próstata metastásico castrado e podem levar a um aumento da incidência de complicações como a osteonecrose da mandíbula. O uso de denosumab ou zoledronato é útil no carcinoma ósseo metastático de próstata resistente à castração com suplementação simultânea adequada de cálcio e vitamina D.
Introdução
O cancro avançado da próstata ocorre frequentemente em homens mais velhos. Os tratamentos medicamentosos para o cancro da próstata metastásico, tais como a terapia de privação de androgénio (ADT) com deficiência subsequente de testosterona, bem como a administração concomitante de esteróides durante a terapia com abiraterona, docetaxel ou cabazitaxel, têm um efeito desfavorável na densidade óssea. Tanto mais que o ADT é frequentemente realizado ao longo de vários anos. O desenvolvimento da osteoporose com as complicações correspondentes deve, portanto, ser tido em conta. Além disso, as metástases ósseas ocorrem em até 90% dos doentes com cancro da próstata metastásico. Eventos esqueléticos (SRE) tais como fracturas patológicas, compressão espinal, radioterapia ou estabilização ortopédica das metástases ósseas, representam potenciais complicações das metástases esqueléticas com elevada morbilidade e custos significativos; por conseguinte, deve ser dada atenção à saúde óssea em homens com cancro da próstata avançado e a terapia orientada para os ossos deve ser considerada atempadamente. Como uma característica especial do carcinoma da próstata, a sobrevivência mediana com metástases esqueléticas está a vários anos do diagnóstico, razão pela qual o uso de terapias anti-resorptivas deve ser adaptado à situação individual da doença. A seguir, serão discutidas as várias opções terapêuticas, bem como as situações clínicas típicas.
Bisfosfonatos e Activador Receptor da inibição de NF-κ Ligand (RANKL)
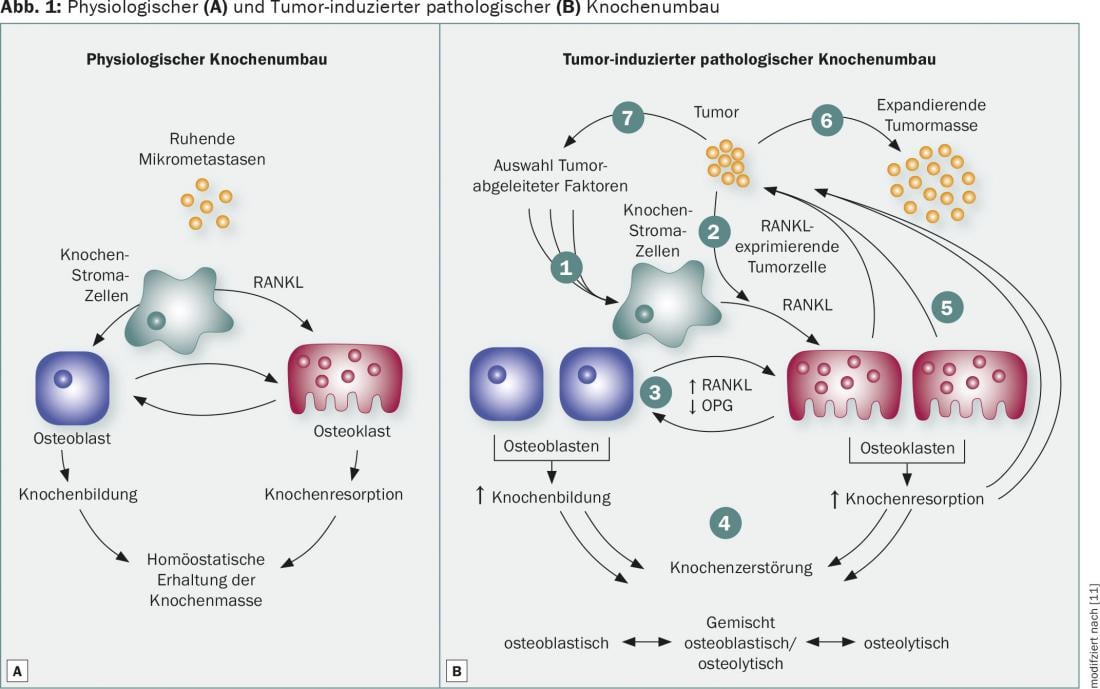
A remodelação óssea é controlada por osteoblastos que acumulam nova substância óssea e osteoclastos que reabsorvem a matriz óssea inorgânica e orgânica. Na remodelação óssea fisiológica, a função dos osteoblastos e osteoclastos está em equilíbrio, o que garante a manutenção da massa óssea (Fig. 1A). A ocorrência de metástases ósseas leva ao aumento da actividade osteoclasta com o subsequente aumento da reabsorção óssea, que pode ser responsável por complicações esqueléticas. A via de sinalização RANKL é um mecanismo crítico na diferenciação, activação e sobrevivência dos osteoclastos que está excessivamente regulamentado nos doentes com metástases ósseas (Fig. 1B) . Estas descobertas levaram ao desenvolvimento de compostos antiresorptivos concebidos para inibir a actividade osteoclasta e assim prevenir a reabsorção óssea. Os bisfosfonatos ligam o cálcio à superfície óssea e são fagocitoseados por osteoclastos, levando à sua apoptose. O denosumab de anticorpos monoclonais humanos liga RANKL com alta afinidade e especificidade. A inibição da interacção com RANK previne a reabsorção óssea e a destruição óssea relacionada com o cancro, reduzindo o número e a actividade dos osteoclastos.
Profilaxia da osteoporose sob privação de androgénio no carcinoma da próstata
Devido ao bloqueio da síntese de testosterona, o ADT leva a uma redução da densidade óssea com o risco de desenvolver osteoporose. Uma osteodensitometria para determinar a densidade óssea deve portanto ser realizada no início de um ADT a longo prazo (>6 meses). Se a osteopenia estiver presente, há um risco acrescido de desenvolvimento de osteoporose sintomática – esta progressão deve ser evitada.
Um estudo de fase 3 em homens com cancro da próstata tratados com ADT que tiveram osteopenia (T-score <-1) ou um historial de fractura osteoporótica mostrou uma redução significativa na incidência de fracturas vertebrais nos primeiros dois anos na TDA quando os pacientes receberam profilaxia de osteoporose com denosumab (60 mg de seis em seis meses) [1].
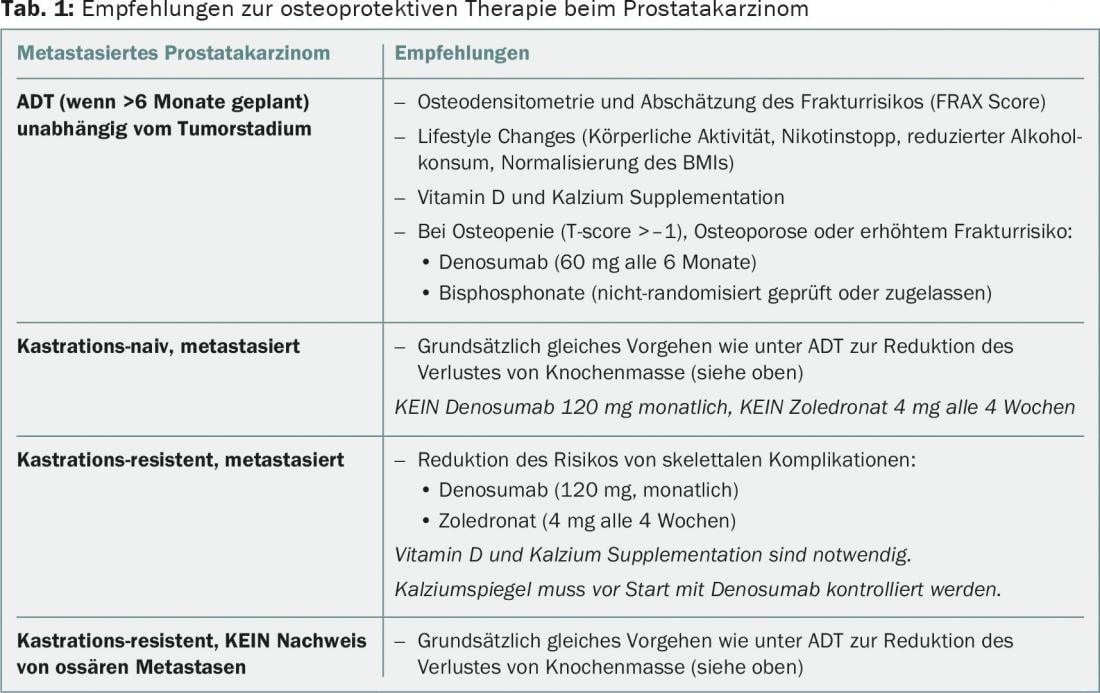
Também foram encontrados bisfosfonatos para melhorar a densidade óssea em homens em ADT, mas não foram encontrados ensaios aleatórios. Assim, o denosumabe ou os bisfosfonatos devem ser considerados em doentes em ADT, com osteoporose comprovada ou risco aumentado de fractura (osteoporose/fractura osteoporótica na história clínica, medição da densidade óssea com pontuação T <-1, uso permanente de glicocorticóides), na dosagem e frequência correctas para esta indicação (por exemplo, denosumabe 60 mg de seis em seis meses). São também recomendadas alterações simultâneas do estilo de vida e suplementação suficiente de cálcio e vitamina D (tab. 1).
Castração – carcinoma ósseo metastático da próstata
Num estudo randomizado da fase 3, o zoledronato bisfosfonato foi investigado a uma dose mensal de 4 mg em doentes com castração-naïve (estes doentes respondem à terapia com ADT em 90% dos casos) carcinoma ósseo metastático da próstata [2]. Não foi possível demonstrar uma redução do risco de eventos esqueléticos, o ponto final primário do estudo, e uma melhoria na sobrevivência global. A Denosumab não foi testada nesta indicação. Devido a isto, os bisfosfonatos e inibidores de RANKL não são indicados em homens com cancro da próstata metastásico osseo e castração. O estatuto de aprovação de bisfosfonatos e denosumab na Suíça (“tratamento de pacientes com metástases ósseas de tumores sólidos em combinação com terapia antineoplásica padrão”) infelizmente não coincide com a evidência deste estudo, resultando no risco de tratamento excessivo deste grupo de pacientes, com um risco aumentado de toxicidade, especialmente a ocorrência de osteonecrose da mandíbula (ONJ) e hipocalcemia (com risco de vida). Por outro lado, como mencionado acima, a profilaxia da osteoporose também deve ser considerada neste grupo de pacientes.
Carcinoma ósseo metastático da próstata resistente à castração
Nos principais estudos de Saad et al. [3,4], foi demonstrada uma redução significativa do risco de eventos esqueléticos para o zoledronato em comparação com o placebo, numa dose de 4 mg a cada três semanas durante 15 a um máximo de 24 meses em homens com cancro da próstata metastásico resistente à castração. Um estudo de seguimento mostrou a superioridade do denosumab (120 mg subcutaneamente a cada quatro semanas) sobre o zoledronato nesta indicação [5]. O tempo médio para o primeiro evento esquelético foi prolongado por 3,5 meses com denosumab versus zoledronato (20,7 versus 17,1 meses, HR 0,82, 95% CI 0,71-0,95, p=0,008). Mais hipocalcaemias de grau ≥3 ocorreram no grupo denosumab (5 vs. 1%), ONJ foram raras em ambos os grupos nos primeiros dois anos (2 vs. 1%). Deve notar-se, contudo, que a incidência de ONJ aumenta significativamente com vários anos de uso de denosumab, atingindo até 8% a longo prazo. O uso de denosumab ou zoledronato é certamente útil no carcinoma ósseo metastático de próstata resistente à castração com suplementação simultânea adequada de cálcio e vitamina D. Contudo, é de notar que o recrutamento de pacientes nestes ensaios ocorreu antes da era dos novos agentes antineoplásicos abiraterona, enzalutamida e rádio. Para todos estes medicamentos, observou-se uma redução significativa dos eventos esqueléticos nos ensaios que acabaram por conduzir à sua aprovação [6–8].
A questão da dosagem e frequência óptima das substâncias anti-reabsorventes permanece por resolver. Num ensaio aleatório da fase 3, a dosagem trimestral de zoledronato era não inferior à dosagem mensal padrão, em doentes com carcinoma metastático (incluindo mais de 600 doentes com carcinoma da próstata), no que diz respeito ao ponto final primário do SRE [9]. Um estudo da Associação Suíça para Investigação Clínica do Cancro (estudo SAKK 96/12, ver www.sakk.ch) está actualmente a testar a dose padrão de denosumab contra uma frequência reduzida em homens com cancro da próstata metastásico resistente à castração, particularmente tendo em conta a frequência crescente de ONJ durante o período de tratamento.
Carcinoma da próstata resistente à castração sem evidência de metástases ósseas
A Denosumab (120 mg de quatro em quatro semanas) também foi estudada em homens com cancro da próstata com níveis crescentes de PSA sob privação de androgénio mas sem a presença de metástases (os chamados pacientes M0 CRPC) num estudo de fase 3 [10]. Isto mostrou um prolongamento da sobrevivência sem metástases ósseas, mas sem uma vantagem para a sobrevivência global. O benefício foi avaliado como clinicamente irrelevante tanto pelas autoridades reguladoras como pelos peritos na Conferência St. Gallen Advanced Prostate Cancer Consensus Conference (APCCC) em 2015 e, portanto, geralmente não é recomendado. A Denosumab também não é aprovada em nenhum país para esta indicação.
Resumo e perspectivas
A terapia osteoprotectora é um pilar importante do tratamento do carcinoma metastático da próstata óssea em certas indicações. As nossas recomendações estão resumidas no quadro 1 . As sobreterapias devem ser evitadas, especialmente devido ao risco de efeitos secundários raros mas graves. Os estudos actuais fornecerão informações sobre a dosagem e frequência terapêutica dos bisfosfonatos e inibidores de RANKL ao longo do tempo. Até à data, não há provas de que os inibidores RANKL tenham um efeito antineoplásico no cancro da próstata que seja clinicamente relevante e resulte numa melhor sobrevivência. Assim, os bisfosponatos ou denosumab só devem ser utilizados como parte da terapia da osteoporose, ou para prevenir SREs, no cancro da próstata refractário da castração.
Literatura:
- Smith MR, et al: Denosumab em Homens que Recebem Terapia de Androgénio-Deprivação para o Cancro da Próstata. NEJM 2009; 361(8): 745-755.
- Smith MR, et al: ensaio aleatório controlado de ácido zoledrónico precoce em homens com cancro da próstata sensível à castração e metástases ósseas: resultados de CALGB 90202 (aliança). J Clin Oncol 2014; 32: 1143-1150.
- Saad F, et al: Um ensaio aleatório, controlado por placebo, de ácido zoledrónico em doentes com carcinoma metastático da próstata refractário de hormonas. J Natl Cancer Inst 2002; 94: 1458-1468.
- Saad F, et al: Eficácia a longo prazo do ácido zoledrónico para a prevenção de complicações esqueléticas em doentes com cancro da próstata metastático-refractário. J Natl Cancer Inst 2004; 96: 879-882.
- Fizazi K, et al: Denosumab versus ácido zoledrónico para o tratamento de metástases ósseas em homens com cancro da próstata resistente à castração: um estudo aleatório, duplo-cego. Lancet 2011; 377: 813-822.
- Logothetis CJ, et al: Effect of abiraterone acetate and prednisone compared with placebo and prednisone on pain control and skeletalrelated events in patients with metastatic castration-resistant prostate cancer: análise exploratória dos dados do ensaio aleatório COU-AA-301. Lancet Oncol 2012; 13: 1210-1217.
- Fizazi K, et al: Efeito da enzalutamida no tempo até ao primeiro evento relacionado com o esqueleto, dor, e qualidade de vida em homens com cancro da próstata resistente à castração: resultados do ensaio aleatório, fase 3 AFFIRM. Lancet Oncol 2014; 15: 1147-1156.
- Sartor O, et al: Efeito do dicloreto de rádio-223 em eventos esqueléticos sintomáticos em doentes com cancro da próstata resistente à castração e metástases ósseas: resultados de um ensaio aleatório de fase 3, duplo-cego. Lancet Oncol 2014; 15: 738-746.
- Himelstein AL, et al. CALGB 70604 (Aliança): Um Estudo Randomizado Fase III de Dosagem Padrão vs. Dosagem com Intervalo Maior de Ácido Zoledrónico em Cancro Metástático. Reunião Anual da ASCO 2015. Resumo 9501.
- Smith MR, et al: sobrevivência livre de Denosumab e de metástases ósseas em homens com cancro da próstata resistente à castração: resultados de um ensaio de fase 3, aleatorizado, controlado por placebo. Lanceta 2012; 379: 39-46.
- Dougall WC: Caminhos moleculares: papéis dependentes do osteoclasto e independentes do osteoclasto da via RANKL/RANK/OPG na tumorigenese e metástase. Clin Cancer Res 2012; 18(2): 326-335.
InFo ONCOLOGY & HEMATOLOGY 2016; 4(5): 8-12