As terapias sistémicas para a psoríase têm mudado muito nos últimos anos. No passado, a terapia com luz ou as terapias sistémicas convencionais como o metotrexato, acitretina, ciclosporina A e os ésteres do ácido fumárico eram utilizados na sua maioria. Actualmente, estes são cada vez mais substituídos no decurso da terapia por tratamentos com os mais recentes produtos biológicos e o grupo de pequenas moléculas.
De acordo com a sua importância no desencadeamento das crises de doença, os factores precipitantes da psoríase devem ser sistematicamente eliminados: Antes de mais, estas incluem infecções, stress, medicação e cuidados de pele inadequados.
Para além das infecções estreptocócicas, que são frequentemente apontadas como a causa, o stress psicológico é também considerado como um importante factor provocador, especialmente na infância e adolescência. Os jovens sofrem mais frequentemente de estigmatização, o que pode levar a grandes situações de conflito psicossocial, especialmente durante a puberdade. Os jovens têm a mesma perda de qualidade de vida devido à psoríase que têm devido à acne.
Medicamentos tais como β2-bloqueadores, inibidores da ECA, antimaláricos, lítio e AINEs também podem provocar psoríase, pelo que é importante um historial de medicação minucioso.
Por último, mas não menos importante, os cuidados com a pele devem ser tomados mesmo quando não há aparência ou expressão mínima de doença. A utilização regular de preparações de cuidado da pele não só ajuda a restaurar a função de barreira perturbada da pele, mas também tem o objectivo de prevenir a ocorrência de novos sintomas cutâneos devido a irritações como a desidratação (banhos ou duches frequentes, permanência em salas aquecidas com baixa humidade). Por conseguinte, a pele deve ser cuidada diariamente com produtos apropriados.
Séries completas de cuidados cutâneos especialmente desenvolvidas para doentes com psoríase (por exemplo, Aqeo®), mas também formulações dermatológicas comprovadas ou outros produtos de cuidados cutâneos são adequados para cuidados cutâneos diários, desde que sejam bem tolerados pelo doente.
Terapia tópica
Para placas de escala infiltradas, uma terapia de descalcificação com queratolíticos é útil em primeiro lugar, sobretudo para melhorar a penetração de agentes activos. Aqui é recomendada a utilização de ácido salicílico em concentrações entre 5 e 10%, dependendo da localização numa vaselina, carbowax ou base de petróleo. Outros queratolíticos são a ureia, o ácido láctico e o enxofre coloidal.
Enquanto o ácido salicílico é essencialmente utilizado para remover a caspa, a ureia (em concentrações entre 8 e 12%), o ácido láctico (2,5-10%) e o enxofre são adequados para cuidados e tratamentos sob a forma de aditivos em cremes, loções ou banhos de óleo de enxofre.
Em crianças com menos de 12 anos de idade, a aplicação local em grande área de preparações tópicas contendo ácido salicílico pode levar a toxicidade reabsortiva (salicilismo) com danos para o sistema nervoso central e rins. Portanto, a utilização de cremes emulsionantes como o Unguentum emulsificans aquosum, se necessário com a adição de ureia (5%), é recomendada para a desquamação em crianças.
Uma vez as placas descamadas, são utilizados corticosteróides tópicos. Estas estão entre as terapêuticas locais mais comummente utilizadas para a psoríase. Caracterizam-se por uma eficácia e tolerabilidade muito boas, bem como – quando utilizadas correctamente – efeitos indesejáveis baixos com uma relação preço-desempenho comparativamente favorável.
A avaliação negativa da cortisona na população não tem qualquer base médico-dermatológica. Só se a duração da terapia for demasiado longa (terapia ininterrupta durante mais de seis semanas) é que ocorre atrofia cutânea, embora em muitos casos esta possa ser irreversível. Tipicamente, os esteróides de classe III-IV que são tanto anti-inflamatórios como antiproliferativos, como o dipropionato de clobetasol (Dermovate®), betametasona (Betnovate®) ou, especialmente em crianças, o furoato de mometasona (Elocom®) são bem eficazes, de preferência em combinação com análogos tópicos de vitamina D como o calcipotriol (Daivobet®), o tacalcitol (Curatoderm®) e o calcitriol (Silkis®). Estes também estão disponíveis em combinações fixas de betametasona e calcipotriol para aplicação tanto na pele (Daivobet®) como no couro cabeludo (Xamiol®) [1]. Para focos localizados, os corticosteróides também podem ser aplicados oclusivamente para aumentar a eficácia, por exemplo, sob a forma de um remendo (Betesil®).
Em princípio, a terapia ininterrupta com corticosteróides para além de um mês não é recomendada, por um lado devido à atrofia e outros efeitos secundários cutâneos, e por outro lado devido à absorção e ao risco de atrofia do córtex adrenal. Como alternativa às preparações de corticosteróides, os inibidores tópicos de calcineurina tacrolimus ou pimecrolimus (Protopic®, Elidel®) são adequados nas áreas intertriginosas (psoríase inversa).
Fototerapia
A fototerapia é altamente valorizada no tratamento da psoríase moderada e grave. É fácil de usar, cosmeticamente aceitável, não muito caro e barato. Finalmente, pode ser combinado vantajosamente com tratamentos tópicos. Actualmente, são utilizadas principalmente lâmpadas UVB que emitem 311 nm [2]. Os raios UVA de maior comprimento de onda também podem ser altamente eficazes em combinação com psoralenos e retinóides fotossensibilizadores [3].
Terapia sistémica
As terapias sistémicas são indicadas para casos moderados a graves de psoríase que não podem ser adequadamente controlados por medidas locais e fototerapia, e para a artrite psoriásica. É feita uma distinção entre as terapias sistémicas padrão com metotrexato, acitretino, ciclosporina A e os ésteres do ácido fumárico e o tratamento com os mais recentes biólogos.
O Metotrexato (MTX) é uma opção rentável com perspectivas limitadas a longo prazo. Dosagem baixa (7,5 ao máximo. 30 mg/semana), MTX mostra um efeito particularmente bom em todas as formas pustulosas de psoríase, eritrodermia psoriásica, bem como na artrite psoriásica, mas também na psoríase em forma de placa extensa. O MTX tem um efeito antiproliferativo e anti-inflamatório ao inibir a enzima dihidrofolato redutase, impedindo assim a formação do importante metabolito ácido tetrahidrofólico do ácido fólico. Conduz a uma melhoria de 75% na psoríase superficial em cerca de 60% dos casos (60% PASI75) [4,5]. Uma resposta é vista dentro de duas a seis semanas [6]. A administração inicial é de 7,5 mg/semana, devido à cinética de absorção variável com administração oral, é preferível a forma parenteral. Nas primeiras duas semanas, a dose deve ser aumentada para a dose normal de manutenção de 10-15 mg semanalmente, ajustando a dose de três em três a quatro semanas. A administração de 5 mg de ácido fólico p.o. 24-48 horas mais tarde melhora a tolerância. A principal desvantagem do MTX é a dose cumulativa limitada de cerca de 1,5 g, que é normalmente atingida após dois a quatro anos. Neste limite, as determinações do procollagen III ou biópsias hepáticas são agora recomendadas para excluir a fibrose hepática.
Os retinóides são análogos da vitamina A lipossolúvel vital. Têm um efeito antiproliferativo e imunomodulador. A acitretina retinóide sistémica mais utilizada (Neotigason®) numa dose de 20-75 mg mostra um PASI75 em 25-41% dos doentes no prazo de oito a doze semanas [7,8]. As doses mais baixas não mostram qualquer efeito. A acitretina é preferida para as formas pustulosas de psoríase e eritrodermia psoriásica. A dose inicial é normalmente 0,5-1 mg/kg/d. Após resposta, pode ser reduzido para 0,3-0,5 mg/kg/d como terapia de manutenção. Uma vez que os efeitos secundários são frequentes, embora na sua maioria reversíveis, e a droga é inferior às outras preparações como monoterapêutica, é quase apenas utilizada como preparação combinada para fotochemoterapia. Taxas de remissão superiores a 94% são aqui alcançadas [3]. Em qualquer caso, os pacientes devem ser informados do efeito teratogénico e é prescrito um anticoncepção eficaz durante dois anos.
O peptídeo entérico ciclosporina A (Sandimmun Neoral®), derivado do bolor do solo Tolypocladium inflatum, inibe os factores de transcrição nuclear nas células T. Isto permite uma rápida imunossupressão celular. Com administração oral de 2,5-3 mg/kgKG/d em duas doses únicas (dose mais baixa descrita para tratamento a longo prazo [9,10]), um PASI75 é alcançado em 50-70% dos casos após 8-16 semanas de terapia [11,12]. A Ciclosporina A tem a desvantagem de muitos efeitos secundários, incluindo o desenvolvimento de hipertensão arterial, insuficiência renal, tremor, infecções e hipertricose. Normalmente não pode ser utilizado por mais de alguns meses, pelo que não é normalmente adequado como terapia a longo prazo para doentes psoriásicos. Hoje em dia, é principalmente utilizada como terapia de salvamento em situações em que o estado da pele precisa de ser melhorado rapidamente (dentro de quatro semanas), como na psoríase eritrodermatica.
Os ésteres do ácido fumárico (Fumaderm®) provaram a sua eficácia em estudos duplo-cego desde o seu desenvolvimento por Schweckendiek, um químico que foi ele próprio afectado pela psoríase [13–15]. Esta classe de substâncias é um subproduto do ciclo do citrato e tem a vantagem de um perfil de eficácia muito seguro, embora se manifeste frequentemente com efeitos secundários incómodos no início da terapia, por exemplo, rubor, dor de cabeça, náuseas, diarreia e linfopenia passiva. No entanto, se tolerada, pode ser tomada durante décadas e suprimir completamente a psoríase. O PASI75 é alcançado por 50-70% dos doentes após 16 semanas [13–15]. Não é aprovado na Suíça, mas pode ser obtido facilmente nas farmácias internacionais após obter a aprovação da companhia de seguros de saúde.
Biológicos
Uma vez que a psoríase é considerada uma doença imunitária mediada por células T na qual as citocinas também desempenham um papel essencial, surgem pontos de partida específicos para a terapia. Os produtos biológicos, nomeadamente anticorpos recombinantes ou receptores solúveis, podem inibir eficazmente as citocinas activadoras de células T. Actualmente aprovados na Suíça para o tratamento da psoríase de placa moderada a grave em adultos sob certas condições são o factor de necrose tumoral (TNF)-α antagonistas infliximab (Remicade®), etanercept (Enbrel®) e adalimumab (Humira®), o bloqueador ustekinumab IL-12/23 (Stelara®) e o antagonista secukinumab IL-17A (Cosentyx®).
Antagonistas de TNF-α: Actualmente, os antagonistas de TNF-α são os antagonistas de TNF-α, os biólogos mais utilizados para o tratamento da psoríase e da artrite psoriásica.
Etanercept (Enbrel®) é um receptor solúvel de TNF-α que é administrado s.c.. Usar 50 mg semanalmente, ou 50 mg duas vezes por semana para casos graves. O medicamento leva a uma melhoria de 75% na IPPAS em 30% dos pacientes no prazo de doze semanas [16]. É a única biologia também aprovada para a psoríase pediátrica [17]. A questão para o futuro, especialmente para a artrite psoriásica na infância, é até que ponto o tratamento precoce com etanercept pode evitar um curso destrutivo e invalidante.
Infliximab (Remicade®) é um anticorpo quimérico de rato-humano contra TNF-α, que é administrado como uma infusão de oito em oito semanas após a dosagem inicial. O Infliximab é adequado para pacientes pesados, pois pode ser administrado de forma adaptada ao peso. É actualmente um dos biólogos mais eficazes, mas tem a desvantagem de um efeito decrescente ao longo do tempo devido à formação de anticorpos.
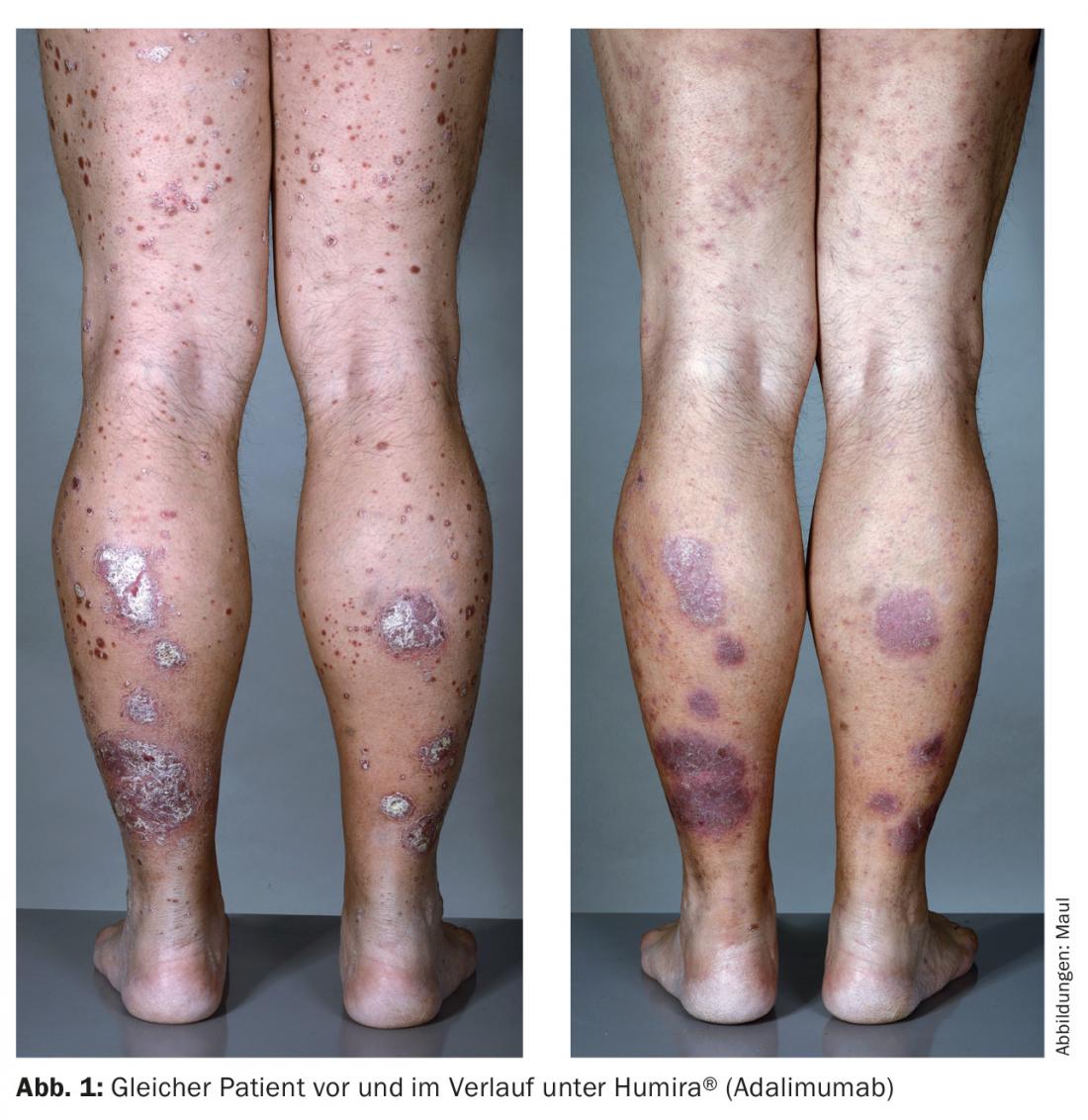
Adalimumab (Humira®) é um anticorpo TNF-α totalmente humanizado que é injectado s.c. a cada quinze dias e combina boa eficácia com grande autonomia do doente (Fig. 1). Tanto o infliximab como o adalimumab são superiores ao etanercept em eficácia.
Bloqueador IL-12/23: O bloqueador IL-12/23 ustekinumab (Stelara®) é um anticorpo totalmente humanizado que liga a subunidade comum de IL-12 e -23. Estas citocinas são importantes nas respostas imunitárias locais. Embora sejam essenciais para o desenvolvimento de lesões cutâneas psoriásicas, não parecem ser essenciais para a imunidade normal, uma vez que não ocorreram efeitos adversos significativos em estudos comparados com placebo. Estudos a longo prazo também não mostraram nenhum aumento das taxas de infecção, tornando o fármaco uma das terapias mais seguras para a psoríase disponível [18,19].
Antagonista da IL-17A: Uma nova biologia que entrou no mercado em 2015 é o bloqueador secukinumab IL-17A (Cosentyx®). IL-17A é uma substância mensageira produzida pelo subgrupo de células T-helper Th17, entre outras, e é muito especificamente responsável pela inflamação local através do recrutamento local de granulócitos neutrófilos e monócitos para locais de inflamação. A vantagem desta inibição selectiva da resposta imunitária é que os efeitos secundários são limitados devido à inibição destas citocinas. Secukinumab é administrado 300 mg s.c. semanalmente durante o primeiro mês, a partir da semana 5 é administrado mensalmente. Dois ensaios fase III de secukinumab na psoríase moderada a grave mostraram que a melhoria do PASI75 na semana 12 da terapia da psoríase (em comparação com a condição pré-terapêutica) foi alcançada em 77,1-81,6% de todos os doentes [20]. Num estudo comparativo, o tratamento com etanercept foi comparado com placebo; aqui, apenas 44,0% dos pacientes atingiram um PASI75 até à semana 12 com etanercept, enquanto o placebo atingiu este desfecho em menos de 5% dos casos em cada caso. Na semana 52, foi observada uma resposta PASI90 em 39% dos doentes a tomar Enbrel® vs. 70,6% a tomar secukinumab 300 mg. Os efeitos secundários dos antagonistas de IL-17 foram investigados em ensaios da fase III [20]. O medicamento mostrou um perfil de segurança e efeitos secundários semelhante ao dos produtos biológicos mais antigos. Em comparação com o placebo, o período de indução mostrou uma incidência ligeiramente maior de efeitos adversos, especialmente os de natureza infecciosa não-perigosa. A IL-17 desempenha um papel fundamental na defesa contra agentes patogénicos microbianos mucocutâneos. Entre outras coisas, estes são defendidos por granulócitos neutrófilos, para os quais a IL-17-A desempenha um papel importante na migração e na granulopoiese. Isto explica porque é que a incidência de infecções por Candida não complicadas é aumentada de forma dose-dependente. Todas as infecções por Candida podiam ser tratadas com a terapêutica padrão e não levavam a uma interrupção da terapia biológica. Além disso, existiam algumas neutropenias, que, no entanto, desapareceram espontaneamente.
Estudos demonstraram que o secukinumabe é também uma boa terapia alternativa para a artrite psoriásica. O ponto final utilizado é o ACR20, uma pontuação padrão que mede a melhoria de 20% nos sintomas da artrite psoriásica. Na semana 24, isto tinha atingido aproximadamente 50% dos pacientes tratados com secukinumab em comparação com 18% dos pacientes com placebo. Num segundo estudo, 39% dos doentes tratados com 300 mg secukinumab obtiveram um ACR20 em comparação com 15% do grupo placebo [21].
Pequenas Moléculas
Outro medicamento aprovado na Suíça em 2015 é o apremilast (Otezla®), um inibidor oral de pequena molécula fosfodiesterase 4 (PDE4) para o tratamento da psoríase (PsO) e da artrite psoriásica (PsA), que pertence ao grupo das “pequenas moléculas alvo”. O inibidor PDE4 apremilast intracelular regula a produção de citocinas inflamatórias, que desempenham um papel na imunopatofisiologia do PsO, elevando os níveis de AMPc intracelular. A produção de citocinas pró-inflamatórias (tais como TNF-α, IL-23, IL-17) é reduzida, enquanto que a produção de citocinas anti-inflamatórias é promovida. Nos ensaios ESTEEM 1 e 2, cerca de seis vezes mais pacientes conseguiram uma resposta PASI75 na semana 16 com apremilast do que com placebo (especificamente, um terço dos pacientes com apremilast tiveram uma melhoria de 75% na psoríase no prazo de 16 semanas). A resposta foi mantida durante 52 semanas. 22% dos pacientes tratados com apremilast também conseguiram a cura quase completa do PsO após 16 semanas (sPGA: 21,7% vs. 3,9%). Além disso, o apremilast mostrou bons resultados em sítios difíceis de tratar como o couro cabeludo (scPGA) e a infestação de unhas (NAPSI) já na semana 16. A comichão diminuiu mais durante este tempo do que com placebo, mas também aqui, a biologia individual tem um efeito mais rápido e possivelmente mais forte. A qualidade de vida melhorou clinicamente de forma significativa em comparação com o grupo placebo (redução DLQI ≥5: 70% vs. 34%) [22]. O tratamento com Apremilast foi bem tolerado (sem aumento do risco de infecções) e, consequentemente, resultou numa menor taxa de descontinuação do tratamento. Efeitos secundários experimentados incluídos: Diarreia, náuseas, dores de cabeça e infecções das vias respiratórias superiores, na maioria das vezes nas primeiras duas semanas de tratamento. Os sintomas da diarreia desapareceram geralmente no espaço de quatro semanas sem intervenção médica com a terapia contínua com Otezla® [22,23]. O Apremilast é aumentado inicialmente como titulação durante cinco dias (pacote de titulação de 10/20/30 mg), depois administrado como terapia de manutenção a 30 mg 2×/d. O Apremilast também pode ser usado para tratar a artrite psoriásica, como demonstrado no estudo PALACE1 (n=504). O tratamento com apremilast resultou numa resposta significativamente superior ao ACR20 (38,1% vs. 19,0%) em comparação com placebo na semana 16. A taxa de resposta do ACR20 melhorou progressivamente entre a semana 24 e a semana 52 a 63% (apremilast 20 mg BID) e 55% (apremilast 30 mg BID), respectivamente. O Apremilast também mostrou uma melhoria significativa dos sintomas PsA (inchaço, dor, entesite, dactilites), funcionamento físico e qualidade de vida (SF36, HAQ-DI). As melhorias nos parâmetros relevantes foram mantidas até à semana 52 [23].
Perspectivas
Com os avanços da imunologia na compreensão da patogénese da psoríase, o desenvolvimento de medicamentos com maior selectividade e o reconhecimento da natureza sistémica da psoríase, a terapia tem melhorado. Ao mesmo tempo, tornou-se mais complicado. Em particular, a integração de produtos biológicos e pequenas moléculas no tratamento da psoríase grave levou a uma mudança de paradigma em dermatologia: A pele faz agora novamente parte de todo o corpo, que é igualmente afectada pela psoríase na área da psique, do sistema cardiovascular ou do sistema músculo-esquelético como o tegumento. Não menos importante devido aos ensaios clínicos com produtos biológicos, a atenção aos instrumentos de qualidade de vida como outra medida de sucesso do tratamento aumentou. Estamos extremamente curiosos em ver até que ponto o uso de produtos biológicos terá também um efeito favorável nas comorbilidades e na esperança de vida a longo prazo. Seja na clínica ou na prática dermatológica: os factores decisivos em cada caso individual são a indicação médica e a falta de alternativas terapêuticas genuínas mais baratas. A psoríase e a artrite psoriásica devem ser tratadas numa equipa constituída por dermatologistas, reumatologistas e clínicos gerais.
É de grande importância reconhecer tanto as manifestações cutâneas da psoríase como as comorbilidades da psoríase numa fase precoce e tratá-las eficazmente.
Literatura:
- Jemec GB, et al: Uma nova formulação de calcipotrieno mais betametasona em comparação com os seus ingredientes activos e o veículo no tratamento da psoríase do couro cabeludo. Um ensaio aleatório, duplo-cego e controlado. J Am Acad Dermatol 2008; 59: 455-463.
- Barbagallo J, et al: Fototerapia UVB de banda estreita para o tratamento da psoríase. Uma revisão e actualização. Cutis 2001; 68: 345-347.
- Saurat JH, et al: Estudo multicêntrico aleatório duplo-cego comparando acitretin-PUVA, etretinate-PUVA e placebo-PUVA no tratamento da psoríase grave. Dermatologica 1988; 177: 218-224.
- Heydendael VM, et al: Metotrexato versus ciclosporina em psoríase crónica moderada a severa. N Engl J Med 2003; 349: 658-665.
- Nyfors A: Benefícios e experiências adversas com drogas durante o tratamento prolongado com metotrexato de 248 psoriásicos. Dan Med Bull 1978; 25: 208-211.
- Trüeb RM: Recomendações de consenso methotrexate. Gebro Pharma 2008.
- van de Kerkhof PC, et al: O efeito da adição de pomada de calcipotriol (50 microgramas/g) à terapia de acitretino na psoríase. Br J Dermatol 1998; 138: 84-89.
- Gupta AK, et al: Perfil de efeito lateral da terapia da acitretina na psoríase. J Am Acad Dermatol 1989; 20: 1088-1093.
- Griffiths CE, et al: Limpeza da psoríase com ciclosporina em dose baixa. Br Med J (Clin Res Ed) 1986; 293: 731-732.
- Lowe NJ, et al: Terapia a longo prazo de baixa dose de ciclosporina para psoríase grave. Efeitos na função e estrutura renal. J Am Acad Dermatol 1996; 35: 710-719.
- Koo J: Um estudo aleatório e duplo-cego comparando a eficácia, segurança e dose óptima de duas formulações de ciclosporina, Neoral e Sandimmun, em doentes com psoríase grave. OLP302 Grupo de Estudo. Br J Dermatol 1998; 139: 88-95.
- Laburte C, et al: Eficácia e segurança da ciclosporina A oral (CyA; Sandimmun) para tratamento a longo prazo da psoríase crónica severa da placa. Br J Dermatol 1994; 130: 366-375.
- Altmeyer PJ, et al.: Efeito antipsoriásico dos derivados do ácido fumárico. Resultados de um estudo multicêntrico em dupla ocultação em 100 pacientes. J Am Acad Dermatol 1994; 30: 977-981.
- Gollnick H, et al: O calcipotriol tópico mais ácido fumárico oral é mais eficaz e de acção mais rápida do que a monoterapia com ácido fumárico oral no tratamento da psoríase crónica grave da placa vulgaris. Dermatologia 2002; 205: 46-53.
- Altmeyer P, Hartwig R, Matthes U: [Eficácia e perfil de segurança dos ésteres do ácido fumárico na terapia oral a longo prazo com psoríase vulgaris refractária severa. Um estudo de 83 pacientes]. Dermatologista 1996; 47: 190-196.
- Gottlieb AB, et al: Um ensaio aleatório do etanercept como monoterapia para a psoríase. Arch Dermatol 2003; 139: 1627-1632; discussão 32.
- Paller AS, et al: Tratamento Etanercept para crianças e adolescentes com psoríase em placas. N Engl J Med 2008; 358: 241-251.
- Leonardi CL, et al: Eficácia e segurança do ustekinumab, um anticorpo monoclonal interleucina-12/23 humano, em doentes com psoríase: 76 semanas de resultados de um ensaio aleatório, duplo-cego, controlado por placebo (PHOENIX 1). Lancet 2008; 371: 1665-1674.
- Papp KA, et al: Eficácia e segurança do ustekinumab, um anticorpo monoclonal interleucina-12/23 humano, em doentes com psoríase: 52 semanas de resultados de um ensaio aleatório, duplo-cego, controlado por placebo (PHOENIX 2). Lancet 2008; 371: 1675-1684.
- Langley RG, et al: Secukinumab em placa psoríase – resultados de dois ensaios da fase 3. N Engl J Med 2014; 371: 326-338.
- McInnes IB, et al: Eficácia e segurança do secukinumab, um anticorpo monoclonal totalmente humano anti-interleucina-17A, em doentes com artrite psoriásica moderada a grave: um ensaio de 24 semanas, aleatorizado, duplo-cego, controlado por placebo, fase II de prova de conceito. Ann Rheum Dis 2014; 73: 349-356.
- Papp K, et al.: Apremilast, um inibidor oral de fosfodiesterase 4 (PDE4), em doentes com psoríase de placa moderada a grave. Resultados de um ensaio fase III, randomizado e controlado (Efficacy and Safety Trial Evaluating the Effects of Apremilast in Psoriasis [ESTEEM] 1). J Am Acad Dermatol 2015; 73: 37-49.
- Schafer PH, et al: O impacto farmacodinâmico do apremilast, um inibidor da fosfodiesterase 4 oral, nos níveis circulantes de biomarcadores inflamatórios em doentes com artrite psoriásica. O subestudo resulta de um ensaio fase III, aleatório, controlado por placebo (PALACE 1). J Immunol Res 2015; 2015: 906349.
PRÁTICA DE DERMATOLOGIA 2016: 26(2): 10-16