Os sintomas vasomotores (VMS), tais como afrontamentos e suores estão entre os sintomas mais comuns da menopausa. A terapia hormonal menopausal (MHT) é a terapia mais eficaz. A decisão a favor ou contra o MHT baseia-se, entre outras coisas, na intensidade das queixas individuais, comorbidades, risco individual de certas doenças e na atitude pessoal em relação à menopausa e à terapia dos sintomas relacionados com a menopausa. Em 2015, as recomendações do SGGG sobre o MHT foram actualizadas.
Os fluxos quentes e a sudação (sintomas vasomotores, VMS) estão entre as queixas mais comuns durante a menopausa. A prevalência destas queixas é de até 50% na fase reprodutiva e perimenopausa e de até 80% na pós-menopausa. A duração média total do VMS frequente (ou seja ≥6 dias com VMS nas últimas duas semanas) é de 7,4 anos, e até mais de 11,8 anos para o início da pré e início da perimenopausa [1]. Os VMS são atribuídos à disfunção termoregulatória hipotalâmica devido à redução da actividade opióide central endógena [2] associada à menopausa, induzida pela deficiência de estrogénios.
Diagnósticos
Os diagnósticos básicos para VMS incluem história e laboratório:
- História médica: A mulher está na menopausa? (Amenorreia secundária durante doze meses); questionário relativo aos sintomas da menopausa, por exemplo, Escala de Classificação da Menopausa (MRS) II
- Laboratório: Existe hipergonadismo hipergonadotrópico? (FSH >40 IU/l com três medições em intervalos de algumas semanas; deficiência de estrogénio no E2 <30 pg/ml)
No diagnóstico diferencial de VMS, é feita uma distinção entre “fluxos húmidos” e “fluxos secos”, ou seja, se a sensação de calor também é acompanhada pela transpiração (Tab. 1) [3,4]. Assim, o diagnóstico diferencial inclui:
- Diagnósticos laboratoriais em soro ou sangue. sangue EDTA: FSH, estradiol, progesterona, TSH, fT3, fT4, anti-TPO, TRAK, hemograma diferencial, transaminases, Crea-
- estanho, potássio, açúcar no sangue em jejum, culturas de sangue se necessário, teste HIV, teste TINE, triptase, VIP (peptídeo intestinal vasoactivo), calcitonina
- Diagnósticos laboratoriais na recolha de urina 24 horas: 5-Hy-
- ácido droxiindoleacético (5-HIAA), catecolaminas (adrenalina, noradrenalina) ou metabolitos de catecolaminas (metanefrinas, normetanefrina), metilhistamina ou ácido 1,4-metilimidazoleacético.
- Se necessário, imagiologia: tórax radiográfico, tórax tomográfico, sonografia renal
- Biopsia à medula óssea, se necessário.

Terapia
A terapia hormonal convencional da menopausa (MHT), a medicina alternativa e complementar e a farmacoterapia não hormonal estão disponíveis para o tratamento da VMS. A seguir, o MHT será discutido mais detalhadamente, uma vez que em 2015 a carta de peritos sobre MHT foi actualizada pela Sociedade Suíça de Ginecologia e Obstetrícia (SGGG) [5].
Terapia hormonal menopausal (MHT)
Indicação, dosagem e forma de aplicação: MHT convencional significa a utilização de estrogénios, progestagénios e, com restrições, andrógenos. As indicações para a MHT sistémica são VMS. Outros sintomas associados à menopausa também podem ser melhorados ou eliminados, tais como perturbações do sono, humor depressivo, redução do desempenho e da memória, sintomas ósseos e articulares, alterações na visão, pele e membranas mucosas, e queda de cabelo.
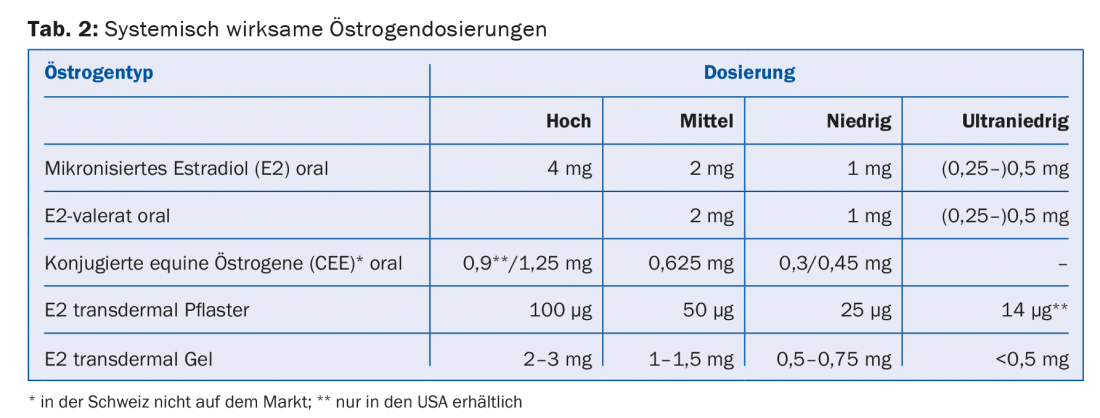
Os estrogénios sistemicamente activos estão disponíveis em diferentes dosagens (alta, média, baixa e ultra-baixa) e formas de aplicação (comprimidos, gel, patch) (tab. 2). Nas mulheres com útero, é indicada a administração adicional de um progestogénio para protecção endometrial. Alternativamente, está disponível a entrega directa de um progestagénio através de um DIU (Mirena®). Tanto a dose de estrogénio como a dose de progestogénio devem ser escolhidas tão baixa quanto possível. Contudo, no caso da menopausa prematura (<40 anos de idade) e da menopausa precoce (<45 anos de idade), a reposição hormonal “real” deve ser continuada até pelo menos 51 anos de idade. Cada MHT deve ser reavaliada anualmente. Não é necessário e razoável limitar arbitrariamente a duração de aplicação do MHT.
Contra-indicações: Contra-indicações absolutas à MHT são gravidez, hemorragia vaginal inexplicada, carcinoma mamário e endometrial, e tromboembolismo arterial e venoso. As contra-indicações relativas incluem doença hepática aguda, disfunção hepática grave crónica, cálculos biliares, certas perturbações lipometabólicas, hipertensão e enxaqueca.
Benefícios adicionais do MHT
Prevenção de fracturas: o MHT reduz significativamente o risco de fracturas relacionadas com a osteoporose em todos os locais em 25-40%. Em mulheres com um risco aumentado de fractura, a MHT é portanto uma terapia de primeira escolha mesmo em casos assintomáticos. Faltam dados de fracturas para preparações MHT de dose baixa e ultra-baixa. Não se recomenda iniciar a MHT com o único objectivo de prevenir fracturas após os 60 anos de idade. Em contraste, só a MHT individualizada para a prevenção da fractura pode continuar para além dos 60 anos de idade, desde que os potenciais benefícios e riscos a longo prazo em comparação com as terapias não-hormonais alternativas sejam considerados. O tratamento específico é indicado para osteoporose manifesta (com fractura).
Doença coronária (CHD): A monoterapia com dose média de estrogénio reduz significativamente o risco de CHD e mortalidade por todas as causas em mulheres que iniciam a MHT aos 60 anos de idade <ou dentro de dez anos da menopausa (“janela favorável”). Uma administração combinada de estrogénio-progestogénio com início dentro da janela favorável mostra um efeito neutro a positivo dependendo do progestogénio utilizado. A prevenção cardiovascular primária por si só não é uma indicação para a MHT. O MHT para prevenção secundária e na presença de CHD sintomática está contra-indicado.
Riscos de MHT
Eventos cerebrovasculares (IVC): O risco adicional de AVC isquémico atribuível à MHT aumenta com a idade sob MHT oral. Não existe tal coisa como uma “janela barata”. O risco absoluto permanece baixo nas mulheres <60 anos na Women’s Health Initiative (WHI) [6] e em grandes estudos observacionais com um a dois casos por cada 10.000 mulheres-anos. Após os 60 anos de idade, o risco de CVI pode atingir significado com a MHT oral. O risco é menor sob MHT transdérmica em doses baixas a médias. Assim, o estrogénio transdérmico deve ser preferido para as mulheres com maior risco de IVC de base.
Tromboembolismo venoso (VTE): Não há “janela favorável”. Sob MHT, o risco adicional de VTE com CEE mais acetato de medroxiprogesterona (MPA) no grupo etário dos 50-59 anos é de 11 e só com CEE quatro casos por 10.000 mulheres-anos (WHI). O maior risco é encontrado nos primeiros meses após o início da terapia. Sob MHT transdermal em dose baixa a média, o risco é menor ou não é aumentado. A duração da utilização e o tipo/dosagem do progestogénio podem influenciar o risco de VTE em combinação com estrogénios. O risco parece ser menor com progesterona micronizada e dydrogesterone do que com progesterona sintética.
Sistema nervoso central: As consequências a longo prazo do MHT começaram na peri- ou na pós-menopausa precoce por cognição e demência ainda são largamente desconhecidas. O MHT começou tarde (>65 anos de idade) poderia ter um efeito desfavorável na cognição. O MHT começou em torno da menopausa e continuou durante até dez anos pode estar associado a um risco reduzido de AD.
Carcinoma da mama: No que diz respeito ao risco de carcinoma da mama, deve ser feita uma distinção entre monoterapia com estrogénio e terapia com estrogénio-progestogénio. Segundo o estudo WHI, o risco de cancro da mama e a mortalidade por cancro da mama não são significativamente reduzidos nas mulheres histerectomizadas durante sete anos de terapia apenas com a CEE. Nos estudos WHI, Danish Osteoporosis Prevention Study (DOPS) [7] e Nurses’ Health Study (NHS) [8], a monoterapia com estrogénios não mostrou consistentemente qualquer aumento no risco de incidência e mortalidade por cancro da mama até um período de observação cumulativo de 13, 16 e 19 anos, respectivamente. Com monoterapia de estrogénio ≥20 anos, observou-se um aumento do risco de cancro da mama em mulheres com peso normal mas não em mulheres obesas e com excesso de peso.
A situação é diferente com a terapia estrogénio-progestão. Sob CEE + MPA, o risco de cancro da mama não aumenta nos primeiros utilizadores nos primeiros 5,6 anos de tratamento. Depois disso, o risco começa a aumentar. Sob CEE + MPA, foram observados mais nove casos por cada 10.000 anos de cancro da mama invasivo no WHI do que no grupo de controlo após um período de observação cumulativo de 13 anos. Em contraste, sob E2 + acetato de noretisterona (NETA) no DOPS, o risco de cancro da mama não aumentou dentro do período de observação de 16 anos. A progesterona micronizada e a dydrogesterona em combinação com um estrogénio podem estar associadas a um risco inferior ao dos progestogénios sintéticos. A extensão do aumento do risco sob terapia combinada de estrogénio-progestogénio depende assim do tipo de progestogénio utilizado e da duração da utilização.
Mortalidade
Meta-análises, ensaios controlados aleatorizados e estudos observacionais mostram uma redução da mortalidade por todas as causas quando os participantes do estudo receberam monoterapia com doses intermédias de estrogénio antes dos 60 anos de idade ou dentro dos primeiros dez anos pós-menopausa (“janela favorável”). No DOPS, a mortalidade por todas as causas não diminuiu significativamente sob E2 e sob E2 + NETA. Pelo contrário, em linha com outros estudos, o SNS mostra que a ovariectomia profiláctica bilateral está associada ao aumento da mortalidade a longo prazo em mulheres com menos de 50 anos. Após 13 anos (WHI) ou 16 anos (DOPS) de observação, a mortalidade cardíaca e a mortalidade por cancro da mama foram significativamente reduzidas sob monoterapia com estrogénios, para além da mortalidade por todas as causas.
Influência sobre outros riscos
No WHI, como no estudo do BCDDP, foi encontrada uma redução significativa do cancro do cólon com administração combinada CEE/MPA oral, mas não com monoterapia CEE oral. O MHT transdérmico não parece reduzir a incidência de cancro do cólon. Não há provas epidemiológicas de uma alteração do risco de carcinoma brônquico ou da vesícula biliar devido ao MHT. Por outro lado, a MHT oral (mas não transdérmica) aumenta o risco de colelitíase e colecistectomia.
Literatura:
- Avis NE, et al: Duração dos sintomas vasomotores da menopausa durante a transição da menopausa. JAMA Intern Med 2015; 175(4): 531-539.
- Freedman RR: Afrontamentos: tratamentos comportamentais, mecanismos, e relação com o sono. Am J Med 2005; 118 Suppl 12B: 124-130.
- von Wolff M, Stute P: Gynaecological Endocrinology and Reproductive Medicine: The Practice Book. 1 ed. Schattauer GmbH, Stuttgart 2013.
- Fazio SB: Abordagem à descarga em adultos. Actualizado em 2015.
- Birkhäuser M, et al.: Recomendações actuais sobre terapia hormonal menopausal (MHT). Carta de peritos nº 42. Sociedade Suíça de Ginecologia e Obstetrícia 2015.
- Manson JE, et al: Terapia hormonal menopausal e resultados de saúde durante as fases de intervenção e pós-paragem prolongada da Women’s Health Initiative ensaios aleatorizados. JAMA 2013; 310(13): 1353-1368.
- Schierbeck LL, et al: Effect of hormone replacement therapy on cardiovascular events in recently postmenopausal women: randomised trial. BMJ 2012; 345: e6409.
- Chen WY, et al: Terapia de estrogénio sem oposição e o risco de cancro da mama invasivo. Arch Intern Med 2006; 166(9): 1027-1032.
PRÁTICA DO GP 2016, 11(2): 14-17