Ablação por cateter da fibrilação atrial paroxística sintomática é uma modalidade de tratamento estabelecida com boas perspectivas de sucesso e baixo risco. O isolamento das veias pulmonares continua a ser a base de uma ablação bem sucedida do cateter. Contudo, numa proporção de pacientes com fibrilação atrial, é encontrada uma doença fibrótica atrial independente, que fornece o substrato para a manutenção da fibrilação atrial. Isto aplica-se em particular (mas não exclusivamente) a pacientes com fibrilação atrial persistente. Esta percepção abriu o caminho para conceitos individualizados de ablação para alcançar uma estabilização a longo prazo do ritmo sinusal mesmo nesta desafiante população de pacientes. O tratamento específico dos “moduladores” de fibrilação atrial (ou seja, favorecer factores como a hipertensão arterial, obesidade, apneia do sono, diabetes, etc.) deve ser realizado no futuro numa base interdisciplinar.
Ablação por cateter de fibrilação atrial (FA) tornou-se um procedimento de rotina com bons resultados clínicos. As taxas de sucesso a longo prazo são actualmente de 80-90% para a fibrilação atrial paroxística (PAF) e 50-60% para a fibrilação atrial persistente (PersAF) [1,2].
A ablação de cateteres pode melhorar significativamente a qualidade de vida dos pacientes. Além disso, os estudos não só demonstram a superioridade da ablação do cateter sobre os medicamentos antiarrítmicos no que diz respeito à recorrência do FVC, mas agora também fornecem provas de que a ablação pode influenciar o prognóstico de AVC isquémico e mortalidade [3].
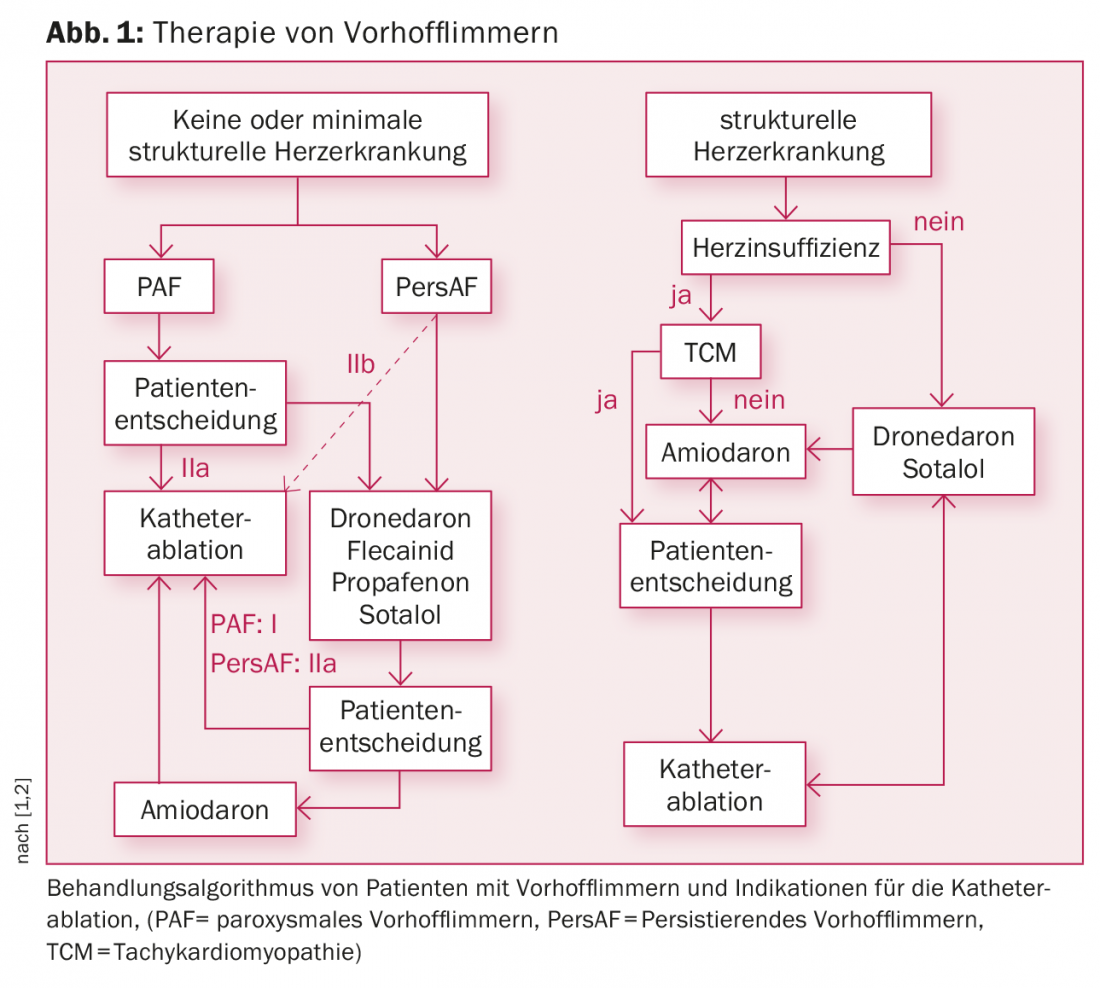
Dependendo da utilização ou não de medicamentos antiarrítmicos, as directrizes actuais listam uma indicação de classe I ou IIa para PAF e uma indicação IIa ou IIb para persAF (Fig. 1) [1,2]. Especialmente para PAF, a ablação de cateteres já é utilizada como terapia de primeira linha.
A fisiopatologia do FVC não-valvular tem sido objecto de investigação intensiva nos últimos anos, e o nosso conhecimento do contexto fisiopatológico tem sido significativamente alargado.
O papel dos gatilhos
Haissaguerre e colegas de trabalho descreveram pela primeira vez o papel dos desencadeadores das veias pulmonares (VP) no início do FCR há quase duas décadas [4]. Esta observação lançou as bases para o desenvolvimento do isolamento das veias pulmonares (IVP) como uma estratégia de tratamento potencialmente curativa. Desde então, esta tem sido a principal pedra angular da ablação do FCR por cateter. Raramente, os gatilhos não-VP desempenham um papel na iniciação. Alguns destes últimos podem ter origem no ouvido atrial esquerdo, seio coronário ou septo interatrial.
O isolamento das veias pulmonares
A PVI é parte integrante de qualquer ablação do FVC por cateter e pode ser obtida utilizando uma variedade de ferramentas e técnicas (Fig. 2 A-C).
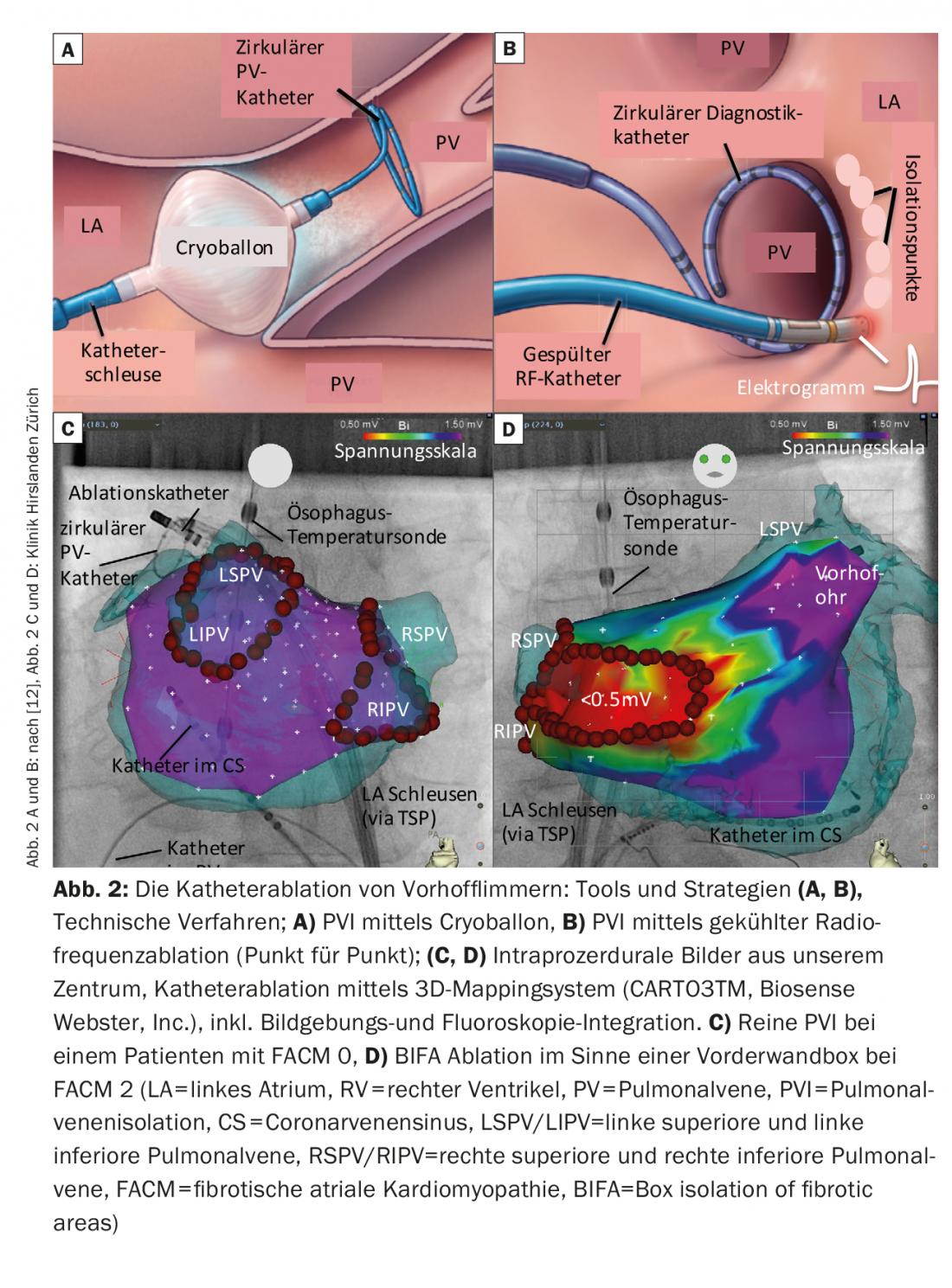
A forma de energia com que a maior parte da experiência está disponível em todo o mundo é a corrente de alta-frequência (= radiofrequência, RF). Uma linha circunferencial é normalmente criada em torno da PV ipsilateral por ablação ponto a ponto sobre a ponta do cateter. O isolamento eléctrico é normalmente verificado pelo uso periprocedural de cateteres cartográficos circulares. São frequentemente utilizados sistemas de cartografia electroanatómica ou técnicas de imagem para integração de imagens (TC, RM, ultra-som intracardíaco). Estes facilitam a navegação dentro do átrio, contribuem para a segurança da intervenção e reduzem os tempos de fluoroscopia. A sustentabilidade das lesões de ablação também melhorou com tecnologias físicas tais como câmaras de ar navegáveis, várias técnicas de lavagem de cateteres e, em particular, a medição da pressão de contacto dos cateteres. A taxa de recuperação de linhas fotovoltaicas poderia ser reduzida como resultado.
Alternativamente, para além da ablação RF, a ablação de criobalão em particular está a ser utilizada cada vez mais frequentemente hoje em dia. Os 4 PV são isolados individualmente, e a fluoroscopia com a ajuda de injecções de contraste é utilizada para avaliar uma posição óptima do balão. Os balões são muitas vezes mais fáceis de manusear, mas têm a limitação de que o diagnóstico/terapia detalhada de arritmias consecutivas ou a análise de electrogramas atriais esquerdos fora da PV não é possível durante o procedimento.
Muito raramente, a energia laser é utilizada para PVI. A experiência a este respeito é ainda limitada.
Na PAF, resultados muito bons a longo prazo podem normalmente ser alcançados com apenas um procedimento usando PVI puro. Em contraste, apesar dos avanços técnicos e estratégicos, as taxas de sucesso do persAF são limitadas, mesmo após múltiplos procedimentos. As recidivas após a ablação nem sempre podem ser explicadas pela recuperação da condução PV.
O substrato atrial esquerdo
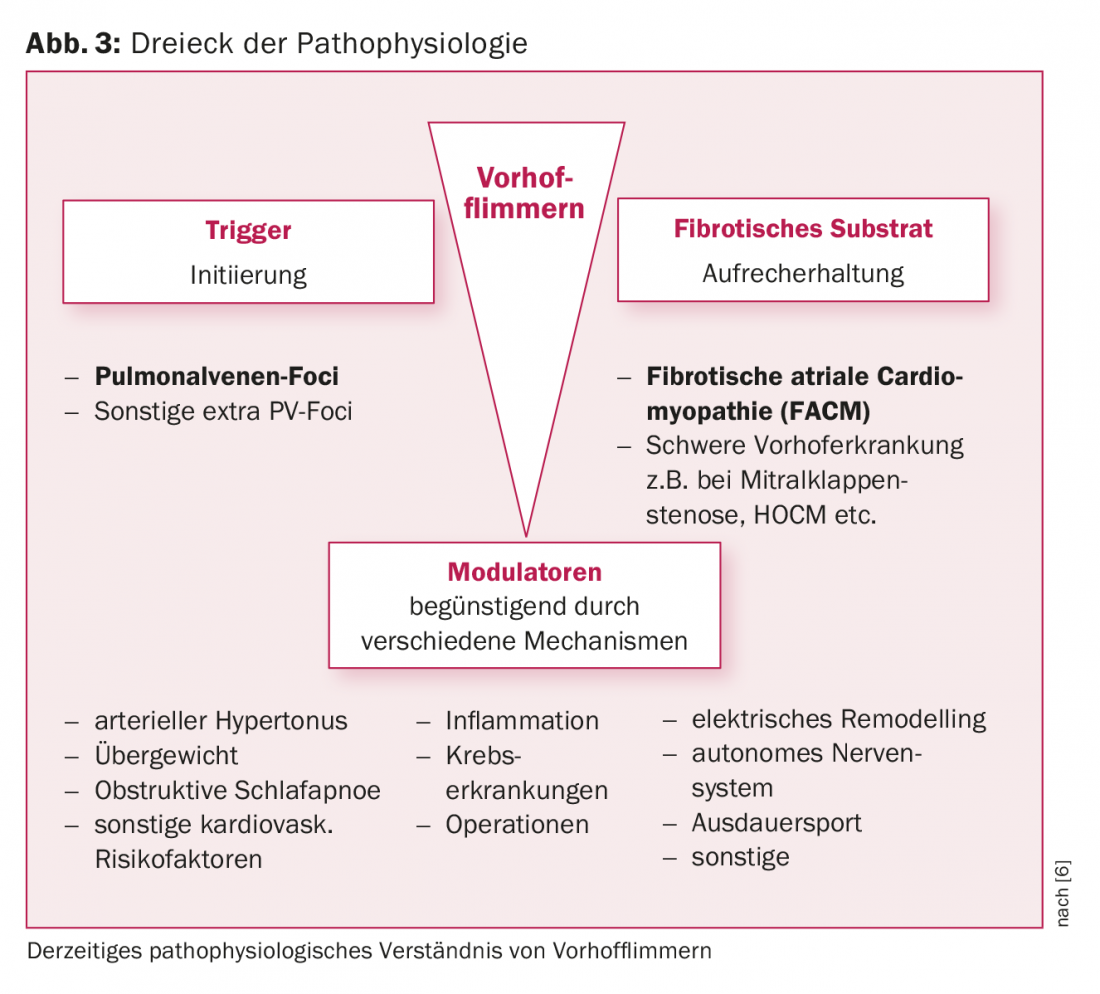
A presença de fibrose atrial esquerda é um achado patológico típico em doentes com FVC. Este substrato atrial esquerdo desempenha um papel crucial na manutenção do FCR. Esta última pode desenvolver-se com base numa doença cardíaca estrutural significativa (por exemplo, estenose da válvula mitral, HOCM) ou pode existir sob a forma de doença atrial independente. O termo cardiomiopatia atrial fibrótica pré-existente (FACM) tornou-se estabelecido nos últimos anos [5, 6] (Fig. 3, 4). Estudos experimentais mostraram que os processos de remodelação estrutural fibrótica levam a uma situação anisotrópica eléctrica (alteração das velocidades de condução, períodos refractários, contactos celulares), o que favorece a manutenção do FCR. Sabemos agora que as taxas de sucesso da ablação dependem significativamente da extensão da fibrose atrial subjacente.
A criação de um mapa de voltagem bipolar durante o procedimento pode mapear bem este substrato atrial esquerdo (as áreas saudáveis são roxas codificadas por cores, as áreas altamente fibróticas <0,5 mV vermelho).
O nosso centro divide agora o FACM em 5 fases, dependendo do grau de gravidade (Fig. 4) (FACM 0: sem áreas significativas de baixa tensão no mapa de tensão, FACM 1: fibrose local de menor extensão, FACM 2: áreas de fibrose maior e confluente, FACM3: fibrose atrial pronunciada, mas ainda limitada regionalmente, FACM 4: fibrose quase ubíqua).
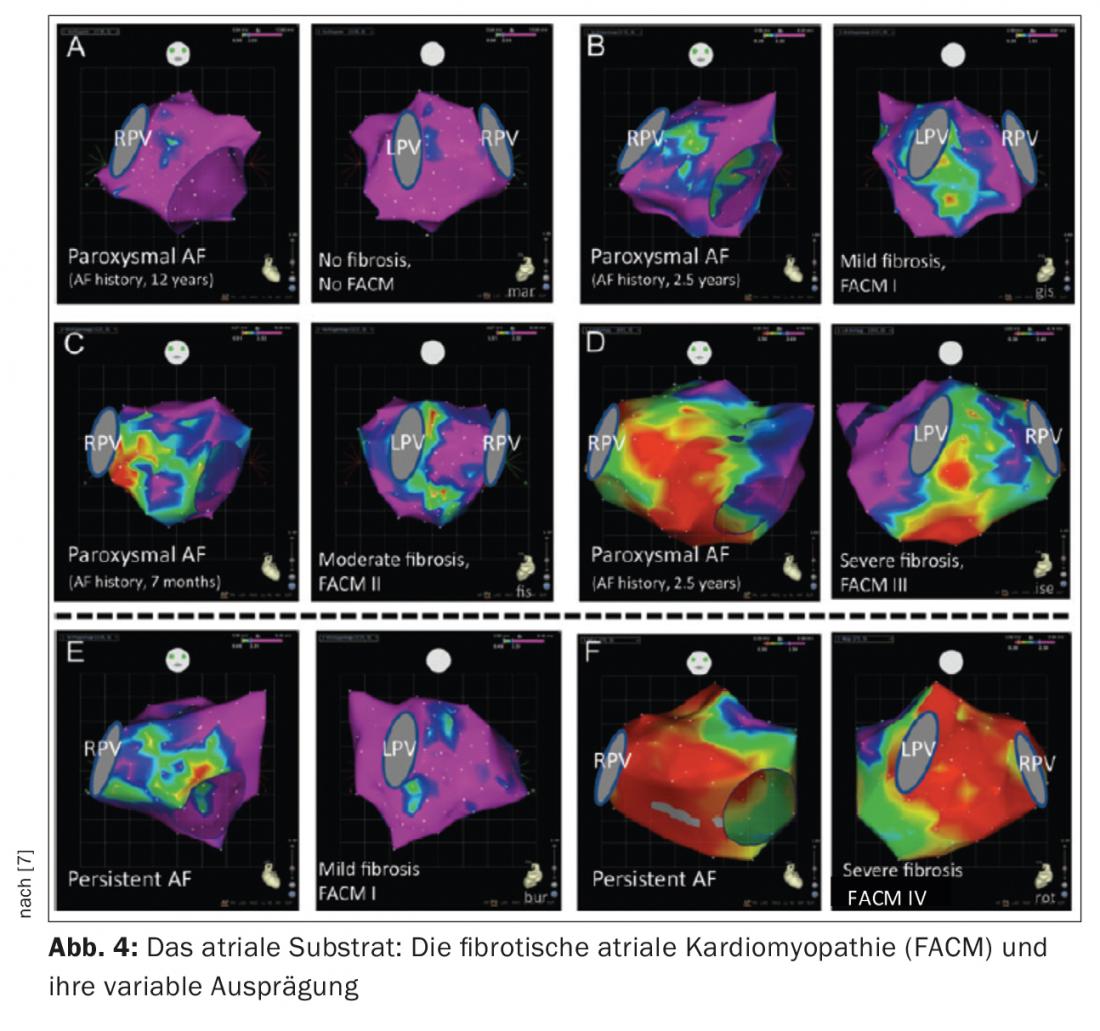
Há muito que se assumiu que a duração e magnitude dos episódios de fibrilação atrial fornecem o estímulo crítico para a remodelação fibrótica dos átrios (“FA gera FA”). Entretanto, existem dúvidas sobre esta teoria. Isto porque foi demonstrado que tanto pacientes com PAF como com persAF podem ter doenças atriais significativas. Nos nossos pacientes, as áreas de fibrose podem ser detectadas em quase 20% dos pacientes com PAF e em 70% dos pacientes com persAF.
Métodos anteriores e novos métodos individualizados para modificação do substrato
A PVI só é bem sucedida em pouco menos de 50% dos doentes com persAF. No entanto, as estratégias de ablação anteriores que vão além da PVI (por exemplo, ablação de electrogramas fraccionados complexos, os chamados CFAE, ou criação de linhas, ou uma combinação de ambos) não contribuíram para qualquer melhoria significativa dos resultados da ablação. Este último foi comprovado, em particular, pelo estudo prospectivo multicêntrico STAR AF II [1,8].
Por conseguinte, foram desenvolvidos conceitos de ablação individualizada, que (para além da PVI) têm em conta os patomecanismos subjacentes ao FCR.
Por um lado, de um ponto de vista funcional, os “rotores” atriais têm vindo a concentrar-se nos últimos 5 anos. Novas técnicas de cartografia electrofisiológica permitem identificar estes “motores” do FCR utilizando um cateter multi-electrodo em forma de cesto, ou mais raramente de forma não invasiva através de “cartografia da superfície corporal”, e torná-los acessíveis para a ablação direccionada. No entanto, o valor clínico, especialmente em pacientes com persAF, necessita de mais investigação. Os resultados da ablação são controversos [9].
Por outro lado, existem hoje conceitos de ablação que se centram nas mudanças estruturais, ou seja, na fibrose atrial esquerda. O isolamento das áreas fibróticas (BIFA), que vai além das IVP circunferenciais, é uma dessas estratégias desenvolvidas no nosso centro (Fig. 2B). Com base num mapa de tensão criado pelo átrio em ritmo sinusal, as áreas fibróticas, ou seja, “áreas de baixa tensão” (<0,5 mV) estão isoladas electricamente. O objectivo é eliminar as áreas atriais doentes e, portanto, o substrato potencialmente arritmogénico.
Apesar de uma população de doentes difícil, o conceito BIFA alcança bons resultados de ablação com taxas de sucesso iniciais de 1 ano cerca de 85% com apenas 1,2 procedimentos por doente [10].
Devido à expressão altamente variável do FACM, um conceito de ablação óptima pode ser escolhido individualmente durante o procedimento. Os procedimentos de imagem como método preliminar de rastreio ainda estão actualmente a ser testados. Em doentes sem FACM detectável (FACM 0), só a PVI parece suficiente mesmo em persAF. Aqui, há uma boa probabilidade de prognóstico de preservação a longo prazo do ritmo sinusal (80-90%) com apenas 1,2 procedimentos/paciente [10]. A ablação do cateter é muito mais exigente em doentes com doenças atriais existentes. A medida em que os pacientes com o grau mais elevado de fibrose atrial (FACM 4) podem beneficiar da ablação do cateter a longo prazo ainda não foi conclusivamente esclarecida.
Moduladores de fibrilação atrial
Vários factores de risco clínico (idade, hipertensão, obesidade, apneia do sono, diabetes, álcool, etc.) promovem a ocorrência de FCR. Certas circunstâncias concomitantes tais como inflamação/infecção ou um ambiente perioperatório também favorecem as recorrências da arritmia (Fig. 3).
Nos últimos anos, foi demonstrado que o tratamento direccionado com os chamados “moduladores de fibrilação atrial” tem um efeito positivo. Por exemplo, o grupo de investigação australiano liderado pela Sanders conseguiu demonstrar que o tratamento orientado dos factores de risco clínico leva a uma redução dos sintomas associados ao FCR, causa remodelação cardíaca e pode mesmo melhorar significativamente os resultados da ablação do cateter [11].
A gestão do factor de risco deve, portanto, ser uma componente essencial do controlo do ritmo na prática, não só antes mas também após a ablação do cateter. O tratamento interdisciplinar de pacientes com FCR é, portanto, desejável.
Complicações
As potenciais complicações da ablação por cateter do FVC dependem das tecnologias e estratégias de ablação utilizadas e da experiência do investigador.
A taxa global de complicações é de aproximadamente 4-5%, sendo as complicações vasculares periféricas associadas ao acesso à virilha responsáveis por aproximadamente metade [1,12,13]. As complicações graves são raras.
As efusões/tamponadas pericárdicas são relatadas em 1-2,5% dos casos, com taxas ligeiramente inferiores de 0,5% para os criobalões. O risco de complicações cerebrovasculares (AIT/acidente vascular cerebral) foi reduzido nos últimos anos por medidas como a exclusão de trombos pré-intervencionais por meio de ecocardiografia transoesofágica, heparinização periprocedural (ACT-guia), bem como lavagem contínua de cateteres/dutos, sendo agora de apenas cerca de 0,5%.
As estenoses fotovoltaicas como efeito térmico da ablação praticamente já não ocorrem actualmente devido às novas estratégias de ablação fora das áreas dos orifícios fotovoltaicos e são relatadas na literatura como sendo de 0-0,3%.
A paresia diafragmática é uma complicação rara mas típica da ablação do criobalão (2-5%). No entanto, muitas vezes é apenas detectável temporariamente, de modo que após 3 meses é apenas descrito em 0,2% dos casos. Uma complicação extremamente rara mas potencialmente fatal é a ocorrência de uma fístula atriooesofágica (relatórios de casos isolados ou aproximadamente 0,04%). As medidas profilácticas a este respeito são claramente recomendadas: Reduções de energia na parede posterior do átrio e utilização de sondas de temperatura de esófago que detectam temperaturas excessivamente altas ou baixas durante a ablação.
Um olhar sobre o futuro
O FCR é uma doença complexa e heterogénea. A ablação do cateter pode tratar eficazmente uma grande proporção de pacientes e estabelecer um ritmo sinusal estável a longo prazo. Contudo, a gravidade da doença atrial subjacente, que nem sempre está correlacionada com a aparência clínica (PAF vs. persAF), é de importância decisiva para o prognóstico a longo prazo.
Os conceitos individualizados de ablação “à medida” são, portanto, cruciais para alcançar os melhores resultados. Novos diagnósticos, idealmente de alta resolução e técnicas de cartografia automatizada durante a ablação do cateter dar-nos-ão mais informações, especialmente sobre os mecanismos de manutenção do FCR. Além disso, a importância das técnicas de imagem aumentará (por exemplo, análises de eco específicas tais como estirpes, MRIs cardíacas, etc.) com o potencial de decidir sobre terapias adequadas ou conceitos específicos de ablação antes do procedimento. Além disso, os biomarcadores (por exemplo, marcadores da matriz ex-tracelular) ou predisposições genéticas conhecidas poderiam fornecer pistas sobre a extensão e progressão do substrato atrial a médio prazo.
Literatura:
- Calkins H, et al: HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation: recomendações para selecção de doentes, técnicas processuais, gestão e acompanhamento de doentes, definições, pontos finais e concepção de ensaios de investigação. Europace. 2012; Abril;14(4): 528-606.
- Kirchhof P, et al.: 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS: The Task Force for the management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESCEndorsed by the European Stroke Organisation (ESO). Europace. 2016 Ago 27 [Epub].
- Friberg L, et al: ablação do cateter para fibrilação atrial está associada a menor incidência de AVC e morte: dados dos registos de saúde suecos. Eur Heart J. 2016; Mar 16. pii: ehw087. [Epub ahead of print]
- Haïssaguerre M, et al. Iniciação espontânea da fibrilação atrial por batimentos ectópicos originários das veias pulmonares. N Engl J Med. 1998; Sep 3;339(10): 659-66.
- Kottkamp H, et al: Ablação por cateter da fibrilação atrial: como modificar o substrato? J Am Coll Cardiol. 2015; Jan 20;65(2): 196-206.
- Kottkamp H, et al.: O Substrato na Arritmia Atrial por Fibrilação “Precoce Persistente” Induzida, Induzida por Factor de Risco, ou de uma Cardiomiopatia Atrial Fibrótica Específica? JACC CEP 2016; 2: 140-142.
- Kottkamp H: Substrato de fibrilação atrial humana: para uma cardiomiopatia atrial fibrótica específica. Eur Heart J. 2013; Sep;34(35):2731-8.
- Verma A, Jiang CY, et. al.: STAR AF II Investigadores. Abordagens à ablação de cateteres para fibrilação atrial persistente. N Engl J Med. 2015; 7;372(19) de Maio: 1812-22.
- Guillem MS, Climent AM, et al: Presença e estabilidade de rotores na fibrilação atrial: provas e implicações terapêuticas. Cardiovasc Res. 2016, 109(4): 480-92. [Epub].
- Kottkamp H, et. al.: Box Isolation of Fibrotic Areas (BIFA): Uma Abordagem de Modificação do Substrato de Ablação de Fibrilhação Atrial por Paciente-Emissor. J Cardiovasc Electrophysiol. 2016; Jan27(1):22-30
- Pathak RK, et al: Estudo de redução agressiva do factor de risco para a fibrilação atrial e implicações para o resultado da ablação: o estudo de coorte ARREST-AF. J Am Coll Cardiol 2014;64: 2222-2231.
- Kuck KH, et al: Cryoballoon or Radiofrequency Ablation for Paroxysmal Atrial Fibrillation (Ablação por Criobalão ou Radiofrequência para Fibrilação Atrial Paroxística). N Engl J Med. 2016; 374: 2235-45.
- Shah RU, et al: Complicações processuais, e repetição de procedimentos Após a ablação do cateter para Fibrilação Atrial. J Am Coll Cardiol 2012; 59: 143-9.
CARDIOVASC 2016; 15(6): 3-8