Para certos tipos de tumores e para tumores malignos com carcinomatose peritoneal limitada, é possível prosseguir uma abordagem curativa mesmo nesta fase da doença, combinando a cirurgia citoreducativa e a quimioterapia hipertérmica intraperitoneal (CRS/HIPEC). Contudo, a indicação deve ser feita de forma muito cuidadosa e selectiva. Para a avaliação definitiva da ressecabilidade em tumores malignos, a laparoscopia é geralmente recomendada. Nos tumores apêndices, carcinoma do cólon e mesotelioma peritoneal primário mésothéliome, a sobrevivência de 5 anos pode ser aumentada pelo CRS/HIPEC.
A carcinomatose peritoneal é uma manifestação tumoral avançada de muitos tumores gastrointestinais, por exemplo do apêndice, cólon, estômago ou ovário, mas também de tumores do sistema hepatobiliar e do pâncreas. Os tumores peritoneais primários, tais como os mesoteliomas peritoneais primários originários do mesotelium do peritoneu, são extremamente raros. Alguns tipos de tumores, por exemplo os tumores apendicóides de baixo malignidade, são progressivos mas geralmente lentos e limitados ao abdómen; a carcinomatose no carcinoma pancreático ou gástrico, por outro lado, é rápida, envolve normalmente o compartimento linfático e é frequentemente resistente à terapia. A gama de tipos de tumores primários e subtipos histológicos adicionais (por exemplo, diferenciação de células intestinais ou de células signet-ring) não permite, portanto, uma generalização das opções terapêuticas e das indicações correspondentes.
Princípio e indicação da cirurgia citoreducativa
A abordagem à cirurgia citoreducativa e à quimioterapia hipertérmica intraperitoneal (CRS/HIPEC) é curativa e não paliativa. É portanto obrigatória uma indicação rigorosa e cuidadosa. Em tumores malignos, a terapia é adequada para a carcinomatose precoce ou limitada e não é muito útil como última opção. A confiança na cooperação interdisciplinar e nos conceitos desenvolvidos em conjunto são, portanto, essenciais para o planeamento terapêutico. Também é importante conhecer a biologia do tumor; por exemplo, a carcinomatose em tumores do fígado, ductos biliares ou pâncreas não é uma indicação para intervenção cirúrgica. CRS/HIPEC é razoável para a terapia da carcinomatose peritoneal limitada em tumores do apêndice, cólon e mesotelioma peritoneal primário; CRS/HIPEC também é concebível no carcinoma ovariano e altamente selectivo no cancro gástrico.
HIPEC é utilizado para tratar células tumorais livres ou microscópicas que permanecem no peritoneu após cirurgia radical, completando assim o resultado da intervenção cirúrgica. O termo “quimioterapia” não é realmente apropriado, apesar das substâncias utilizadas, visto que o HIPEC provavelmente só completa o resultado macroscópico da cirurgia a um nível microscópico.
De acordo com a abordagem curativa, uma laparoscopia é geralmente necessária para a avaliação definitiva da resectabilidade, por vezes também uma laparotomia exploratória. A extensão da carcinomatose peritoneal é determinada através do “Índice de Câncer Peritoneal” (PCI) [1]. O abdómen é dividido em 13 quadrantes e a cada um é atribuído um valor entre 0 e 3. A decisão de ressecção só é tomada se isto puder ser realizado radicalmente (citoredução completa [CC]- pontuação 0, sem tumor macroscopicamente visível). Em relação ao prognóstico a longo prazo, a ICP não deve exceder um valor máximo para certos tipos de tumores. A contra-indicação para a citoredução e, portanto, também para HIPEC é frequentemente uma infestação tumoral pronunciada do intestino delgado, o que pode tornar impossível a ressecção radical. Em tais casos, a cirurgia deve ser interrompida, pois não se justifica que, com o prognóstico (pobre) esperado, a qualidade de vida seja diminuída pela deficiência pós-operatória.
Aspectos técnicos
Se for tomada a decisão de ressecar, o peritoneu afectado pelo tumor é removido (peritonectomia). As ressecções de órgãos são realizadas com parcimónia e apenas em caso de envolvimento de tumores. A excepção são ressecções oncológicas se o tumor primário (por exemplo, na área do cólon ou apêndice) não tiver sido removido antes. Uma ressecção é considerada completa se já não houver tumor visível (CC-score 0), só então é realizada a HIPEC. A aplicação directa intra-abdominal dos fármacos citostáticos atinge concentrações elevadas na cavidade abdominal, enquanto a exposição sistémica permanece baixa. O aquecimento simultâneo da solução transportadora quimioterápica (líquido de diálise) a 42°C melhora a penetração e parcialmente o efeito citotóxico dos fármacos citostáticos [2]. São utilizadas principalmente combinações de mitomicina C e doxorubicina, cisplatina, oxaliplatina e, por vezes, docetaxel. As temperaturas variam entre os 41° e os 43°. A aplicação tem lugar durante 30-90 minutos, dependendo das substâncias utilizadas.
Efeitos secundários
A morbilidade do procedimento depende principalmente da extensão da citoredução. A insuficiência renal devida à HIPEC é extremamente rara, especialmente com um bom controlo da diurese intra-operatória. A taxa de hemotoxicidade induzida por citostáticos é também baixa. Um estudo multicêntrico francês [3] e uma revisão sistemática da literatura actual [4] mostram uma taxa de complicações pós-operatórias de aproximadamente 30% e uma taxa de mortalidade de 3-5% com experiência adequada. Os factores de risco significativos na análise multivariada do estudo francês foram a idade do paciente, a ICP e a extensão da ressecção associada, e a experiência do centro [3,5]. HIPEC causa uma paralisia intestinal algo prolongada em quase todos os pacientes, pelo que são inicialmente alimentados parenteralmente.
Indicação especial e resultados de acordo com o tipo de tumor
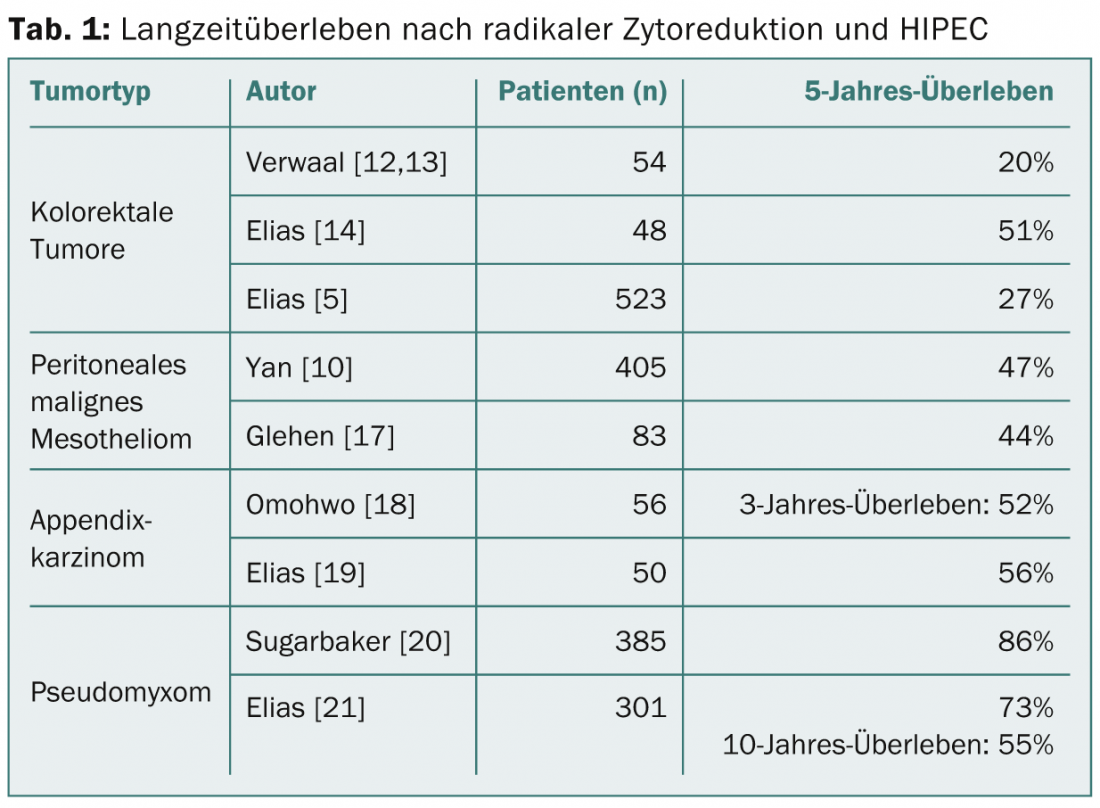
Pseudomixoma e tumores apendiceos: Os tumores apêndices mostram uma grande variação nos tipos histológicos. A carcinomatose peritoneal pode ser muito pobre em células e/ou rica em mucina, mas também se encontram carcinomas de células tetranianas, adenocarcinomas e carcinomas do anel sinete, aumentando a agressividade por essa ordem. A manifestação sob a forma de massas mucosas pobres em células e pouco malignas (adenomucinose peritoneal disseminada, DPAM) corresponde ao pseudomixoma clássico. Nesta doença, uma sobrevivência de 5 anos de 85% pode ser alcançada pelo CRS/HIPEC (Tab. 1) [6]. Estes excelentes resultados ainda são evidentes ao longo de 10-20 anos [7]. Para tumores ricos em células (carcinomatose da mucosa peritoneal, PMCA), a sobrevivência de 5 anos é inferior a 47%, mas ainda é superior à dos tumores colorrectais [8]. Um pior prognóstico é encontrado em tumores apendiceis com diferenciação de células anelares signet.
Deve-se notar que a histologia da carcinomatose peritoneal é relevante para o prognóstico, e menos para a histologia do tumor primário. Com base nos dados actuais, todos os tumores apêndices com envolvimento exclusivamente peritoneal podem ser avaliados para CRS/HIPEC. No entanto, especialmente no caso de tumores de grau mais elevado, é necessária uma terapia do sistema em caso de infestação extensiva; no caso de falta de resposta ou infestação extensiva do intestino delgado, o CRS/HIPEC também não é indicado aqui. Isto não se aplica ao pseudomixoma clássico, onde o CRS/HIPEC deve ser realizado mesmo com PCI elevado.
Mesotelioma peritoneal maligno: Actualmente, não existe tratamento sistémico eficaz para o mesotelioma peritoneal primário e a sobrevivência é limitada [9]. Um estudo multicêntrico de 401 pacientes com uma ICP mediana de 20 mostrou uma sobrevida mediana de 53 meses e uma sobrevida de 5 anos de 47% após CRS/HIPEC [10]. Os factores preditivos negativos são a ICP, o envolvimento dos gânglios linfáticos e as metástases distantes [11]. Devido a estes promissores dados de sobrevivência , o CRS/HIPEC é uma opção de tratamento razoável para esta doença rara, apesar da falta de ensaios aleatórios.
Carcinoma colorrectal: Até agora, existe apenas um estudo prospectivo randomizado que compara a cirurgia citoreducativa e HIPEC com a quimioterapia sistémica. Verwaal et al. mostrou sobrevida prolongada em doentes com tumores colorrectais em 2003 e 2008 [12,13]. Actualmente, este estudo é considerado controverso, por um lado devido à ressecção insuficientemente radical, e por outro lado no que diz respeito à quimioterapia agora obsoleta com apenas 5FU. Num ensaio não randomizado, CRS/HIPEC com oxaliplatina foi comparado com pacientes que recebem quimioterapia sistémica moderna: nos pacientes após CRS/HIPEC, a sobrevida média melhorou de 24 para 63 meses; além disso, a sobrevida em 5 anos aumentou de 13 para 51% [14]. Uma análise mais aprofundada das experiências multi-institucionais ao longo de vários anos mostrou uma sobrevivência global de 5 anos de 27%, que foi ainda maior com um PCI baixo [5]. As metástases hepáticas individuais não são uma contra-indicação absoluta; podem ser ressecadas ao mesmo tempo com bom êxito, mas apenas com um envolvimento peritoneal limitado [15,16].
Vários estudos estão actualmente em curso para clarificar o papel do CRS/HIPEC no cancro colorrectal em comparação com a terapia do sistema moderno. Actualmente, o CRS/HIPEC é razoável em doentes com envolvimento peritoneal limitado (PCI <20), enquanto que em fases mais avançadas ou se não puder ser feito radicalmente (envolvimento do intestino delgado), o procedimento deve ser interrompido a favor de uma terapia paliativa. O que falta discutir é o papel da terapia neoadjuvante/preoperatória, o que leva a uma maior selecção de doentes. É importante saber que o envolvimento peritoneal – e portanto a ressecabilidade – muitas vezes só pode ser avaliado no decurso de uma laparoscopia exploratória ou laparotomia devido à resolução insuficiente dos procedimentos de imagem.
Conclusão e recomendação para a prática
O tratamento da carcinomatose peritoneal por CRS/HIPEC é uma opção terapêutica eficaz para pacientes bem seleccionados em bom estado geral, que normalmente têm poucas perspectivas de sobrevivência a longo prazo sem terapia agressiva. O pré-requisito para o CRS/HIPEC é uma ressecção radical (CCR-0), que é realizada idealmente cedo. A multimodalidade do tratamento requer indicação e cooperação cuidadosa e interdisciplinar.
Dr. med. Kuno Lehmann
Literatura:
- Jacquet P, Sugarbaker PH: Metodologias de investigação clínica no diagnóstico e estadiamento de doentes com carcinomatose peritoneal: Kluwer Academic Publishers, Boston (MA); 1996.
- Ceelen WP, Flessner MF: Nat Rev Clin Oncol 2010; 7: 108-115.
- Glehen O, Elias D, Gilly F: Présentation du rapport de l’AFC. In : Carcinoses péritonéales d’origine digestive et primitives 2008.
- Chua TC, et al: Ann Surg 2009; 249: 900-907.
- Elias D, et al: J Clin Oncol 2010; 28: 63-68.
- Glehen O, et al: Cancer 2010; 116(24): 5608-5618.
- Sugarbaker PH: Lancet Oncol 2006; 7: 69-76.
- Elias D, et al: Eur J Surg Oncol 2010; 36: 456-462.
- Fizazi K, et al: J Clin Oncol 2003; 21: 349-354.
- Yan TD, et al: J Clin Oncol 2009; 27: 6237-6242.
- Yan TD, et al: Cancer 2011; 117: 1855-1863.
- Verwaal VJ, et al: Ann Surg Oncol 2008; 15: 2426-2432.
- Verwaal VJ, et al: J Clin Oncol 2003; 21: 3737-3743.
- Elias D, et al: J da Clin Oncology 2009; 27: 681-685.
- Chua TC, et..: Eur J Surg Oncol 2009; 35: 1299-1305.
- Elias D, et al: Similitudes Prognósticas e Diferenças nas Metástases Fígicas e Metástases Peritoneais de Cânceres Colorectal com Ressecção Óptima. Ann Surg 2014 Fev. [Epub ahead of print].
- Tong L, et al: Ophthalmology 2009; 116: 572-579.
- Omohwo C, et al: J Am Coll Surg 2009; 209: 308-312.
- Fan KH, et al: Chang Gung Med J 2009; 32: 526-534.
- Sugarbaker PH, Chang D: Ann Surg Oncol 1999; 6: 727-731.
- Chuanyu S, et al: Urologia 2009; 74: 1036-1040.
InFo ONCOLOGy & HEMATOLOGy 2014; 2(8): 20-22