Novos resultados dos estudos FIREFISH e SUNFISH sugerem que há esperança para as crianças com atrofia muscular espinhal.
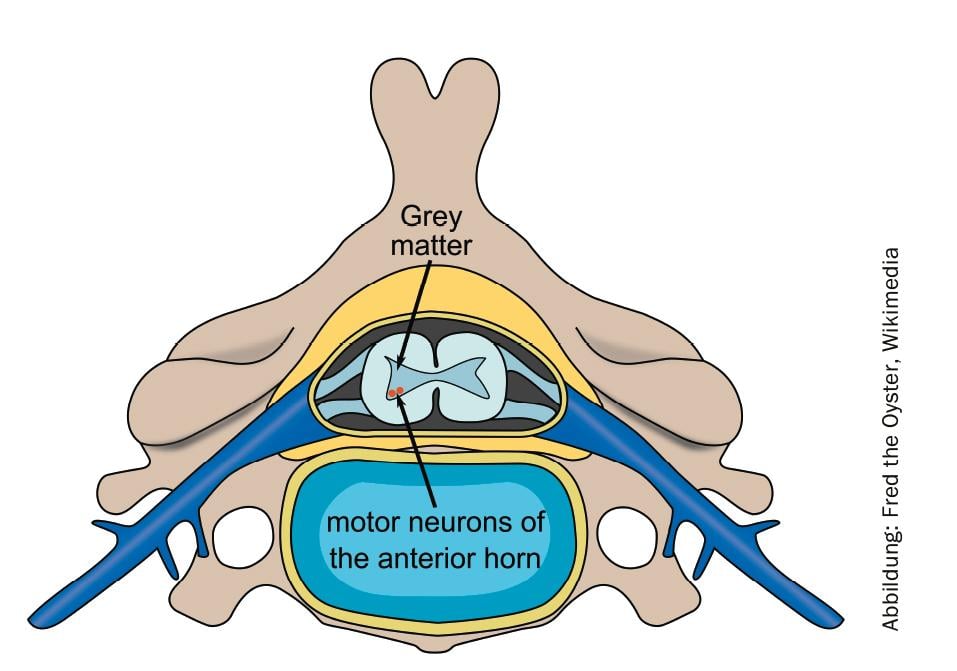
A atrofia muscular espinhal (AME) é uma doença neuromuscular hereditária, grave e progressiva que leva ao desperdício muscular e a complicações relacionadas com a doença. Entre as doenças raras, a AME é a mais comum, afectando cerca de um em cada 11.000 bebés. A perda progressiva de células nervosas na medula espinal leva a deficiências motoras, cuja gravidade depende da forma do SMA.
Uma abordagem terapêutica promissora é o risdiplam. O derivado da piridazina aumenta a sobrevivência funcional dos genes de manutenção da vida do neurónio motor (SMN) alterando o padrão de emenda. A droga é administrada oralmente e está actualmente a ser investigada nos ensaios FIREFISH, SUNFISH, JEWELFISH e RAINBOWFISH. Na Reunião Anual da AAN em Filadélfia, Roche apresentou novos resultados de dois estudos.
Outro passo para a terapia oral
O FIREFISH é um estudo de duas partes de rótulo aberto em crianças com SMA tipo 1. A parte 1 foi um estudo de dose-escalação em 21 crianças cujo objectivo principal era determinar o perfil de segurança do risdiplam. Além disso, deve definir a dose para a parte 2 (n=41). A parte 1 mostrou que os doentes tratados com risdiplam sobreviveram mais tempo do que os não tratados. Além disso, alcançaram marcos motores que estão acima do que seria de esperar num curso natural da doença. Assim, após 12 meses, das 17 crianças que tinham recebido o medicamento e que também foram aleatorizadas para a parte 2, 7 crianças puderam sentar-se sem apoio durante pelo menos cinco segundos, 11 crianças puderam sentar-se com/sem apoio e 9 puderam manter a cabeça erguida. Uma criança podia ficar de pé. Os efeitos secundários incluíram, com frequência decrescente, febre (52%), infecções das vias respiratórias superiores (43%), diarreia (29%), vómitos, tosse, pneumonia e obstipação. Nenhuma criança precisava de traqueostomia ou ventilação permanente, nenhuma perdeu a capacidade de engolir. Três crianças morreram durante o estudo, embora estes casos não estivessem associados ao risdiplam.
No total, 59% dos pacientes >pontuaram 40 na escala CHOP-INTEND, com um máximo de 57. O investigador principal, Giovanni Baranello, MD, da Fundação Carlo Besta Neurological Research Institute em Milão (I), sublinhou então que estes resultados positivos advogam uma abordagem terapêutica que se concentra no aumento dos genes SMN no sistema nervoso central, bem como em todo o corpo. “Estamos muito encorajados com estas recentes descobertas sobre o Risdiplam”, fez eco a Sandra Horning, MD, Médica Chefe de Roche e Chefe do Desenvolvimento Global de Produtos. “Isto aproxima-nos mais um passo para podermos fornecer a primeira opção de tratamento oral à comunidade SMA”. A parte 2 do FIREFISH, que foi concebida para medir a eficácia e inclui 41 pacientes, está actualmente em curso.
Preparação do estudo de eficácia concluído
O ensaio clínico chave da SUNFISH, também um estudo em duas partes, duplo-cego, controlado por placebo, incluiu doentes de 12-25 anos com AME tipo 2 ou tipo 3. O objectivo da Parte 1 (n=51) era determinar a dose para a Parte 2. A Parte 2 visa principalmente avaliar as capacidades motoras após doze meses, conforme medido pela pontuação da Medida de Função Motora 32 (MFM-32). Enquanto a Parte 2 (n=180) está actualmente a ser conduzida, os resultados da Parte 1 estão disponíveis.
Na linha de base, os participantes tinham capacidades motoras e limitações muito diferentes. Alguns já não se sentam em pé, enquanto outros ainda andam. Alguns tinham uma escoliose grave, outros não.
Após doze meses de tratamento com risdiplam, a concentração mediana da proteína SMN no sangue foi duplicada. 43 pacientes puderam participar em todas as medições, com 58% de melhoria de 3 pontos na escala MFM-32 >.
A parte 2 dos ensaios FIREFISH e SUNFISH estão agora a testar a eficácia do risdiplam. Os resultados são esperados no quarto trimestre de 2019 e no primeiro trimestre de 2020.
InFo NEUROLOGIA & PSYCHIATRY 2019; 17(3): 40