Hoje em dia, o prurigo crónico é definido como uma doença por direito próprio. O Prurigo nodularis em particular é muito angustiante para as pessoas afectadas. As terapias locais não são eficazes em todos os doentes, mas há vários biólogos e inibidores JAK que mostraram resultados promissores em ensaios. Dupilumab e nemolizumab em particular são grandes esperanças, especialmente porque ambos os biólogos já receberam aprovação da FDA para esta indicação.
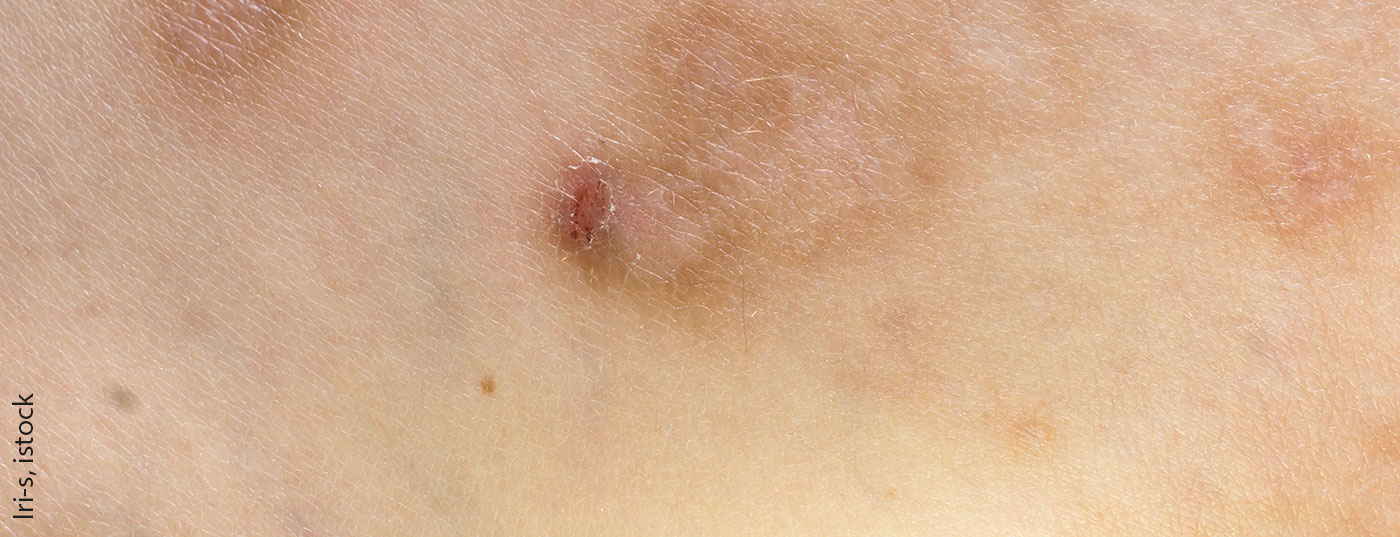
O prurigo crónico (CPG) pode ser diagnosticado quando a comichão crónica persiste durante pelo menos 6 semanas, há sinais de arranhões repetidos (por exemplo, escoriações e cicatrizes) e lesões pruriginosas* múltiplas localizadas ou generalizadas estão presentes. Estes critérios de classificação foram definidos em 2018 por um grupo de trabalho da Academia Europeia de Dermatologia e Veneorologia (EADV) (Quadro 1) [1]. A CPG está frequentemente associada a uma carga significativa de doença. “Os pacientes sofrem e têm uma qualidade de vida prejudicada”, diz o Prof. Andreas Wollenberg, Departamento de Dermatologia e Alergologia LMU Munique e Departamento de Dermatologia, Vrije Universiteit Brussel [2]. A CPG resulta da sensibilização neuronal à comichão e do desenvolvimento de um ciclo de coceira-arranhões. Em termos de etiologia, são possíveis factores dermatológicos, sistémicos, neurológicos ou psiquiátricos/psicossomáticos. Contudo, o prurigo também pode ser multifactorial ou ter uma etiologia inexplicada [1]. De acordo com o consenso dos especialistas, CPG é um termo geral para manifestações papulares, nodulares e outras (Tab. 1) [1]. Para além dos critérios essenciais obrigatórios acima mencionados, foram definidos critérios secundários, incluindo qualidade de vida limitada, perturbações do sono, depressão, ansiedade e desamparo.

Terapia local: TCS e TCI continuam a ser o padrão de cuidados
Relativamente aos corticosteróides tópicos (TCS), o Prof. Wollenberg prefere substâncias activas de classe de resistência 4 (por exemplo, clobetasol proprionate) [2]. Ao utilizar corticosteróides tópicos sob oclusão, esta classe de resistência também é aconselhável. Os inibidores tópicos de calcineurina (TCI) podem ser utilizados como uma alternativa aos TCS. Uma vantagem dos TCIs é que não provocam os efeitos secundários típicos dos esteróides. A pomada Tacrolimus demonstrou ser mais eficaz do que o creme de pimecrolimus em três ensaios aleatórios multicêntricos de seis semanas, cegos por investigadores, envolvendo um total de 1065 doentes, pelo que deve ser preferida [13]. O Tacrolimus também pode ser utilizado sob oclusão, mas isto só faz sentido para um pequeno número de lesões. Os corticosteróides intralesionais também podem ser úteis se houver poucas lesões. A comichão pode ser reduzida, mas o resultado cosmético é por vezes suboptimizado, disse o orador. O uso de análogos tópicos de vitamina D3 também se justifica – em alguns casos, bons resultados podem ser alcançados com eles, relata o Prof. Wollenberg. A terapia da luz (PUVA, banda estreita UVB) pode ser utilizada em combinação com TCS tópicos. E para uma pequena área limitada, vale a pena tentar um tratamento com laser excimer (cerca de 300 nm). A crioterapia é também uma possibilidade, embora o orador não seja um apoiante desta opção terapêutica, pois a experiência tem demonstrado que o resultado cosmético deixa muito a desejar [2].
A Biologia está em alta: Dupilumab e Nemolizumab convencem
Dupilumab, um anticorpo monoclonal já aprovado para outras indicações na Europa, exerce efeitos anti-inflamatórios ao inibir a cascata de sinalização IL4/IL13. Numa série de casos por investigadores do Instituto Karolinska, Estocolmo, o dupilumabe levou a uma redução significativa dos sintomas em doentes com prurigo nodularis (PN) e no ensaio PRIME-2 aleatorizado e controlado por placebo, 37,2% dos doentes tratados com dupilumabe conseguiram uma redução clinicamente significativa da comichão desde a linha de base na semana 12 em comparação com 22,0% no grupo placebo (p=0,0216) [2–5]. Na semana 24, os números correspondentes eram 57,7% no braço dupilumab contra 19,5% no braço placebo (p<0,0001), pelo que quase três vezes mais participantes no estudo da condição verum conseguiram uma redução da comichão clinicamente significativa após cerca de seis meses (fig. 1) [2,4,5]. A pele sem aparência ou quase sem aparência na semana 24 foi vista em 44,9% dos pacientes tratados com dupilumab contra 16% com placebo (p<0,0001).
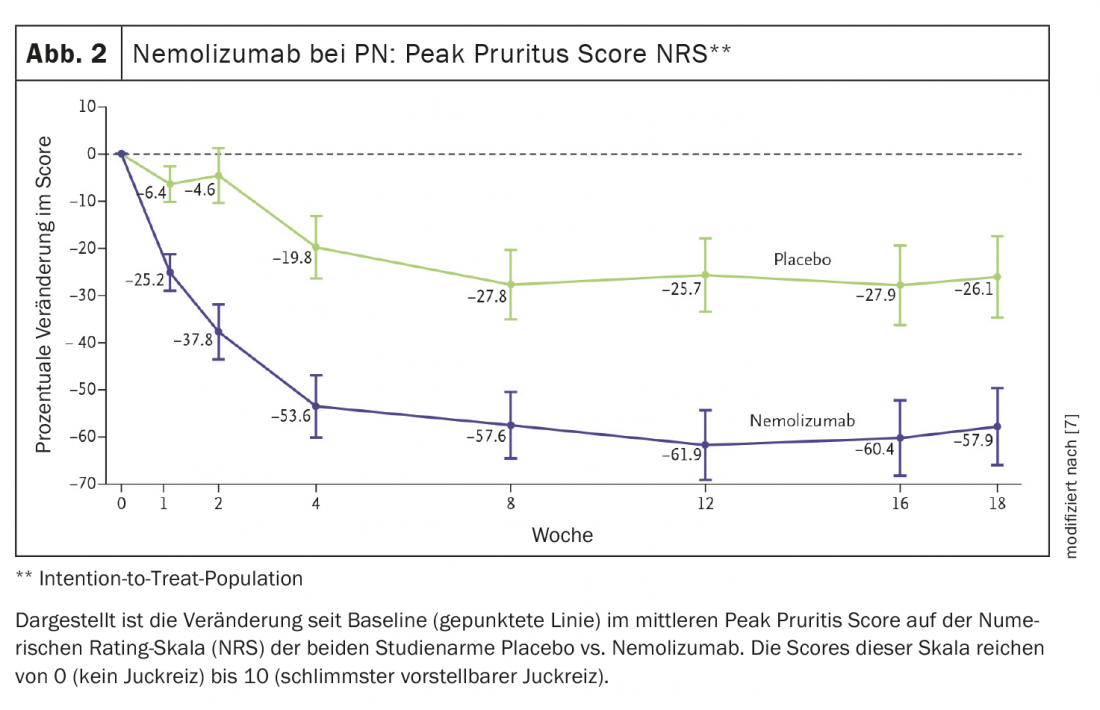
Nemolizumab é também um promissor candidato a drogas. IL-31 é um condutor de processos inflamatórios e é considerada uma espécie de citocina mestre para prurido. Em estudos, nemolizumab controlou com sucesso o prurido em doentes com dermatite atópica e também reduziu os distúrbios do sono relacionados com a comichão [6]. Neste contexto, foi realizado um ensaio clínico fase II de nemolizumab em PN. Os resultados publicados no New England Journal of Medicine mostram que o nemolizumab reduziu significativamente a comichão em doentes com prurigo nodularis moderado a grave [7]. 70 pacientes foram randomizados 1:1 para nemolizumab ou placebo, a pontuação inicial de prurido de acordo com o NRS foi de 8,4. Na semana 4, o pico do prurido NRS diminuiu 4,5 pontos (-53,0%) nos doentes tratados com nemolizumab em comparação com a linha de base, mas apenas 1,7 pontos (-20,2%) no grupo placebo (p<0,001) [7] (Fig. 2).
A FDA já aprovou nemolizumab e dupilumab para a indicação PN, e o Prof. Wollenberg espera que a Europa siga o exemplo num futuro próximo.
Também se pode ficar curioso sobre os inibidores JAK
Para além destes dois biológicos, existem também algumas substâncias activas do campo das pequenas moléculas que são consideradas como tendo potencial terapêutico no prurigo crónico. O delgocitinibe é um inibidor JAK tópico que inibe o JAK-1, JAK-2 e JAK-3 e pode também ser eficaz em CPG. No Japão, o delgocitinibe foi aprovado para o tratamento da dermatite atópica [8]. Outro inibidor JAK em forma de dosagem tópica é o ruxolitinibe. Isto inibe a JAK-1, JAK-2 e TYK-2. Ruxolitinib é aprovado nos EUA para a indicação de dermatite atópica [9]. O tofacitinibe é um inibidor oral do JAK que inibe o JAK-3, JAK-2 e TYK-2 e demonstrou a sua eficácia no tratamento do PN num relatório de caso [10].
A utilização da substância neuroactiva aprepitante também resultou numa redução significativa da intensidade da comichão em PN (p<0,05). [11]. Contudo, o aprepipante é uma opção terapêutica relativamente cara que ainda não se estabeleceu nos cuidados de rotina, disse o orador. Numa série de casos, a combinação de MTX e alitretinoína provou ser eficaz no tratamento do PN [12]. No que respeita aos agentes sistémicos convencionais MTX, ciclosporina A, e azatioprina, o perito aconselha cautela, uma vez que os pacientes com CPG são frequentemente idosos e, em particular, relativamente muitos dos pacientes PN têm a função renal prejudicada.
Congresso: Congresso Anual da SGDV
Literatura:
- Pereira MP, et al: Membros do grupo EADV Task Force Pruritus. Academia europeia de dermatologia e venereologia Projecto europeu de prurigo: consenso de especialistas na definição, classificação e terminologia do prurigo crónico. J Eur Acad Dermatol Venereol 2018; 32(7): 1059-1065.
- “Prurigo crónico – estado da arte na sua prática”, Prof. Andreas Wollenberg, Reunião Anual da SGDV 09.11.2022.
- Lönndahl L, et al. Dupilumab reduz significativamente os sintomas de prurigo nodularis e depressão: uma série de casos. Acta Derm Venereol 2022; 102 : adv00754XX.
- Estudo do dupilumab para o tratamento de pacientes com prurigo nodularis, inadequadamente controlado em terapias de prescrição tópica ou quando essas terapias não são aconselháveis (PRIME2). Disponível a partir de: https://ClinicalTrials.gov/show/NCT04202679. Acedido a 11 de Abril de 2022.
- “Dupixent® (dupilumab) é o primeiro produto biológico a reduzir significativamente a comichão e as lesões cutâneas na fase 3 do ensaio do prurigo nodularis, demonstrando o papel da inflamação de tipo 2 nesta doença”, Sanofi, 22 de Outubro de 2021, www.sanofi.com/en/media-room/press-releases/2021/2021-10-22-05-00-00-231…, (último acesso em 15.11.2022)
- Ruzicka T, et al: NEJM 2017 ; 376 : 826-835.
- Stand S, et al: NEJM 2020; 382: 706-716.
- Worm M, et al: Br J Dermatol 2022; 187: 42-51.
- Papp K, et al: JAAD 2021; 85: 863-872.
- Peng C, et al: Clin Cosmet Investig Dermatol 2022 ; 15: 503-506.
- Angelopoulos K, et al. JEADV 2019 ; 33 : 2371-2379.
- Bergqvist C, et al: JEADV 2021; 35: e516-e519.
- Paller AS, et al: JAAD 2005; 52 : 810-822.