No Medidays, o programa de formação contínua de medicina interna do Hospital Universitário de Zurique (USZ), foram também feitas apresentações sobre vários tópicos hematológicos. Como é esclarecida a anemia de uma forma significativa? Que pacientes devem ser mudados para novos anticoagulantes na prática? E de que medidas terapêuticas beneficiam os doentes com leucemia linfocítica crónica?
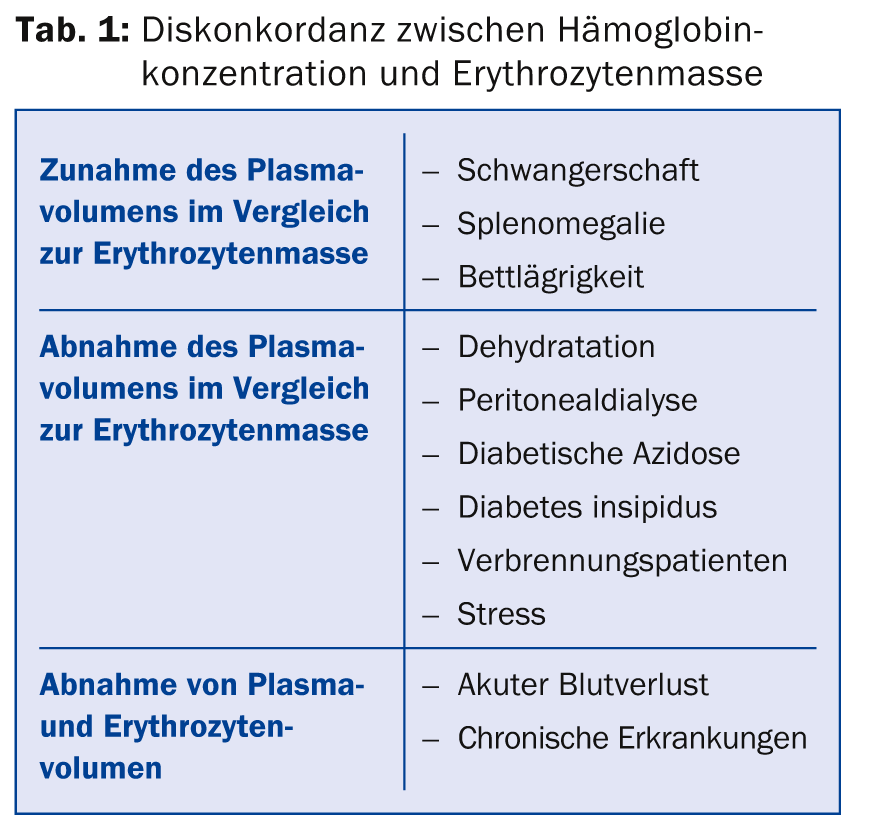
(ee) O Dr. med. Jeroen Goede, médico chefe a.i. da Clínica de Hematologia do Hospital Universitário de Zurique, forneceu informações sobre o diagnóstico e tratamento da anemia. Existem várias causas para uma discrepância entre a concentração de hemoglobina e a massa eritrócita (Tab. 1). Em princípio, a concentração de hemoglobina depende de vários factores tais como idade, sexo, raça e altitude de residência. Os valores de referência para a anemia são <120 g/l nas mulheres, <110 g/l na gravidez e <130 g/l nos homens. O valor mais baixo nas mulheres não se deve à menstruação, mas à diminuição dos níveis de testosterona; quando os níveis de testosterona diminuem nos homens à medida que envelhecem, a concentração de hemoglobina também diminui.
O diagnóstico diferencial de anemia é muito diversificado. Basicamente, é feita uma distinção entre produção inadequada de eritrócitos (por exemplo, em deficiência de ferro ou perturbação da eritropoiese normal em tumores malignos), aumento da degradação (por exemplo, em próteses de válvulas cardíacas, anemia hemolítica auto-imune, defeitos de membrana, etc.), perda de eritrócitos (hemorragia aguda ou crónica) e “pseudo” anemia (por exemplo, na gravidez). Alguns testes laboratoriais são normalmente suficientes para o esclarecimento inicial da anemia (Quadro 2). Isto permite que o diagnóstico seja feito em cerca de dois terços de todas as anemias.

O metabolismo do ferro é muito complexo. Em 99% dos casos, contudo, a determinação da ferritina é suficiente para o diagnóstico de anemia por deficiência de ferro; um estado completo de ferro é geralmente desnecessário. Em caso de deficiência de ferro, deve ser recomendada aos pacientes uma dieta rica em ferro (carne, gema de ovo, cereais com casca, soja, nozes, pão integral). A substituição oral do ferro por 200 mg/d de sulfato de ferro (durante 3 – 6 meses) só faz sentido se o ferro também puder ser absorvido – é por isso que, por exemplo, a substituição do ferro deve ter lugar i.v. no caso da doença celíaca. No entanto, os comprimidos de ferro levam frequentemente a queixas gastrointestinais.
A substituição intravenosa do ferro pode ser realizada com muita segurança hoje em dia; as novas preparações com carboximaltose de ferro (Ferinject®) resp. A sacarose de ferro (Venofer®) já não contém dextrano e já não causa anafilaxia grave. Uma indicação clara é no entanto obrigatória para a administração de ferro intravenoso. Estes incluem a intolerância documentada da administração oral de ferro, má absorção ou má conformidade que não pode ser influenciada. A trombocitose leve (até 700 G/l) é comum com deficiência de ferro, mas normalmente desaparece após substituição.
Novos anticoagulantes orais
Novos anticoagulantes orais estão disponíveis há alguns anos: o antagonista directo do trombina dabigatran (Pradaxa®) e os antagonistas directos do factor Xa rivaroxaban (Xarelto®), apixaban (Eliquis®) e – não disponível na Suíça – edoxaban (Lixiana®). Jan-Dirk Studt, MD, Médico Senior da Clínica de Hematologia do Hospital Universitário de Zurique, apresentou as possíveis aplicações, bem como as vantagens e desvantagens.
Todos os novos anticoagulantes orais (NOAK) são aprovados na Suíça para a profilaxia embólica em fibrilação atrial. Rivaroxaban e apixaban são adicionalmente aprovados para a profilaxia do tromboembolismo venoso (TEV) em grandes cirurgias ortopédicas da anca e do joelho, e o rivaroxaban pode ser utilizado adicionalmente para a terapia TEV aguda e profilaxia secundária (sem administração prévia de heparina de baixo peso molecular).
Em pacientes com fibrilação atrial, os NOAK são ligeiramente melhores que os antagonistas da vitamina K em termos de eficácia e segurança de acordo com os estudos actuais; em pacientes com TEV, ambas as classes são actualmente consideradas como sendo aproximadamente equivalentes. O quadro 3 lista as indicações para a conversão. Em princípio, os NOAK têm segurança e eficácia equivalentes aos “velhos” anticoagulantes orais, e uma vantagem significativa é o rápido início da acção.

O Dr. Studt informou sobre o tratamento dos NOAKs em situações clínicas especiais:
- Procedimentos e intervenções: Para a maioria dos procedimentos, a NOAK deve ser parada pelo menos 24 horas antes da intervenção, para procedimentos de alto risco (por exemplo, procedimentos CNS) 48 horas ou mais antes. Em caso de insuficiência renal, é necessário um tempo de espera mais longo.
- Cancelamento dos efeitos: Ainda não existem antídotos específicos, pelo que a meia-vida comparativamente curta das novas substâncias é vantajosa. No caso do dabigatran, a diálise é, na melhor das hipóteses, aconselhável; no caso do rivaroxaban e do apixaban, a diálise não é promissora devido à alta ligação protéica.
- Sangramento: No caso de hemorragias menores, o tratamento sintomático é apropriado (terapia local, possivelmente adiando a dose seguinte). Em caso de hemorragia moderada a grave, a ingestão é interrompida e o paciente é internado no hospital. A administração de protamina ou vitamina K é ineficaz. Se necessário, pode-se administrar concentrado de complexo de protrombina ou concentrado de complexo de protrombina activado.
- Válvulas cardíacas mecânicas: Para pacientes com válvulas cardíacas protéticas mecânicas, os antagonistas de vitamina K (VKA) continuam a ser a terapia padrão. Os resultados de estudos comparando a dabigatrana com a VKA foram desfavoráveis para a dabigatrana. Actualmente, todos os NOAKs estão contra-indicados em pacientes com válvulas protéticas mecânicas.
- Gravidez e amamentação: Os dados sobre a utilização de NOAK na gravidez e amamentação são muito limitados, de modo que todos os NOAK estão actualmente contra-indicados em mulheres grávidas e a amamentar. A heparina de baixo peso molecular continua a ser a terapia padrão.
- Insuficiência renal: Nenhum dos NOAK pode ser prescrito em doentes com insuficiência renal grave (depuração de creatinina <30 ml/min.) ou necessidade de diálise. No caso de insuficiência renal ligeira, as dosagens podem ser ajustadas.
- A quantificação do efeito NOAK é de interesse em certas situações clínicas, por exemplo antes – especialmente não planeadas – de intervenções, em caso de trauma, hemorragia, insuficiência renal, pacientes muito leves ou muito pesados, suspeita de overdose ou ocorrência de tromboses sob terapia adequada. Não existe uma gama de alvos como com VKA ou heparina, e estão disponíveis testes específicos para quantificação para cada agente.
Leucemia linfocítica crónica
Dr. Markus G. Manz, Director da Clínica de Hematologia do Hospital Universitário de Zurique, falou sobre a leucemia linfocítica crónica (CLL). Esta leucemias mais frequentes ocorre principalmente nos idosos (idade média no primeiro diagnóstico 70 anos). Devido ao envelhecimento da população, a incidência de CLL irá aumentar no futuro. 7% de todos os dadores de sangue saudáveis com mais de 45 anos de idade têm linfocitose monoclonal de células B (MBL) no seu sangue periférico, mas quando o MBL está presente, apenas cerca de 1-2% por ano progridem para o CLL.
A dinâmica da CLL varia muito de paciente para paciente: a doença pode progredir rapidamente, mas também pode ser assintomática (descoberta acidental). Os sintomas típicos são uma queda no desempenho devido à anemia, infecções, estigmas hemorrágicos, sintomas B (febre, suores nocturnos, perda de peso), inchaço dos gânglios linfáticos e inchaço do fígado e/ou baço. O diagnóstico é feito a partir do sangue periférico (linfócitos monoclonais B >5000/µl); uma punção de medula óssea não é geralmente necessária, mas pode ser útil em casos individuais, especialmente antes de iniciar a terapia. A clarificação citogenética deve ser sempre realizada a fim de diagnosticar aberrações cromossómicas que sejam prognosticalmente desfavoráveis.
O CLL é classificado de acordo com Binet (Tab. 4) ou Rai, o que é importante para estimar o prognóstico. Ainda em 1974, apenas 5% dos doentes CLL sobreviveram ao diagnóstico durante mais de cinco anos – esta situação mudou significativamente à medida que várias opções de tratamento estão disponíveis. No entanto, a CLL não pode ser curada por terapias sistémicas. Na CLL assintomática, o paciente não é tratado porque não há actualmente provas de que a terapia na fase assintomática seja benéfica. Há uma indicação geral de terapia na fase Binet C ou se existem sintomas angustiantes tais como inchaço dos gânglios linfáticos, fígado e baço, sintomas B, anemia, etc.

A terapia padrão hoje em dia é a quimioterapia com fludarabina, ciclofosfamida e rituximab (FCR). Contudo, este esquema é desviado em função da idade e estado geral do doente, comorbilidades (especialmente insuficiência renal) e aberrações cromossómicas. A combinação de bendamustine e rituximab demonstrou ser menos tóxica mas também ligeiramente menos eficaz do que o regime FCR. Portanto, é mais provável que esta combinação seja utilizada em pacientes mais velhos com mais de 65 anos de idade. Para pacientes com CLL refractária ou recaída, também é possível o transplante alogénico de células estaminais.
Em Julho de 2014, a Agência Europeia de Medicamentos (EMA) recomendou os inibidores da tirosina quinase ibrutinib e idelalisib (Zydelig®) bem como o anticorpo monoclonal anti-CD20 obinutuzumab (Gazyvaro®) para aprovação da indicação CLL. O Ibrutinib pode prolongar significativamente a sobrevivência, mas a resistência também se desenvolve.
O orador chamou a atenção para o facto de que os elevados custos dos novos medicamentos para o tratamento das leucemias crónicas representam um desafio para a sociedade: “O tratamento da hipertensão com enalapril custa cerca de 500 francos por ano, o tratamento do CML com imatinib 40.000 francos. À medida que as pessoas envelhecem e as leucemias crónicas se tornam mais comuns, coloca-se a questão de quem suportará os custos das dispendiosas terapias”.
Fonte: Medidays, 3 de Setembro de 2014, Hospital Universitário de Zurique
PRÁTICA DO GP 2014; 9(11): 52-56











