Em 2018, cerca de 10 milhões de pessoas contraíram tuberculose e 1,45 milhões morreram. Um desafio cada vez maior é o tratamento de pacientes com tuberculose multirresistente (MDR-TB), para os quais os dois principais medicamentos utilizados na terapia permanente da tuberculose – isoniazida e rifampicina – perderam a sua eficácia.
Em 2018, cerca de 10 milhões de pessoas contraíram tuberculose e 1,45 milhões morreram. Um desafio cada vez maior é o tratamento de pacientes com tuberculose multirresistente (MDR-TB), para os quais os dois principais medicamentos utilizados na terapia permanente da tuberculose – isoniazida e rifampicina – perderam a sua eficácia. A resistência aos medicamentos é provavelmente causada não raro pelas diferentes farmacocinéticas dos medicamentos para a tuberculose [1]. Contudo, em regiões com uma elevada proporção de MDR-TB em novos diagnósticos, a transmissão directa dos agentes patogénicos MDR está também a ser observada com uma frequência crescente [2]. A terapia é longa e pode estar repleta de efeitos secundários, pelo que é necessária uma equipa interdisciplinar e experiente para gerir o tratamento. De acordo com o relatório anual da Organização Mundial de Saúde (OMS), o sucesso do tratamento da forma multirresistente da tuberculose é actualmente de apenas 55-56% em todo o mundo [2,3]. A baixa taxa de detecção de casos da MDR-TB a nível mundial continua a ser problemática. Antes de se poder tomar uma decisão terapêutica sensata, devem estar disponíveis diagnósticos com a ajuda dos quais, se possível, podem ser determinadas todas as resistências medicamentosas relevantes. Por exemplo, dos 500.000 novos casos MDR-TB estimados para 2018, apenas 187.000 foram diagnosticados e notificados. O número de casos que podiam ser tratados foi correspondentemente baixo, com 156.000. Uma vez que apenas cerca de metade deles conclui com sucesso o tratamento de acordo com as estatísticas da OMS, mais de 80% dos casos MDR estimados continuam sem controlo e contribuem para a propagação da doença [2].
Na Alemanha, foram notificados 118 casos com MDR-TB em 2018, o que corresponde a uma quota estável de 3,1% de novos diagnósticos ao longo dos últimos anos. No relatório de 2019 do Instituto Robert Koch (RKI), os resultados do tratamento de casos de tuberculose MDR a partir de 2017 estão disponíveis e o tratamento bem sucedido só pôde ser documentado em 39% dos doentes [4]. A data limite para a avaliação destes resultados de tratamento transmitidos ao RKI foi 1 de Março de 2019. Contudo, em quase 45% dos pacientes, a terapia não tinha sido concluída no momento da avaliação, pelo que o resultado da terapia era desconhecido. De acordo com o Gabinete Federal de Saúde Pública, sete casos foram diagnosticados com MDR-TB na Suíça em 2018 e dez casos em 2019 (Gabinete Federal de Saúde Pública, comunicação pessoal).
As recomendações da OMS sobre o diagnóstico e tratamento da tuberculose resistente aos medicamentos, que mudaram significativamente em 2019 e 2020, são explicadas mais detalhadamente a seguir.
Diagnósticos
Nos doentes em que se suspeita de tuberculose pulmonar com base em sintomas típicos ou com base numa radiografia de tórax conspícua, pelo menos 2 amostras de saliva de boa qualidade devem ser examinadas para detecção de micobactérias de acordo com as recomendações da OMS [5,6]. Nos últimos anos, os testes de amplificação do ácido nucleico (NAAT) para as formas pulmonares e extrapulmonares de tuberculose ganharam a maior importância no diagnóstico inicial. Os NAATs permitem distinguir o complexo M. tuberculosis de micobactérias não tuberculosas (NTMs). Com métodos automatizados como o Xpert® MTB/RIF, pode esperar-se um resultado de teste para identificação de agentes patogénicos e resistência à rifampicina após apenas algumas horas. A nova versão do Xpert® MTB/RIF Ultra mostrou uma sensibilidade global melhorada em comparação com a versão anterior (90% versus 85% [6]), especialmente na tuberculose pulmonar paucibacilar sem detecção microscópica de micobactérias (sensibilidade 77% versus 67% [7]). Contudo, esta melhoria foi acompanhada por uma deterioração da especificidade (96% contra 99% [6]). Especialmente em doentes com historial de tuberculose nos últimos 5 anos, são possíveis resultados falso positivos aumentados [7].
A microscopia da expectoração para detectar hastes ácidas dá uma indicação da carga bacteriana da expectoração e, portanto, do risco de infecção. Contudo, a transmissão também é possível com microscopia negativa e NAAT positiva [8]. Sempre que se suspeite de tuberculose, deve ser procurado um cultivo cultural do patogéneo. A cultura ainda é actualmente o padrão para o diagnóstico da tuberculose. Em comparação com os meios de cultura sólidos, a cultura líquida tem uma sensibilidade um pouco maior, e o crescimento de micobactérias pode ser detectado cerca de duas semanas antes devido ao método.
Diagnóstico da resistência aos medicamentos
Apesar dos desafios metodológicos, os testes de resistência cultural ou fenotípica ainda são actualmente muito valorizados para as decisões terapêuticas clínicas na Alemanha e na Suíça [9]. Os testes de resistência fenotípica de isoniazida, rifampicina, fluoroquinolonas, aminoglicosídeos e polipéptidos parecem ser mais fiáveis aqui do que com outros medicamentos anti-tuberculose [10]. As razões para isto são, por um lado, técnicas, tais como a instabilidade da substância dos carbapenems. Em alguns casos, faltam valores limiares para a categorização “sensível”/”resistente” ou não estão suficientemente comprovados cientificamente. Isto aplica-se em particular às importantes substâncias cicloserina/terizidona e ácido para-aminosalicílico (PAS) [11].
O cultivo de patogénicos e os testes de resistência fenotípica podem demorar 2-10 semanas. Durante este tempo, teria de ser realizada uma terapia calculada que estivesse alinhada com os padrões de resistência locais [12,13]. Os resultados de um teste de resistência molecular biológica ou genotípica estão disponíveis muito mais rapidamente. Em muitos casos, isto já pode ser realizado a partir de material directo (por exemplo, expectoração contendo agentes patogénicos). Os resultados devem estar disponíveis após algumas horas a dias e permitir o início de uma terapia orientada. Contudo, com as técnicas de biologia molecular, não é actualmente possível detectar resistência a todos os fármacos disponíveis. Além disso, a resistência que não está associada às mutações genéticas detectadas em testes rápidos pode ser negligenciada. Portanto, os resultados de testes biológicos moleculares rápidos devem normalmente ser confirmados por testes de resistência fenotípica. Cada vez mais, a sequenciação de todo o genoma está a fornecer resultados adicionais e já está a substituir os testes de resistência fenotípica para medicamentos de primeira linha em alguns países [14,15].
Novas recomendações diagnósticas da OMS
Os resultados dos testes biológicos moleculares mostram uma boa concordância com os resultados fenotípicos de alguns medicamentos [15]. Por conseguinte, desde 2020, a OMS recomenda testes biológicos moleculares rápidos no diagnóstico patogénico inicial, bem como no diagnóstico de resistência, em preferência aos métodos microscópicos e culturais. Isto aplica-se em particular ao NAAT Xpert® MTB/RIF e ao Xpert® MTB/RIF Ultra do Cepheid na tuberculose pulmonar. Ambos os testes indicam resistência à rifampicina, para além do diagnóstico patogénico. Em alternativa, segundo a OMS, podem ser utilizados os testes Truenat® MTB, MTB Plus e MTB-RIF Dx do Molbio. Para o diagnóstico do LCR em casos de suspeita de meningite de TB, é feita uma forte recomendação para a utilização do Xpert® MTB/RIF Ultra como teste inicial. Para outros materiais de amostra em casos de suspeita de tuberculose extrapulmonar, os dados analisados apenas justificam uma fraca recomendação principalmente para o Xpert MTB/RIF [7].
Os chamados ensaios de sonda de linha (LPAs), tais como os comercializados pela Hain Lifescience em , podem ser utilizados para diagnosticar a resistência à rifampicina e isoniazida (GenoType® MTBDRplus) em amostras microscópica ou culturalmente positivas de expectoração. LPAs para medicamentos de segunda linha (GenoType® MTBDRsl) podem ser utilizados em vez de testes fenotípicos para determinar a resistência às fluoroquinolonas (FQs) e amikacina quando a resistência à rifampicina tiver sido previamente detectada. A mesma recomendação aplica-se no caso de monoresistência de isoniazida antes de iniciar a terapia com fluoroquinolonas. Os testes de resistência fenotípica continuam a ser recomendados pela OMS quando não é detectada qualquer resistência nos testes com LPAs, mas a probabilidade de resistência adicional para além da MDR-TB parece elevada [6,7].
No ano corrente, o novo teste rápido NAAT Xpert® MTB/XDR para a determinação simultânea da resistência à isoniazida, fluoroquinolonas, amikacina, canamicina, capreomicina e etionamida deverá ser avaliado pela OMS.
Sequenciação
A sequenciação do genoma inteiro (WGS) é uma técnica que também pode detectar mutações raras associadas à resistência às drogas. Além disso, a sequenciação pode ser aplicada para analisar dados epidemiológicos e para rastrear a origem dos surtos de tuberculose [16–18]. Os testes abrangentes de resistência fenotípica e genotípica incluindo sequenciação são oferecidos por laboratórios de referência na Alemanha e devem ser realizados pelo menos para cada estirpe MDR-TB. A interpretação das mutações genéticas em termos da sua relevância clínica constitui um desafio em muitos casos e é uma parte essencial dos actuais esforços de investigação para generalizar esta tecnologia [19]. Os laboratórios de referência na Alemanha e na Suíça oferecem agora a WGS.
Tratamento da tuberculose com monorresistência isoniazídica
Estima-se que cerca de 8% da TB a nível mundial mostram resistência INH sem resistência RMP. Assim, em 2018, a OMS publicou uma recomendação separada sobre a terapia para a monoresistência INH, recomendando 4 vezes a terapia com levofloxacina juntamente com ou em vez da INH para toda a duração da terapia de 6 meses [20,21]. Esta recomendação foi adoptada em 2020 [22,23].
Na Alemanha, a proporção de estirpes resistentes ao INH era de 9,4% em 2018 [4], enquanto que na Suíça era de 6,2% das estirpes de TB testadas, de acordo com o Departamento Federal de Saúde Pública (Departamento Federal de Saúde Pública, comunicação pessoal). A recomendação para a terapia de monoresistência INH (Tab. 1) será reavaliada na actualização já notificada da directriz alemã. Por enquanto, contudo, as recomendações de 2017 permanecem válidas para tratamento na Alemanha. Um pré-requisito importante para o tratamento é o teste rápido e fiável da resistência às fluoroquinolonas frequentemente utilizadas nesta situação.
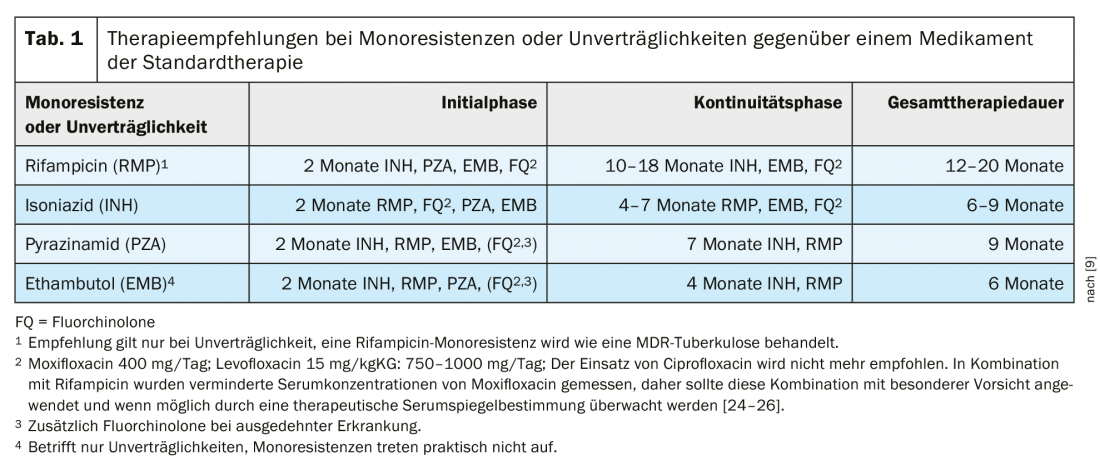
Tratamento da tuberculose com monoresistência ou intolerância à rifampicina
Nas recomendações da OMS, a monorresistência à rifampicina é equiparada à tuberculose MDR. A resistência à Rifampicina (RR) raramente ocorre sem resistência à isoniazida. Uma vez que a ausência de rifampicina tem um sério impacto no sucesso da terapia, MDR- e RR-TB são frequentemente combinadas em documentos da OMS. As novas recomendações da OMS comentam que, no MDR/RR, a utilização de isoniazida de dose elevada (10 -15 mg/kgKG) é possível no contexto da terapia MDR em caso de sensibilidade comprovada ou resistência de baixo nível à isoniazida [21]. A actual directriz terapêutica alemã recomenda uma terapia diferente da resistência à rifampicina para pacientes com intolerância à rifampicina (Tab. 1).
Tratamento da tuberculose multirresistente
As recomendações da OMS foram inicialmente actualizadas em 2019 com base nas provas existentes [21]. Em 2020, uma actualização completa das recomendações seguidas com o Manual do Acompanhante associado, que se destina a enriquecer as recomendações com aspectos práticos [22,23].
Os medicamentos disponíveis para o tratamento da tuberculose resistente aos fármacos foram classificados em novos grupos pela OMS desde 2018 (Tab. 2). Esta classificação permanece válida com as novas recomendações de 2020. Especialmente a nova droga bedaquilina, mas também linezolida, é dada uma prioridade muito maior com as novas recomendações. Neste contexto, a recomendação de uma terapia completamente oral representa uma verdadeira mudança de paradigma para a maioria dos pacientes.
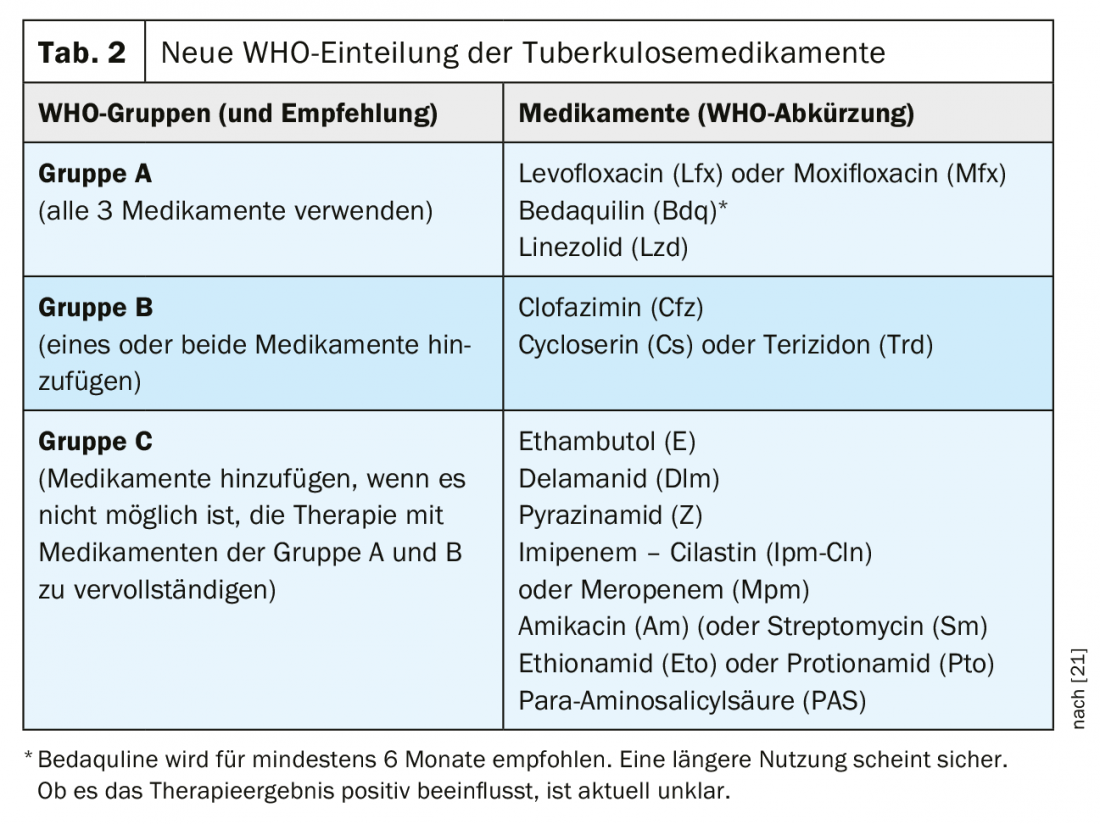
A OMS recomenda que para a terapia da tuberculose MDR [27] se junte uma combinação de pelo menos quatro medicamentos com eficácia inicialmente muito provável.
- Todas as 3 drogas do grupo A devem ser usadas, se possível, e complementadas por 1 droga do grupo B.
- Se apenas 1 ou 2 drogas do grupo A podem ser usadas, então ambas as drogas do grupo B são suplementadas.
- Se não for possível compilar uma terapia completa a partir dos grupos A e B, esta deve ser complementada por medicamentos do grupo C.
A European Respiratory Society (ERS), American Thoracic Society (ATS) e Infectious Disease Society of America (IDSA) recomendam pelo menos cinco medicamentos eficazes na fase intensiva, e quatro medicamentos depois [28].
Infelizmente, com excepção das fluoroquinolonas, os testes de resistência aos fármacos dos grupos A e B só são estabelecidos em laboratórios de referência. As novas recomendações da OMS ainda sugerem uma duração de 18-20 meses para esta terapia mais longa. No entanto, comenta-se que a duração da terapia pode ser ajustada à resposta individual à terapia MDR-TB. Para a maioria dos doentes com MDR-TB, uma duração terapêutica de 15-17 meses após a conversão da cultura deve ser suficiente. Se for utilizado amikacin ou estreptomicina, a fase intensiva com aminoglicosídeos deve durar 6-7 meses na maioria dos casos [21].
Uma inovação significativa é a desvalorização dos aminoglicosídeos na terapia MDR-TB. A OMS recomenda a sua remoção da terapia, se possível. Apenas a amikacina (alternativamente estreptomicina) deve ainda ser utilizada se não houver outra possibilidade de completar a terapia MDR-TB. A capreomicina e a canamicina já não são geralmente recomendadas.
Com as novas recomendações da OMS de 2020, a utilização de bedaquilina será agora
- para além de 6 meses,
- simultaneamente com a nova droga delamanid
- ou durante a gravidez
considerado suficientemente seguro. A base de dados para estas recomendações era limitada, pelo que deve ser possível monitorizar bem a terapia, especialmente em tais situações [22,23].
Declaração sobre as recomendações da OMS de uma perspectiva alemã
Na sequência da actualização das recomendações da OMS em 2019, foi publicada uma declaração conjunta pelo Centro de Investigação Borstel (FZB) e pelo DZK, apoiando as novas recomendações da OMS.
Para o tratamento MDR na Alemanha, o início da terapia MDR que consiste em cinco medicamentos com bedaquilina, linezolida, levo ou moxifloxacina, clofazimina e terizidona é recomendado após provas biológicas moleculares de resistência à rifampicina e exclusão da resistência à fluoroquinolona (gene gyrA posição 90, 91 e 94 tipo selvagem). Em caso de evidência biológica molecular de resistência à fluoroquinolona, deve ser implantado um sistema de porto intravenoso e iniciada terapia com bedaquilina, linezolida, clofazimina, terizidona, amikacin ou ácido meropenem/amoxicilina-clavulânico. O objectivo continua a ser a administração inicial de pelo menos cinco substâncias eficazes. A escolha de medicamentos adicionais do grupo C deve ser feita em função dos resultados dos testes de resistência [29].
Amikacin só é recomendado para o tratamento de pacientes adultos com MDR/RR-TB:
- se um regime terapêutico não puder ser montado a partir de drogas dos grupos A e B,
- os resultados dos testes de resistência sugerem que o medicamento é eficaz e que pode ser assegurado um controlo rigoroso para detectar o desenvolvimento de efeitos secundários numa fase precoce [29].
Tal monitorização é viável na maioria dos centros especializados na Alemanha e Suíça, de modo que o amikacin continua a ser uma opção terapêutica aqui. As novas recomendações da OMS de 2020 apoiam esta posição nas condições mencionadas [22].
Na Suíça, não existem recomendações específicas para a terapia da MDR-TB. Actualmente, o Gabinete Federal de Saúde Pública e a Liga Pulmonar recomendam a consulta de peritos em caso de resistência à rifampicina. Os peritos podem ser contactados nos dias úteis de 8-12 e 14-17 através do número de telefone gratuito da Liga Pulmonar Suíça 0800 388 388 . Liderado por eles, existe um grupo de especialistas clínicos, microbiologistas e especialistas em saúde pública que discutem casos complexos e respondem a perguntas de profissionais numa plataforma em linha.
Terapia a curto prazo da tuberculose multirresistente
Desde 2016, a OMS tem vindo a recomendar uma terapia de curto prazo ao longo de 9-12 meses com uma combinação fixa de medicamentos para pacientes MDR-TB seleccionados, preferindo esta terapia a uma terapia individualizada mais longa com as novas recomendações [22,23,30]. O pré-requisito para tal tratamento a curto prazo é a sensibilidade comprovada do patogéneo às fluoroquinolonas e, idealmente, a todas as outras substâncias utilizadas. Além disso, o paciente não deve ter sido previamente tratado com nenhum dos medicamentos utilizados durante mais de 1 mês. Na Europa, isto aplica-se provavelmente apenas a alguns doentes, uma vez que uma elevada proporção de casos de MDR-TB tem resistência adicional [12,31]. Por conseguinte, não se pode actualmente recomendar uma utilização preferencial da terapia de curto prazo na Alemanha [9,29].
A combinação de drogas recomendada pela OMS em 2016 continha aminoglicosídeos, que já não devem ser utilizados. Agora, dados recentes da África do Sul mostraram que a terapia de curto prazo totalmente oral usando bedaquilina melhora os resultados do tratamento e leva a menos interrupções do tratamento [32]. Para os doentes com estirpes de MDR-TB em que a susceptibilidade à fluoroquinolona tenha sido demonstrada e a terapia de curto prazo esteja indicada, a OMS recomenda, portanto, o abandono dos aminoglicosídeos em favor da bedaquilina desde 2020. A terapia de curto prazo completamente oral durante 9 -12 meses deve incluir bedaquilina, levo- ou moxifloxacina, etionamida, etambutol, pirazinamida, isoniazida de alta dose e clofazimina [22,23].
Nova terapia de combinação para MDR-TB com resistência à fluoroquinolona
A terapia combinada de bedaquilina, pré-mamaneto e linezolida (BPaL) durante 6-9 meses foi aprovada nos EUA para o tratamento da tuberculose extensivamente resistente (XDR-TB) e para o fracasso do tratamento MDR-TB desde 14 de Agosto de 2019. A Agência Europeia de Medicamentos aprovou a prétonamida em Julho de 2020 para o tratamento da tuberculose XDR ou MDR TB na ausência de outras opções de tratamento. O novo nitroimidazol Pretomanid foi desenvolvido pela organização sem fins lucrativos TB-Aliança e a terapia combinada foi testada em 109 pacientes na África do Sul. Um estudo de rótulo aberto sem braço comparador (Nix-TB) levou à aprovação, que foi capaz de mostrar boa eficácia com um sucesso de tratamento de 90% em situações de resistência complicadas [33].
A OMS comparou dados do ensaio Nix TB com dados de doentes que receberam bedaquilina e linezolida como parte de uma terapia combinada durante uma média de 21-26 meses. Ambos os grupos mostraram um sucesso de tratamento muito bom de 97% (BPaL) e 92% (grupo de comparação) [23]. A análise dos dados do estudo Nix-TB mostrou que os efeitos secundários graves sob BPaL podem ocorrer em 25% dos pacientes. Linezolid foi utilizado no estudo Nix-TB numa dosagem de 1200 mg diários. Esta dosagem é aprovada para outras infecções bacterianas com uma duração mais curta da terapia. No estudo Nix-TB ocorreram com correspondente frequência reacções adversas relacionadas com a dose, tais como depressão da medula óssea e neuropatia periférica. Na sequência da experiência do estudo, a dosagem de linezolida pode ser reduzida para 600-300 mg após 4 semanas de terapia de alta dose em caso de efeitos secundários relevantes. Uma interrupção da terapia de até 35 dias também parece possível. A duração total da terapia com BPaL deve ser de pelo menos 6 meses. Se a conversão da cultura da saliva não tiver sido alcançada após 4 meses, a duração da terapia deve ser prolongada para 9 meses [23].
A utilização de BPaL é recomendada pela OMS apenas para pacientes com MDR-TB com resistência à fluoroquinolona para os quais não é possível juntar outra terapia. Além disso, a utilização deveria estar em condições de estudo e a terapia prévia com bedaquilina ou linezolida por mais de 2 semanas não deveria ter ocorrido [23].
Estão actualmente a ser realizados mais estudos com o objectivo de melhorar a tolerabilidade da combinação de fármacos. Por exemplo, o ensaio ZeNix está a testar diferentes doses de linezolida.
Conclusão e perspectivas
A incidência global da tuberculose (TB) está actualmente a diminuir 2% por ano. Esta diminuição está longe de ser suficiente para atingir os objectivos da estratégia EndTB da OMS [2]. A resistência às drogas é aqui um obstáculo significativo. As alterações às recomendações de tratamento da OMS para MDR-TB aqui resumidas são o resultado bem-vindo da crescente investigação nesta área. O estabelecimento do diagnóstico molecular e a aprovação de três novos medicamentos para o tratamento de M/XDR-TB (bedaquilina, delamanida e pré-mamanida) representam grandes sucessos. No entanto, o número de casos de MDR-TB estimado anualmente não está a diminuir a um ritmo suficiente e apenas 51% dos casos de TB confirmados globalmente foram mesmo testados para resistência à rifampicina em 2018.
Na Alemanha e na Suíça, os números de casos MDR-TB são baixos e estão disponíveis recursos suficientes. A terapia é individualizada após extensos testes de resistência e pode levar a um melhor sucesso terapêutico [34,35]. No entanto, os maiores desafios do controlo da tuberculose no século XXI dizem respeito principalmente aos países de alta incidência com recursos limitados. Para além de novos desenvolvimentos inovadores em diagnóstico e terapia, a prevenção e, em particular, o desenvolvimento de uma vacinação eficaz será de importância decisiva na luta contra a tuberculose. Há uma necessidade urgente de melhorar o acesso global às opções diagnósticas e terapêuticas existentes e novas para todos.
Mensagens Take-Home
- A tuberculose é uma doença rara na Suíça, mas 10 milhões de pessoas em todo o mundo contraem tuberculose todos os anos.
- Na tuberculose multirresistente, os dois medicamentos mais importantes na terapia da tuberculose, a isoniazida e a rifampicina, já não são eficazes.
- A terapia na Alemanha e na Suíça é individualizada após extensos testes de resistência.
- Os métodos biológicos moleculares permitem um diagnóstico rápido para o início de uma terapia orientada. Os resultados devem ainda ser confirmados por testes fenotípicos.
- A complexa e longa terapia da tuberculose MDR deve ser orientada por especialistas experientes. Os serviços de aconselhamento gratuitos estão disponíveis na Liga Suíça dos Pulmões (tel.: 0800 388 388).
Literatura:
- Prideaux B, et al.: A associação entre a actividade de esterilização e a distribuição de drogas em lesões de tuberculose. Nat Med 2015; 21(10): 1223-1227.
- Relatório global da tuberculose de 2019. Genebra: Organização Mundial de Saúde 2019. Licença: CC BY-NC-SA 3.0 IGO.
- Global tuberculosis report 2018, Organização Mundial de Saúde Genebra.
- Relatório sobre a epidemiologia da tuberculose na Alemanha para 2018. Instituto Robert Koch 2019.
- Mase SR, et al: Yield of serial sputum specimen examinations in the diagnosis of pulmonary tuberculosis: a systematic review. Int J Tuberc Lung Dis 2007; 11(5): 485-495.
- Manual operacional da OMS sobre tuberculose. Módulo 3: diagnóstico – diagnóstico rápido para a detecção da tuberculose. Genebra: Organização Mundial de Saúde 2020. Licença: CC BY-NC-SA 3.0 IGO.
- A OMS consolidou as directrizes sobre tuberculose. Módulo 3: diagnóstico – diagnóstico rápido para a detecção da tuberculose. Genebra: Organização Mundial de Saúde 2020. Licença: CC BY-NC-SA 3.0 IGO.
- Tostmann A, et al: Transmissão da tuberculose por doentes com tuberculose pulmonar negativa em grande coorte nos Países Baixos. Clin Infect Dis 2008; 47(9): 1135-1142.
- Schaberg T, et al.: Tuberculosis Guideline for Adults – Guideline for Diagnosis and Treatment of Tuberculosis including LTBI Testing and Treatment of the German Central Committee (DZK) and the German Respiratory Society (DGP). Pneumologia 2017; 71(6): 325-397.
- Lange CI, Abukabar I, Alffenaar JW: Gestão de doentes com tuberculose multirresistente/extensivamente resistente aos medicamentos na Europa: uma declaração de consenso TBNET. 2014.
- OMS, Relatório técnico sobre concentrações críticas para testes de susceptibilidade aos medicamentos para a tuberculose utilizados no tratamento da tuberculose resistente a fármacos. 2018.
- Otto-Knapp R, et al: Resistência aos medicamentos de segunda linha em migrantes com tuberculose multirresistente na região de Berlim. Pneumologia 2014; 68: 496-500.
- Lange C, et al: Gestão de doentes com tuberculose multirresistente/extensivamente resistente aos medicamentos na Europa: uma declaração de consenso TBNET. The European Respiratory Journal 2014; 44: 23-63.
- Serviço Nacional de Infecções da Saúde Pública Inglaterra. National Mycobacterium Reference Service-South (NMRS-South). Manual do utilizador de 2019.
- Allix-Beguec C, et al: Predição da Susceptibilidade a Medicamentos para a Tuberculose de Primeira Linha através da Sequenciação do ADN. N Engl J Med 2018; 379(15): 1403-1415.
- Galagan JE: Percepções genómicas sobre a tuberculose. Nat Rev Genet 2014; 15(5): 307-320.
- Nikolayevskyy V, et al: Sequenciação do genoma inteiro de Mycobacterium tuberculosis para detecção de surtos recentes de transmissão e rastreio: Uma revisão sistemática. Tuberculose (Edinb) 2016; 98: 77-85.
- Merker M, et al: The Evolution of Strain Typing in the Mycobacterium tuberculosis Complex. Adv Exp Med Biol 2017; 1019: 43-78.
- Meehan CJ, et al: Sequenciação de todo o genoma de Mycobacterium tuberculosis: padrões actuais e questões em aberto. Nat Rev Microbiol 2019; 17(9): 533-545.
- OMS, WHO, WHO treatment guidelines for isoniazid-resistant tuberculosis: Supplement to the WHO treatment guidelines for drug-resistant tuberculosis 2018; Organização Mundial de Saúde: Genebra.
- OMS, OMS consolidou directrizes sobre o tratamento da tuberculose resistente aos medicamentos de 2019; Organização Mundial de Saúde Genebra
- A OMS consolidou as directrizes sobre tuberculose. Módulo 4: tratamento – tratamento contra a tuberculose resistente aos medicamentos. Genebra: Organização Mundial de Saúde 2020. Licença: CC BY-NC-SA 3.0 IGO.
- Manual operacional da OMS sobre tuberculose. Módulo 4: tratamento – tratamento contra a tuberculose resistente aos medicamentos. Genebra: Organização Mundial de Saúde 2020. Licença: CC BY-NC-SA 3.0 IGO.
- Weiner M, et al.: Efeitos do polimorfismo dos genes rifampicina e multirresistência às drogas sobre as concentrações de moxifloxacina. Antimicrob Agents Chemother 2007; 51(8): 2861-2866.
- Nijland HM, et al.: Rifampicina reduz as concentrações plasmáticas de moxifloxacina em doentes com tuberculose. Clin Infect Dis 2007; 45(8): 1001-1007.
- Alsultan A, Peloquin CA: Controlo de medicamentos terapêuticos no tratamento da tuberculose: uma actualização. Drogas 2014; 74(8): 839-854.
- Ahmad N, et al: O tratamento correlaciona os resultados de sucesso na tuberculose multirresistente pulmonar: uma meta-análise de dados individuais do doente. Lancet 2018; 392(10150): 821-834.
- Nahid P, et al: Tratamento da Tuberculose Resistente às Drogas. Uma Directriz Oficial de Prática Clínica ATS/CDC/ERS/IDSA. Am J Respir Crit Care Med 2019; 200(10): e93-e142.
- Maurer B, et al.: Declaração conjunta sobre a nova recomendação da OMS sobre o tratamento da tuberculose multirresistente e resistente à rifampicina. Pneumologia 2019; 1-4 (no prelo).
- Directrizes de tratamento da OMS para a tuberculose drugresistant – Actualização 2016.
- Günther G, et al: Multidrug-resistant tuberculosis in Europe, 2010-2011. Emerging Infectious Diseases 2015; 21: 409-416.
- Comunicação rápida: mudanças fundamentais no tratamento da tuberculose resistente aos medicamentos. Genebra: Organização Mundial de Saúde 2019 (OMS/CDS/TB/2019.26). Licença: CC BY-NC-SA 3.0 IGO.
- Conradie F, et al: Tratamento da Tuberculose Pulmonar Altamente Resistente a Drogas. New England Journal of Medicine 2020; 382(10): 893-902.
- Olaru ID, et al: Regime de tratamento à base de Bedaquilina para a tuberculose multirresistente. Eur Respir J 2017; 49(5).
- Heyckendorf J, et al: Cura sem recidiva da tuberculose multirresistente na Alemanha. Eur Respir J 2018; 51(2).
InFo PNEUMOLOGIA & ALERGOLOGIA 2020: 2(3): 6-11