As paranodopatias são uma nova forma especial de polineuropatias inflamatórias mediadas por danos auto-induzidos pelo auto-anticorpo no anel de laço de Ranvier. Quais são as características desta doença e como pode ser tratada?
As polineuropatias são um grupo heterogéneo de doenças que resultam de danos na bainha do axônio ou mielina dos nervos periféricos. Embora a causa permaneça pouco clara em cerca de 25% de todas as polineuropatias, a diferenciação etiológica é essencial na prática clínica [1,2]. Desta forma, podem ser identificadas causas tratáveis e oferecidas terapias específicas, especialmente para as neuropatias imunitárias. Para além da história, exame e diagnóstico laboratorial, os diagnósticos básicos incluem a eletroneurografia, que pode distinguir entre um padrão axonal e desmielinizante, e a ultra-sonografia nervosa. Nos últimos anos, foi descrita a nova entidade das paranodopatias, que não pode ser atribuída ao conceito clássico de “axonal” e “desmielinizante” [3–5]: Aqui, o anel de laço de Ranvier representa o ponto de partida da doença. Os auto-anticorpos paranodais são biomarcadores valiosos nas neuropatias imunitárias, uma vez que as paranodopatias diferem das outras neuropatias imunitárias em termos de resposta à terapia.
Neuropatias inflamatórias
As neuropatias inflamatórias incluem as neuropatias infecciosas, que são raras na Europa Central, e as neuropatias auto-imunes, que, com uma prevalência de cerca de 10%, são a terceira causa mais comum de todas as polineuropatias após as polineuropatias diabéticas e etil tóxicas [2,6]. Os principais representantes das formas desmielinizantes são a síndrome de Guillain-Barré aguda (GBS), a polineuropatia inflamatória crónica desmielinizante (CIDP) e a neuropatia motora multifocal (MMN). Nestas doenças, a bainha de mielina é danificada por processos imunitários humorais e celulares, e a destruição axonal pode ocorrer secundariamente. Na neuropatia vasculítica, por outro lado, os danos axonais isquémicos ocorrem devido ao envolvimento maioritariamente isolado do vasa nervorum. Para o diagnóstico diferencial das neuropatias imunitárias, o curso, o padrão de distribuição, o diagnóstico laboratorial e, acima de tudo, a electrofisiologia e a biopsia nervosa são decisivos. A diferenciação exacta é particularmente importante no que diz respeito às diferentes opções terapêuticas (tab. 1).
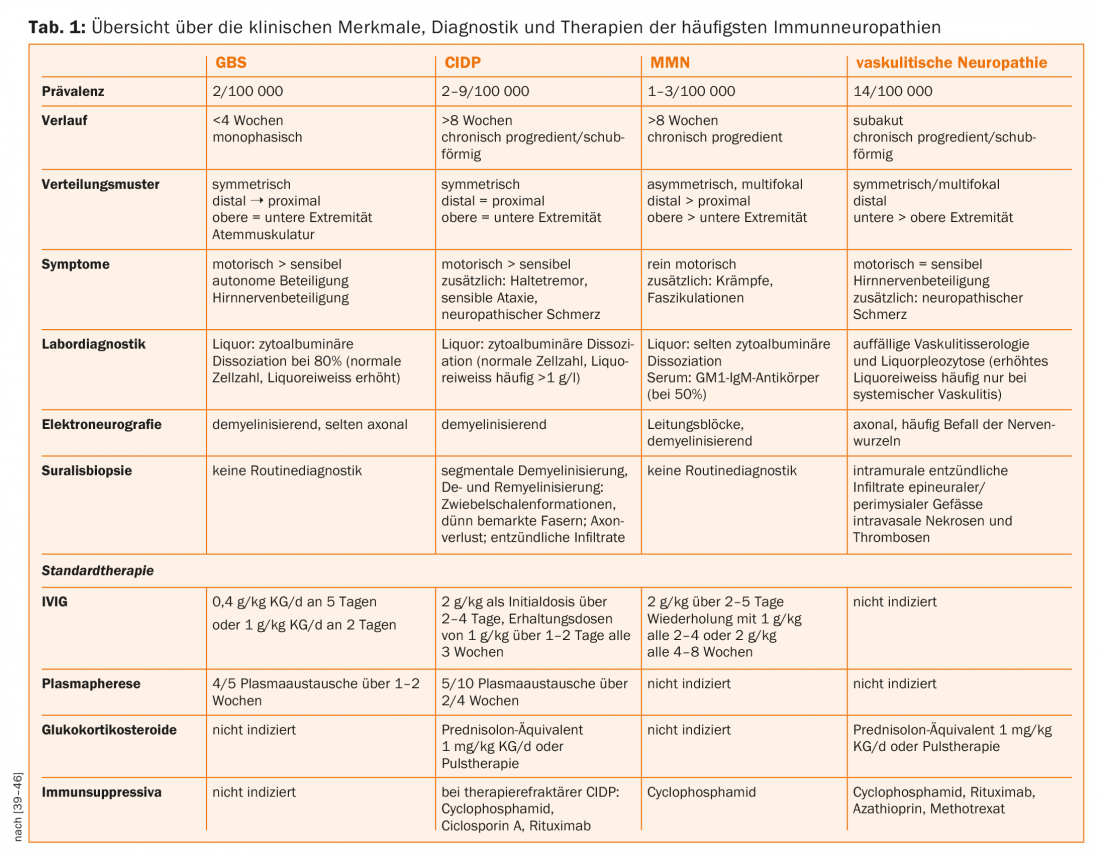
O paranodio como ponto de partida de raras neuropatias imunitárias
O anel de cordão de Ranvier de nervos mielinizados periféricos está subdividido em três secções (Fig. 1). No nódico, os canais de sódio dependentes da tensão, responsáveis pela transmissão da excitação salina, são agrupados por neurofascina-186 [7]. A região é ladeada pelo paranodio, onde os laços terminais de mielina se encontram soltos em torno do axônio. O complexo proteico de neurofascina glial-155 e de contacto axonal em-1 e caspr-1 liga aqui a mielina e o axão e é crucial para manter a arquitectura nodal e as velocidades normais de condução nervosa [8,9]. Lateralmente, os canais de potássio em tensão estão concentrados no juxtaparanodio por um complexo proteico de contactin-2 e caspr-2 [10].
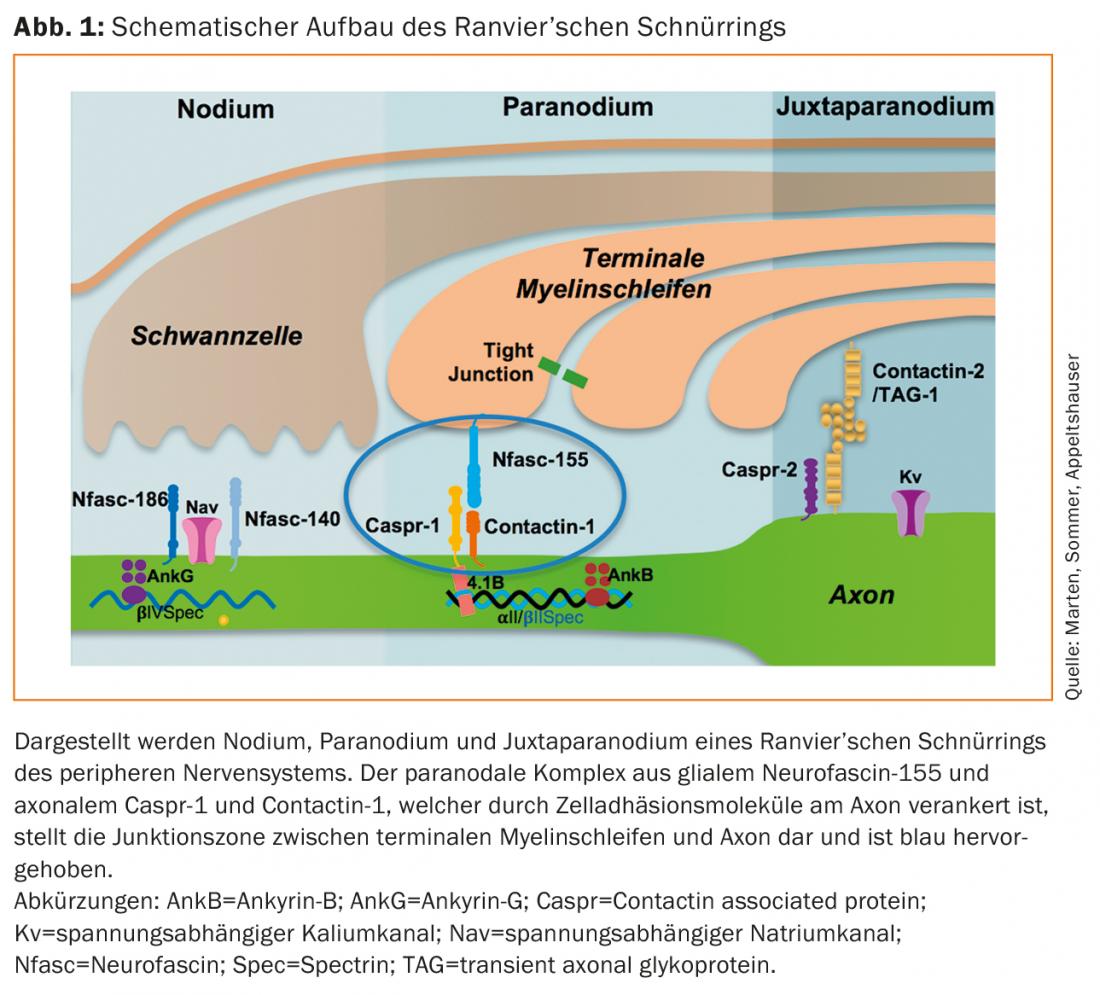
Vários estudos histopatológicos descrevem uma alteração da arquitectura do anel de laço em várias polineuropatias [11–13]. Nos últimos anos, autoanticorpos IgG e mais recentemente autoanticorpos IgM contra as proteínas paranodais neurofascin-155, contactin-1 e caspr-1 têm sido descritos em doentes com neuropatias imunitárias [14–20]. A maioria são auto-anticorpos da subclasse 4 IgG independente do complemento, mas os auto-anticorpos IgG3 também foram descritos em doentes na fase aguda da doença, que podem ligar-se e activar o complemento in vitro [16,21]. Electrofisiologicamente, estas neuropatias imunitárias mediadas por autoanticorpos podem preencher os critérios do CIDP ou GBS, mas não histopatologicamente. Aqui, não há desmielinização e remineralização dependente de macrófagos, mas sim danos axonais (secundários) e descolamento dos loops terminais da mielina do axônio paranodal, bem como alongamento dos nódulos e dispersão das proteínas paranodais e canais iônicos [14,16,22,23]. Pensa-se que esta perturbação arquitectónica do anel de ligação de Ranvier é responsável por bloqueios de condução e velocidades prolongadas de condução nervosa nas paranodopatias [5,24]. Modelos de transferência passiva confirmam a destruição paranodal e blocos de condução in vivo após injecção de autoanticorpos IgG4 e IgG-155 anti-contactina-1 e anti-neurofascina-155 [25,26]. O ponto de partida da doença não é portanto a bainha de mielina mas sim o anel do cordão, razão pela qual não é possível qualquer atribuição às categorias clássicas “axonal” ou “desmielinizante”. Portanto, o termo “paranodopatia”, que originalmente se referia a neuropatias imunitárias anti-gangliosídios associados a auto-anticorpos, foi agora estabelecido para se referir especificamente a neuropatias imunitárias com auto-anticorpos paranodais [3,4,22,27].
Características clínicas, diagnósticos e terapia
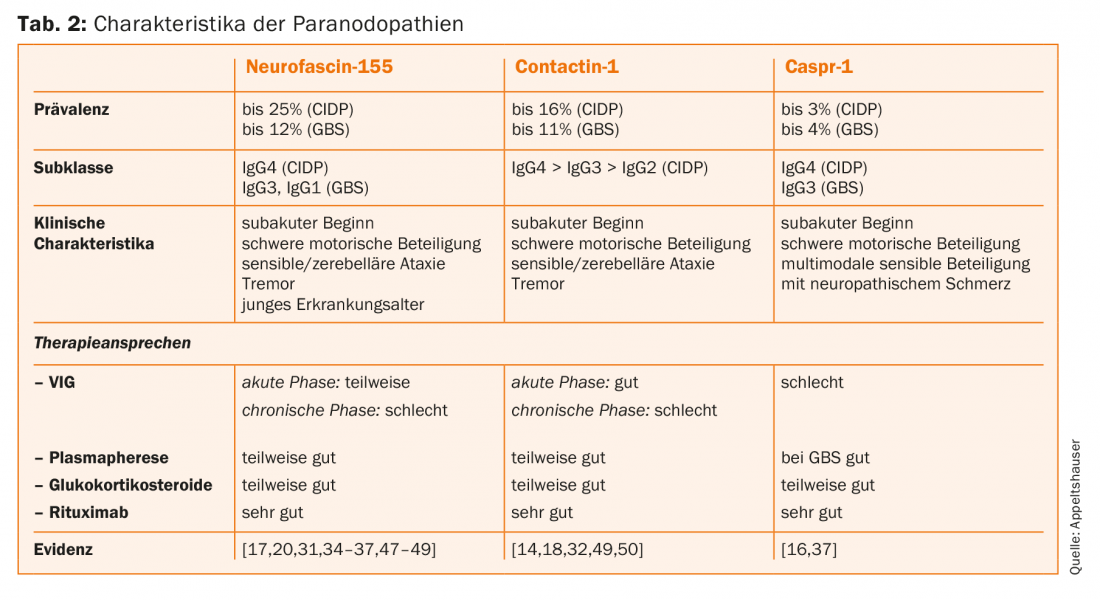
Os auto-anticorpos paranodais têm sido até agora identificados quase exclusivamente em doentes com o quadro clínico do CIDP e GBS. As prevalências são geralmente cerca de <10% [28–30]. Os doentes afectados mostram um início agudo ou subagudo da doença e desenvolvem um grave envolvimento motor. Além disso, um tremor pronunciado e uma ataxia sensorial podem agravar o curso clínico [31,32]. Os anticorpos IgG4 contra a neurofascina-155 têm a maior prevalência [33]. Nestes doentes seropositivos, focos centrais de desmielinização, tremor e ataxia cerebelar também foram descritos como possíveis sinais de danos mediados por autoanticorpos centrais. O patomecanismo e a prevalência de autoanticorpos anti-neurofascina-155 IgG em doentes com envolvimento central e periférico clinicamente combinado não foram suficientemente investigados e são discutidos de forma controversa na literatura [30,33–36]. Autoanticorpos contra Caspr-1 raramente foram detectados, mas autoanticorpos IgG4 foram descritos em doentes com um curso crónico e autoanticorpos IgG3 num doente com GBS [16,37]. A dor neuropática foi proposta como uma característica comum com um correlato histopatológico, nomeadamente a ligação dos auto-anticorpos aos neurónios nociceptivos do gânglio espinhal. No entanto, faltam estudos clínicos e experimentais de maior envergadura para confirmar esta situação [16]. O quadro 2 dá uma visão geral das características específicas de autoanticorpos das paranodopatias.
Os auto-anticorpos podem ser detectados em soro através de ELISA, bem como ensaios de ligação em nervos de rato ou de rato e células transfectadas (Fig. 2) [33]. Ainda não está disponível nenhum teste comercial validado, mas os testes são possíveis em laboratórios de investigação especializados. O rastreio só é útil em pacientes com o fenótipo clínico típico. No caso de neuropatias sensoriais-motoras suaves, crónicas e distais, por outro lado, uma clarificação das causas comuns é útil.
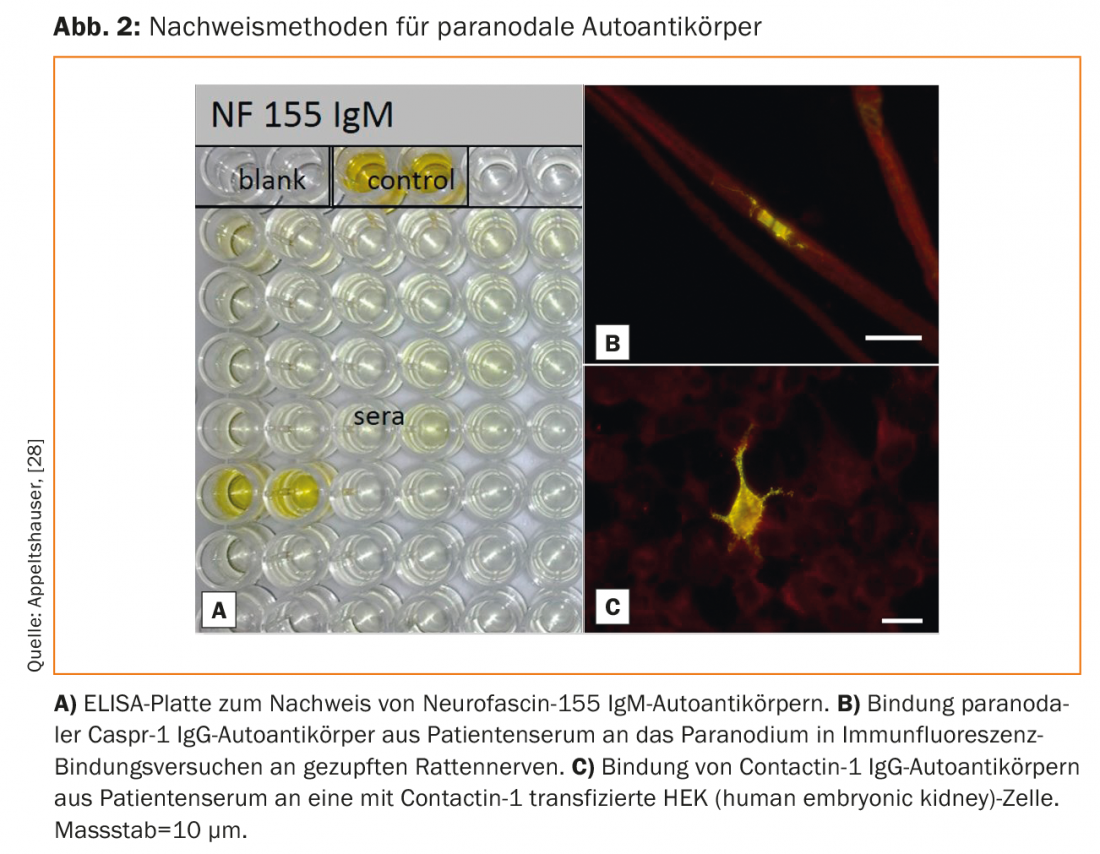
Devido ao baixo número de casos de pacientes com paranodopatias, não existem até agora estudos terapêuticos controlados. As séries de casos indicam que, ao contrário do CIDP clássico, os pacientes com paranodopatia mediada por IgG4 respondem mal, enquanto os pacientes com paranodopatia mediada por IgG3 respondem bastante bem ao IVIG [14,21,30].
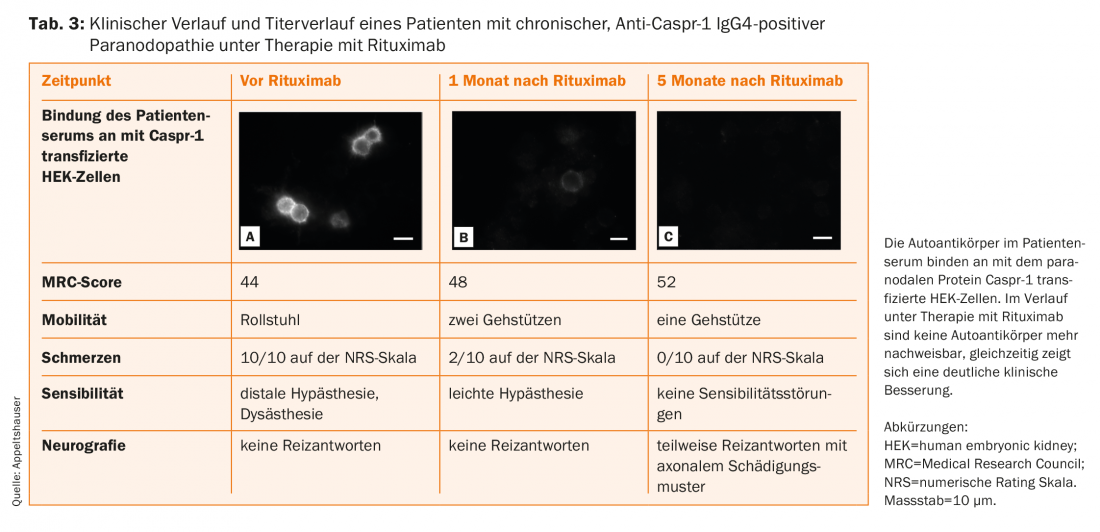
Os doentes com auto-anticorpos IgG4 respondem muito bem ao rituximab na série de casos, com uma redução significativa dos títulos de anticorpos como parâmetro substituto (Tab. 3) [14,16,20,38]. É possível que um início precoce da terapia evite danos axonais crónicos. Por conseguinte, a actual directriz também recomenda um ensaio terapêutico individual com rituximab se forem detectados auto-anticorpos paranodais IgG4, o qual deve ser realizado sob acompanhamento atento em centros especializados [39]. Além disso, o acompanhamento de pacientes com paranodopatias é essencial para uma melhor compreensão desta nova entidade.
Mensagens Take-Home
- A etiologia das polineuropatias inflamatórias é heterogénea e difere entre as polineuropatias axonais e desmielinizantes.
- As paranodopatias são uma nova forma especial de polineuropatias inflamatórias, mediadas por danos auto-induzidos pelo auto-anticorpo no anel de laço de Ranvier.
- As características clínicas das paranodopatias são: início subagudo, envolvimento motor severo, má resposta às terapias padrão, tremor e idade jovem de início para auto-anticorpos à neurofascina-155, mais ataxia para auto-anticorpos de contacto à caspr-1 e dor para anticorpos à caspr-1.
- A identificação de doentes com auto-anticorpos paranodais é importante para uma melhor compreensão da doença e para as decisões terapêuticas.
Literatura:
- Pasnoor M, et al: A polineuropatia sensorial criptogénica. Neurol Clin 2013; 31(2): 463-476.
- Visser NA, et al: Incidência de polineuropatia em Utrecht, Países Baixos. Neurologia 2015; 84(3): 259-264.
- Uncini A: Um mecanismo comum e uma nova categorização para neuropatias mediadas por anticorpos anti-ganglioside. Exp Neurol 2012; 235(2): 513-516.
- Uncini A, Vallat JM: Paranodopatias auto-imunes do nervo periférico: o conceito está a ganhar terreno. J Neurol Neurosurg Psychiatry 2017; 89(6): 627-635.
- Uncini A, Susuki K, Yuki N: Nodo-paranodopatia: para além da classificação desmielinizante e axonal em neuropatias mediadas por anticorpos anti-ganglioside. Clin Neurophysiol 2013; 124(10): 1928-1934.
- Hanewinckel R, et al: Prevalência de polineuropatia na população geral de meia-idade e idosos. Neurologia 2016; 87(18): 1892-1898.
- Stathopoulos P, Alexopoulos H, Dalakas MC: alvos antigénicos auto-imunes no nó de Ranvier em perturbações desmielinizantes. Nat Rev Neurol 2015; 11(3): 143-156.
- Vallat JM, et al: Contactin-Associated Protein 1 (CNTNAP1) Mutations Induce Characteristic Lesions of the Paranodal Region. J Neuropathol Exp Neurol 2016; 75(12): 1155-1159.
- Sherman DL, et al.: As neurofascinas são necessárias para estabelecer domínios axonais para a condução salina. Neuron 2005; 48(5): 737-742.
- Poliak S, et al: Caspr2, um novo membro da superfamília neurexina, está localizado nos justaparanódios dos axónios mielinizados e associa-se aos canais K+. Neuron 1999; 24(4): 1037-1047.
- Doppler K, et al: Perturbação da arquitectura nodal em biópsias de pele de pacientes com neuropatias desmielinizantes. J Peripheral Nerv Syst 2013; 18(2): 168-176.
- Li J, et al.: Biopsias de pele em neuropatias relacionadas com a mielina: trazer a patologia molecular para a beira do leito. Cérebro 2005; 128(5): 1168-1177.
- Cifuentes-Diaz C, et al.: Nodos de ranvier e paranodos em neuropatias crónicas adquiridas. PloS one 2011; 6(1): e14533.
- Doppler K, et al: Destruição da arquitectura paranodal em neuropatia inflamatória com autoanticorpos anti-contactina-1. J Neurol Neurosurg Psychiatry 2015; 86(7): 720-728.
- Devaux JJ, et al: Os anticorpos da gliomedina causam neuropatia periférica desmielinizante e o desmantelamento dos nós de Ranvier. Am J Pathol 2012; 181(4): 1402-1413.
- Doppler K, et al: Auto-anticorpos para a proteína 1 associada à contactina (Caspr) em dois doentes com neuropatia inflamatória dolorosa. Cérebro 2016; 139(10): 2617-2630.
- Ng JK, et al: Neurofascin como alvo de auto-anticorpos em neuropatias periféricas. Neurologia 2012; 79(23): 2241-2248.
- Devaux JJ, Odaka M, Yuki N: As proteínas nodais são antigénios alvo na síndrome de Guillain-Barré. J Nervo Periférico Syst 2012; 17(1): 62-71.
- Doppler K, et al: Neurofascin-155 IgM autoanticorpos em doentes com neuropatias inflamatórias. J Neurol Neurosurg Psychiatry 2018; 89(11): 1145-1151.
- Burnor E, et al: Anticorpos neurofascínicos em neuropatias auto-imunes, genéticas, e idiopáticas. Neurologia 2018; 90(1): e31-e38.
- Appeltshauser L, et al.: O depósito complementar induzido pela ligação de autoanticorpos anti-contato-1 é modificado por imunoglobulinas. Exp Neurol 2017; 287(1): 84-90.
- Koike H, et al: dissecção paranodal em polineurofascina desmielinizante crónica com anticorpos anti-neurofascina-155 e anti-contactina-1. J Neurol Neurosurg Psychiatry 2017; 88(6): 465-473.
- Vallat JM, et al: nodopatia subaguda com bloqueios de condução e anticorpos anti-neurofascina 140/186: um estudo ultra-estrutural. Cérebro de 2018; 141(7): e56.
- Vallat JM, et al: Lesões paranodais em polineurofascina desmielinizante crónica associada a anticorpos anti-neurofascina 155. Neuromuscul Disord 2017; 27(3): 290-293.
- Manso C, et al: Os anticorpos IgG4 contactin-1 causam defeitos de desmantelamento e de condução dos paranódios. Cérebro 2016; 139(6): 1700-1712.
- Yan W, et al: Anticorpos para a neurofascina exacerbam a neurite auto-imune experimental de transferência adoptiva. J Neuroimmunol 2014; 277(1-2): 13-17.
- Kuwabara S, Misawa S, Mori M: Nodopatia: polineurofascina desmielinizante crónica com anticorpos anti-neurofascina 155. J Neurol Neurosurg Psychiatry 2017; 88(6): 459.
- Doppler K, et al: Contactin-1 e Neurofascin-155/-186 não são alvos de Auto-Antibodies in Multifocal Motor Neuropathy. PloS one 2015; 10(7): e0134274.
- Doppler K, Sommer C: Nova entidade de paranodopatias: uma estrutura alvo com consequências terapêuticas. Neurol Akt 2017; 44(3): 194-199.
- Hu W, et al: Association of neurofascin IgG4 and atypical chronic inflammatory demyelinating polyneuropathy: A systematic review and meta-analysis. Brain Behav 2018: 8(10): e1115.
- Querol L, et al: Os anticorpos Neurofascin IgG4 no CIDP associam-se a um tremor incapacitante e a uma fraca resposta ao IVIg. Neurologia 2014; 82(10): 879-886.
- Miura Y, et al: Contactin 1 IgG4 associa a polineuropatia desmielinizante crónica inflamatória com ataxia sensorial. Cérebro 2015; 138(6): 1484-1491.
- Vural A, Doppler K, Meinl E: Autoanticorpos contra o Nodo de Ranvier em Polineuropatia Seropositiva Inflamatória Crónica Desmielinizante: Relevância Diagnóstica, Patogénica, e Terapêutica. Immunol frontal 2018; 9: 1029.
- Kawamura N, et al: anticorpo anti-neurofascina em doentes com desmielinização central e periférica combinada. Neurologia 2013; 81(8): 714-722.
- Devaux JJ, et al: Neurofascin-155 IgG4 em polineurofascina desmielinizante crónica inflamatória. Neurologia 2016; 86(9): 800-807.
- Ogata H, et al: Characterization of IgG4 anti-neurofascin 155 anti-corpo-positivo polineuropatia. Ann Clin Transl Neurol 2015; 2(10): 960-971.
- Delmont E, et al: Autoanticorpos a isoformas nodais de neurofascina em polineuropatia inflamatória desmielinizante crónica. Cérebro 2017; 140(7): 1851-1858.
- Querol L, et al: Rituximab em CIDP resistente ao tratamento com anticorpos contra proteínas paranodais. Neurol Neuroimmunol Neuroinflamm 2015; 2(5): e149.
- Sommer C, et al.: Therapy of acute and chronic immune-mediated neuropathies and neuritis, S2e guideline, 2018. In: Commission on Guidelines of the German Neurological Society: Guidelines for Diagnosis and Therapy in Neurology.
- Vedeler CA, Farbu E, Mellgren SI: polineuropatia desmielinizante inflamatória crónica (CIDP). Acta Neurol Scand Suppl 2013; 196: 48-51.
- Saperstein DS, et al: Espectro clínico das polineuropatias crónicas desmielinizantes adquiridas. Nervo Muscular 2001; 24(3): 311-324.
- Muley SA, Parry GJ: Neuropatia Motora Multifocal. J Clin Neurosci 2012; 19(9): 1201-1209.
- Sommer C, et al: Polyneuropathies. Dtsch Arztebl Int 2018; 115(6): 83-90.
- Hadden RDM, et al: Neuropatia periférica vasculítica: Definição de casos e orientações para a recolha, análise e apresentação de dados de segurança de imunização. Vacina 2017; 35(11): 1567-1578.
- Collins MP, Hadden RD: As neuropatias vasculíticas não-sistémicas. Nat Rev Neurol 2017; 13(5): 302-316.
- Callaghan BC, et al: The Importance of Rare Subtypes in Diagnosis and Treatment of Peripheral Neuropathy: A Review. JAMA Neurol 2015; 72(12): 1510-1518.
- Kadoya M, et al: IgG4 anti-neurofascina155 anticorpos em poliradiculoneuropatia desmielinizante crónica inflamatória: Significado clínico e utilidade diagnóstica de um ensaio convencional. J Neuroimmunol 2016; 301: 16-22.
- Cortese A, et al: Neurofascin-155 como antígeno putativo na desmielinização central e periférica combinada. Neurol Neuroimmunol Neuroinflamm 2016; 3(4): e238.
- Mathey EK, et al: Autoantibody responses to nodal and paranodal antigens in chronic inflammatory neuropathies. J Neuroimmunol 2017; 309: 41-46.
- Querol L, et al: Anticorpos de contacto em polineuropatia crónica desmielinizante inflamatória. Ann Neurol 2013; 73(3): 370-380.
InFo NEUROLOGIA & PSYCHIATRY 2018; 16(6): 14-18.