A modificação do estilo de vida (exercício, dieta) e a metformina continuam a ser as pedras angulares no tratamento da diabetes mellitus tipo 2. Antes de iniciar a terapia antidiabética, recomenda-se a definição de um alvo individual de HbA1c. As vantagens dos novos medicamentos antidiabéticos orais (DAO) são o baixo risco de hipoglicémia, perda de peso ou neutralidade de peso e geralmente boa tolerabilidade. Os inibidores SGLT2 induzem a perda de glicose renal e só são eficazes com a função renal preservada. Devido ao novo mecanismo de acção, eles podem ser bem combinados com outros DAOs. Com base na eficácia e no perfil de efeitos secundários dos novos medicamentos antidiabéticos, deve procurar-se uma combinação terapêutica óptima e individual para cada paciente.
Devido a novas descobertas e desenvolvimentos, novos princípios importantes foram estabelecidos no tratamento da diabetes tipo 2 e encontraram o seu caminho para as actuais directrizes: Deve ser estabelecido um objectivo individual de HbA1c na gama de 6,5-8,0% para cada doente, tendo em conta a duração da doença, doenças concomitantes, esperança de vida, recursos pessoais e sociais. Uma redução das complicações macrovasculares também pode ser alcançada se se conseguir um controlo óptimo sustentável da diabetes desde o início da doença (HbA1c 6,5-7,0%). Por outro lado, uma redução de HbA1c <7,0% “a qualquer preço” leva a uma hipoglicemia frequente e a um aumento da mortalidade no caso de complicações cardiovasculares já existentes e de longa duração da doença [1]. Embora o papel da metformina como terapia de primeira linha juntamente com a modificação do estilo de vida seja indiscutível, existem numerosas opções de combinação a escolher na segunda etapa após a introdução de incrementos e gliflozinas, que serão discutidas em pormenor mais adiante.
Notícias sobre os “velhos” antidiabéticos orais
Metformina: No diagnóstico da diabetes tipo 2 ou pouco depois, todos os pacientes devem receber terapia com metformina se não for possível alcançar um controlo óptimo da diabetes através da modificação do estilo de vida e se o tratamento for gastrointestinalmente tolerado. Metformina é fortemente HbA1c-baixa, reduz complicações micro e macrovasculares, retarda a progressão da diabetes, não causa hipoglicemia, suporta a perda de peso e é rentável. A insuficiência renal com um eGFR <30 ml/min é uma contra-indicação importante devido ao risco de acidose láctica potencialmente fatal. Se o eGFR cair para 30-45 ml/min, a terapia pré-existente pode ser continuada com um máximo de 1000 mg diários; não se recomenda o início da terapia. O tratamento pode ser reiniciado a um eGFR de 45-60 ml/min, com recomendações de dose máxima diária de 1000-2000 mg variando [2].
É crucial instruir os pacientes para fazerem uma pausa na terapia em caso de doenças intercorrentes (operações, infecções, insuficiência cardíaca, etc.). Se estiver planeada a utilização de meios de contraste de raios X contendo iodo, a metformina deve ser parada 48 horas antes num eGFR <45 ml/min (administração intravenosa) ou <60 ml/min (administração intrarterial). Com função renal estável documentada, o reinício da terapia é possível 48 horas após a administração de contraste [3]. Como resultado da interferência na absorção de vitamina B12, a deficiência de vitamina B12 ocorre em 10-15% dos doentes que tomam metformina e deve ser procurada e substituída se estiverem presentes sinais, especialmente na polineuropatia periférica.
Gliclazida: Das sulfonilureias disponíveis, apenas é recomendada a utilização de gliclazida, uma vez que as preparações de acção prolongada, especialmente a glibenclamida, têm um risco acrescido de hipoglicémia e a sua utilização pode estar associada a um aumento da mortalidade [4]. Com apenas um ligeiro aumento do risco de hipoglicémia, a segurança cardiovascular e a redução da incidência de complicações microvasculares foram adequadamente demonstradas com gliclazida [5]. A gliclazida é potente HbA1c-lowering, a sua utilização associada a um ligeiro aumento de peso.
Glitazonas: Das glitazonas, apenas a pioglitazona ainda está disponível após a retirada da rosiglitazona do mercado em 2010, porque foram observados eventos cardiovasculares acrescidos com a terapia. O mecanismo de acção baseia-se numa melhoria da sensibilidade à insulina, resultando num potente efeito de redução do HbA1c sem um aumento do risco de hipoglicemia. As glitazonas levam ao aumento de peso devido a um aumento de tecido adiposo subcutâneo e retenção de líquidos, razão pela qual não podem ser utilizadas na insuficiência cardíaca. Além disso, estudos recentes mostraram um aumento da incidência de fracturas osteoporóticas em mulheres na pós-menopausa [6]. A associação de tomar pioglitazona com um risco acrescido de cancro da bexiga foi questionada ou posta em perspectiva por um estudo recentemente publicado [7]. No entanto, a pioglitazona tornou-se menos importante com a disponibilidade de novas substâncias e é agora utilizada relativamente raramente, pelo menos na Suíça.
Novos medicamentos antidiabéticos (orais)
Gliflozina: Sabe-se desde o século XIX que a gliflozina, um glicosídeo isolado pela primeira vez da casca da macieira em 1835, tem um efeito glucosúrico. Em 1987, a clorizina foi utilizada pela primeira vez como um antidiabético em modelos animais e pouco depois foi reconhecida como um inibidor dos cotransportadores de glucose de sódio (SGLT) 1 e 2 (cotransportadores de glucose de sódio do rim). O SGLT2 encontra-se principalmente no túbulo proximal dos rins, o SGLT1 no túbulo proximal e no intestino delgado. Devido à fraca biodisponibilidade oral, a phlorizina não encontrou o seu caminho para a clínica, mas estimulou o desenvolvimento de novos inibidores SGLT. Até ao momento, estão disponíveis três inibidores relativamente selectivos SGLT2, canagliflozina (Invokana®), dapagliflozina (Forxiga®) e empagliflozina (Jardiance®), cuja utilização leva a uma perda de glicose renal de 60-90 g/d [8]. Estas substâncias reduzem o HbA1c em cerca de 0,5-1% em relação ao placebo, independentemente de um inibidor SGLT2 ter sido administrado como monoterapia ou em combinação. Observou-se uma redução tanto nos níveis de glicemia em jejum como nos níveis de glicemia pós-prandial. Os efeitos secundários bem-vindos foram uma redução da tensão arterial sistólica (2-8 mmHg em seis meses) e uma diminuição do peso corporal (1-3 kg em seis meses). No caso de função renal deficiente (GFR <45-60 ml/min), o efeito dos inibidores de SGLT2 diminui rapidamente [9].
Com os inibidores SGLT2, as micoses genitais ocorrem com maior frequência (cerca de 10%), razão pela qual uma boa higiene íntima deve ser observada. Se ocorrer micose, preferimos uma única terapia oral com fluconazol. As infecções do tracto urinário são também um pouco mais frequentes. Devido à diurese osmótica, podem ocorrer queixas ortostáticas, de modo que o ajustamento de qualquer terapia diurética existente deve ser considerado no início da terapia [8].
Os dados a longo prazo relativos à segurança e redução dos parâmetros micro e macrovasculares ainda não estão disponíveis. Assim, um ligeiro aumento do colesterol LDL e uma diminuição do colesterol HDL de cerca de 4% foram observados em vários estudos. Recentemente, foi também observada uma acumulação de cetoacidoses associadas à utilização de inibidores SGLT2 em doentes com diabetes tipo 2. Na maioria dos casos, poderia ser identificado um factor predisponente – doença grave, redução da ingestão de alimentos e fluidos ou uma redução da dose de insulina utilizada. Vale também a pena mencionar que a cetoacidose ocorreu com níveis ligeiramente elevados de glicose no sangue (cetoacidose euglycaemic), o que dificultou o diagnóstico [10]. Os inibidores SGLT2, como a metformina, devem ser pausados em caso de doenças intercorrentes, intervenções cirúrgicas, etc.
As gliflozinas podem ser combinadas com metformina, gliclazida, gliptins, análogos GLP-1 e insulina. A combinação com um gliptin é potente para reduzir o HbA1c e não causa hipoglicémia (Fig. 1) [11]. Na Suíça, apenas o dapagliflozin pode actualmente ser combinado com os gliptins sem aprovação prévia. A combinação com análogos GLP-1 é também potencialmente muito eficaz, mas ainda não foi aprovada na Suíça. Os inibidores SGLT2 também podem ser combinados com insulina e depois permitir frequentemente uma redução na dose de insulina. São também eficazes na diabetes tipo 1, mas não são aprovados para esta indicação.
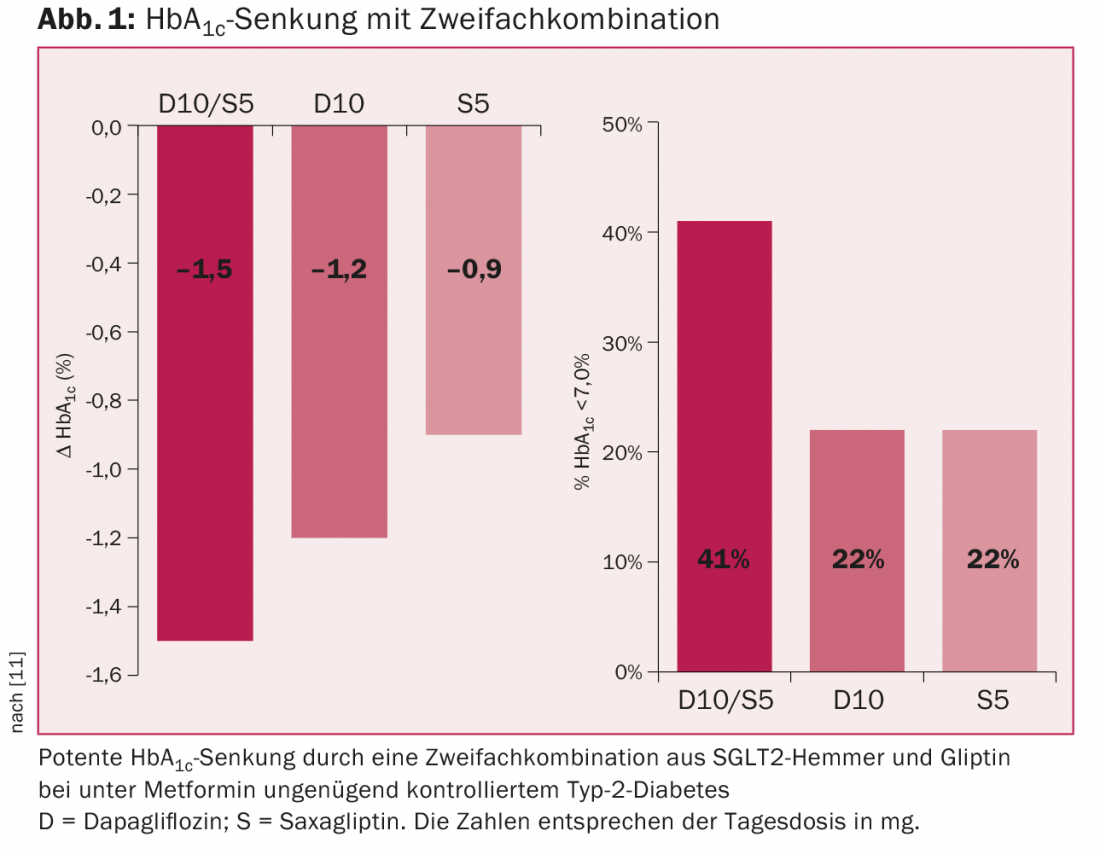
Em resumo, o uso de um inibidor SGLT2 é particularmente adequado para pacientes obesos mais jovens com função renal normal, nos quais a hipoglicémia deve ser evitada a todo o custo (por exemplo, os motoristas).
Incretins (gliptins e análogos GLP-1): Os gliptins são inibidores da peptidase dipeptidyl 4 e impedem assim a rápida decomposição dos incrementos, especialmente da GLP-1 (“glucagon como o peptídeo 1”). O melhoramento do efeito incremental ou GLP-1 leva, entre outras coisas, a um atraso no esvaziamento gástrico, activação das células β com aumento da secreção de insulina e inibição das células α (secreção de glucagon) e gluconeogénese no fígado. Os gliptins melhoram assim os níveis de glicemia em jejum e pós-prandial. Uma redução de HbA1c com monoterapia pode ser esperada na faixa de 0,5-1,0% [12]. Os gliptins são neutros em termos de peso e não causam hipoglicémia devido ao seu efeito dependente do glucose-dependente. Em geral, os gliptins são muito bem tolerados. Após terem sido levantadas preocupações acerca da segurança cardiovascular com base em resultados anteriores (aumento das hospitalizações devido à insuficiência cardíaca com saxagliptin no estudo Savor-TIMI 53), os estudos de acompanhamento não mostraram qualquer aumento da insuficiência cardíaca ou do risco cardiovascular [13–15]. Contudo, os dados a longo prazo que demonstram uma redução nos parâmetros micro e/ou macrovasculares ainda não estão disponíveis.
Em função renal moderada e gravemente afectada (eGFR <30 ml/min), apenas a linagliptin pode ser utilizada sem ajuste de dose. Os gliptins podem ser combinados com metformina, gliclazida, inibidores de SGLT2 e insulina básica. A combinação com a insulinoterapia intensificada não é recomendada devido ao baixo benefício adicional.
A modificação da molécula GLP-1 pode também evitar a sua rápida degradação por transferência de dipeptidyl 4. A aplicação subcutânea destes análogos GLP-1 atinge níveis suprafisiológicos da GLP-1, de modo que o efeito dos análogos GLP-1 é mais forte em comparação com os gliptins. A redução de HbA1c alcançada nos ensaios clínicos é de 1,0-1,8%. Os análogos GLP-1 actualmente disponíveis diferem principalmente na sua duração de acção: exenatide (Byetta®) e lixisenatide (não disponível na Suíça) são de acção curta (meia-vida <5 horas) e principalmente níveis mais baixos de glicemia pós-prandial, enquanto as preparações de acção prolongada (meia-vida >12 Horas: Liraglutide [Victoza®], Exenatide LAR [Bydureon®], Dulaglutide [Trulicity®] e Albiglutide [Eperzan®]) baixam mais os níveis de glicose no sangue em jejum. Todos os análogos GLP-1 levam à perda de peso, em média na gama de 1-4 kg, e não causam hipoglicémia. Os efeitos secundários gastrointestinais tais como náuseas, inchaço e diarreia são relativamente frequentes e mais pronunciados com as preparações de curta duração, mas normalmente diminuem após algumas semanas. Se os sintomas persistirem, pode-se tentar um tratamento com um análogo GLP-1 alternativo de acção prolongada. A aplicação subcutânea é diária (liraglutide) ou semanal (exenatide LAR, dulaglutide, albiglutide). Os análogos GLP-1 podem ser combinados com metformina, gliclazida e pioglitazona; a prescrição simultânea de gliptins é inútil por causa do mesmo alvo. Apenas o liraglutido pode ser combinado com insulina de base (aprovação e reembolso) [16]. Os análogos GLP-1 não foram estudados nem aprovados em função renal significativamente afectada (eGFR <30 ml/min) .
A combinação fixa recentemente disponível (IDegLira, Xultophy®) de uma insulina básica (Degludec, Tresiba®) com um análogo GLP-1 (liraglutido) é uma opção de tratamento muito potente com poucos efeitos secundários e associada a um risco muito baixo de hipoglicémia. Em pacientes já tratados com insulina básica e metformina, uma redução de HbA1c de 1,9% poderia ser alcançada mudando para esta terapia. A titulação regular da dose (uma ou duas vezes por semana) com base nos níveis de glucose no sangue matinal é crucial para um tratamento bem sucedido [17].
Conclusão
Os novos medicamentos antidiabéticos abrem novas opções de tratamento para pacientes cuja diabetes não é suficientemente controlada com metformina ou com uma combinação de dois medicamentos. Os inibidores SGLT2, em particular, podem ser combinados com todos os medicamentos com glucose-baixo teor de glucose-sangue devido ao seu mecanismo especial de acção. Com terapias combinadas, uma redução de HbA1c muito potente (>1,5%) pode ser alcançada. Nenhum dos novos grupos de substâncias demonstrou ainda levar a uma redução das complicações microvasculares e/ou macrovasculares. Estudos a longo prazo demonstram a segurança cardiovascular dos gliptins.
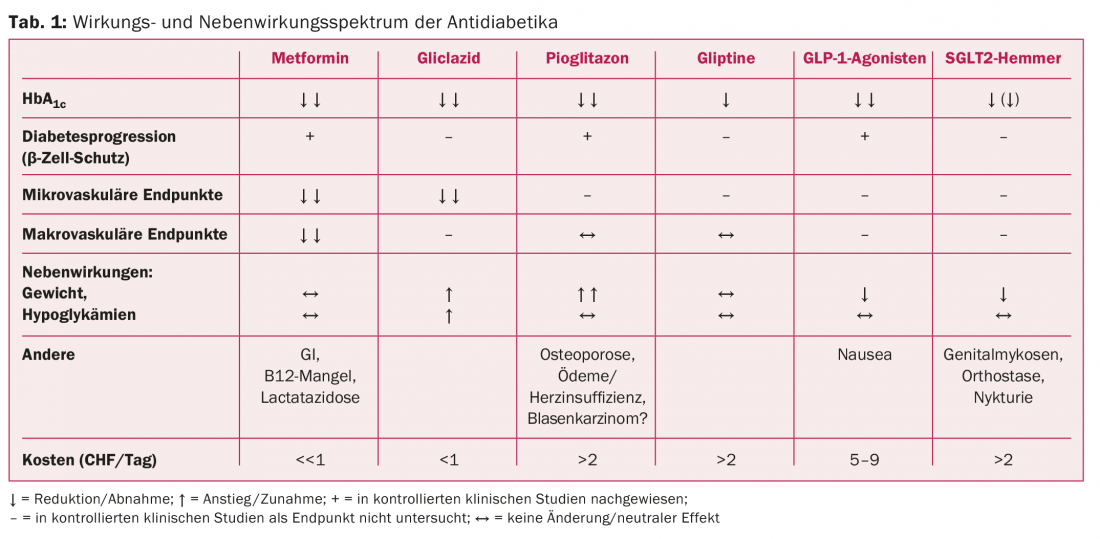
O quadro 1 mostra o espectro dos efeitos e efeitos secundários dos medicamentos antidiabéticos.
Literatura:
- American Diabetes Association, ADA Position Statement 2015: 7. Approaches to Glycemic Treatment (Abordagens ao Tratamento Glicémico). Diabetes Care 2015 Jan 1; 38(Suplemento 1): S41-48.
- Inzucchi SE, et al: Metformina em Pacientes com Diabetes Tipo 2 e Doença Renal: Uma Revisão Sistemática. JAMA 2014 Dez 24; 312(24): 2668.
- Sociedade Suíça de Endocrinologia e Diabetologia: Metformina e meios de contraste de roentógenos contendo iodo [Internet]. Directrizes. 2014 [cited 2015 Jul 29]. Disponível a partir de: www.sgedssed.ch/fileadmin/files/news/Metformin_und_jodhaltige_Roentgenkontrastmittel.pdf
- Simpson SH, et al: Mortality risk among sulfonylureas: a systematic review and network meta-analysis. Lancet Diabetes Endocrinol 2015 Jan; 3(1): 43-51.
- ADVANCE Collaborative Group, Patel A, et al: Controlo intensivo da glucose no sangue e resultados vasculares em doentes com diabetes tipo 2. N Engl J Med 2008 Jun 12; 358(24): 2560-2572.
- Soccio RE, Chen ER, Lazar MA: Thiazolidinediones e a promessa de sensibilização à insulina na diabetes tipo 2. Cell Metab 2014 Oct 7; 20(4): 573-591.
- Lewis JD, et al: Pioglitazone Use and Risk of Bladder Cancer and Other Common Cancers in Persons With Diabetes. JAMA 2015 Jul 21; 314(3): 265-277.
- Tahrani AA, Barnett AH, Bailey CJ: Inibidores SGLT na gestão da diabetes. Lancet Diabetes Endocrinol 2013; 1(2): 140-151.
- Vasilakou D, et al: Cotransportador de sódio-glucose 2 inibidores para a diabetes tipo 2: uma revisão sistemática e meta-análise. Ann Intern Med 2013 Ago 20; 159(4): 262-274.
- Peters AL, et al: Euglycemic Diabetic Ketoacidosis: A Potential Complication of Treatment With Sodium-Glucose Cotransporter 2 Inhibition. Diabetes Care 2015 Jun 15; dc150843 (Epub ahead of print).
- Rosenstock J, et al: Dual Add-on Therapy in Type 2 Diabetes Poorly Controlled With Metformin Monotherapy: A Randomized Double-Blind Trial of Saxagliptin Plus Dapagliflozin Addition Versus Single Addition of Saxagliptin or Dapagliflozin to Metformin. Diabetes Care 2015 Mar; 38(3): 376-383.
- Karagiannis T, et al: inibidores de Dipeptidyl peptidase-4 para o tratamento da diabetes mellitus tipo 2 no ambiente clínico: revisão sistemática e meta-análise. BMJ 2012; 344: e1369.
- Scirica BM, et al: Saxagliptin e resultados cardiovasculares em doentes com diabetes mellitus tipo 2. N Engl J Med 2013 Oct 3; 369(14): 1317-1326.
- Zannad F, et al: Resultados de insuficiência cardíaca e mortalidade em doentes com diabetes tipo 2 que tomam alogliptin versus placebo em EXAMINE: um ensaio multicêntrico, aleatório e duplo-cego. Lancet 2015 23 de Maio; 385(9982): 2067-2076.
- Green JB, et al: Effect of Sitagliptin on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2015 Jul 16; 373(3): 232-242.
- Meier JJ: agonistas receptores de GLP-1 para tratamento individualizado da diabetes mellitus tipo 2. Nat Rev Endocrinol 2012 Dez; 8(12): 728-742.
- Buse JB, et al: Contribuição do Liraglutide na Combinação de Razão Fixa de Insulin Degludec e Liraglutide (IDegLira). Diabetes Care 2014 Nov; 37(11): 2926-2933.
CARDIOVASC 2015; 14(4): 4-8











