Os extractos de mosto de São João são comprovados para o tratamento de doenças depressivas. Contudo, algumas preparações reduzem os níveis plasmáticos de outros fármacos, induzindo CYP3A4 e P-glycoprotein (ABCB1) e prejudicam a sua eficácia. Estas interacções farmacocinéticas não são observadas com extractos baixos em hiperforina. O tratamento com tais extractos aumenta a segurança desta terapia.
De acordo com a OMS, aproximadamente 264 milhões de pessoas de todas as categorias etárias no mundo sofrem de depressão. É a principal causa de incapacidade para o trabalho [1]. As directrizes de tratamento internacionais e nacionais recomendam o uso de psicoterapia ou farmacoterapia para depressão ligeira, e psicoterapia e/ou e farmacoterapia para depressão moderada e grave [2]. Além dos antidepressivos sintéticos como os SSRIs, os fitoterápicos como a erva de São João (Hypericum perforatum) também fazem parte da caixa de ferramentas terapêuticas, após a sua eficácia e boa tolerabilidade terem sido comprovadas em numerosos estudos [3–5]. Contudo, a erva de St. John’s também deve ser tomada sob supervisão médica especializada [6]: embora existam numerosas preparações de venda livre no mercado para além das disponíveis mediante receita médica, a erva de St. John’s é conhecida pelo seu potencial de interacção farmacocinética com um grande número de medicamentos, razão pela qual a sua ingestão não é inofensiva. Este fitofarmacêutico atingiu um nível perturbador de notoriedade depois de se ter tornado conhecido que pacientes de transplante cardíaco tratados com ciclosporina que receberam uma comedicação com a erva de São João devido à comorbidade depressiva experimentaram rejeição do órgão transplantado [7]. O extracto de hipericão induz a enzima CYP3A4 responsável pelo metabolismo da ciclosporina. A eficácia deste imunossupressor é consideravelmente reduzida pela diminuição da sua biodisponibilidade [8]. O componente do hipericão responsável pela indução do CYP3A4 é a hiperforina, embora os extractos de hipericão disponíveis no mercado difiram consideravelmente no conteúdo deste composto.
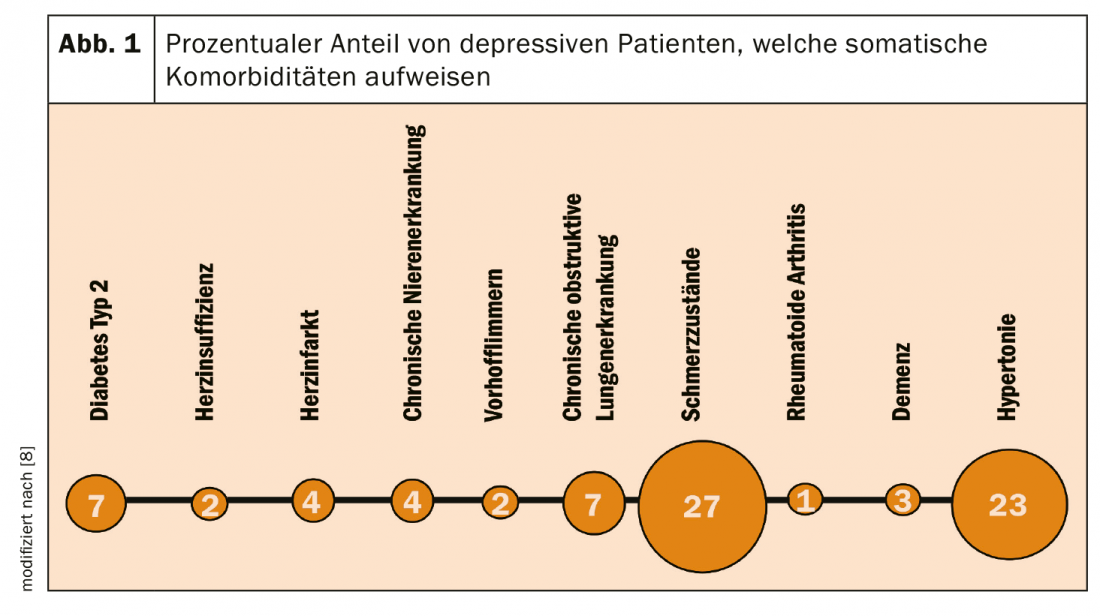
Os pacientes deprimidos não são tratados apenas por um especialista em psiquiatria e psicoterapia, mas também por um especialista em medicina geral ou medicina interna. O risco de certas comorbilidades é particularmente elevado na depressão (Fig. 1), mas os doentes deprimidos também sofrem de outras doenças somáticas e mentais que causam comedicações [8]. Felizmente, existe um extracto de baixa hiperfornina que se caracteriza por um baixo risco de interacção com outros medicamentos e favorece as condições de terapia segura nestes pacientes.
Extractos de hipericão e suas indicações
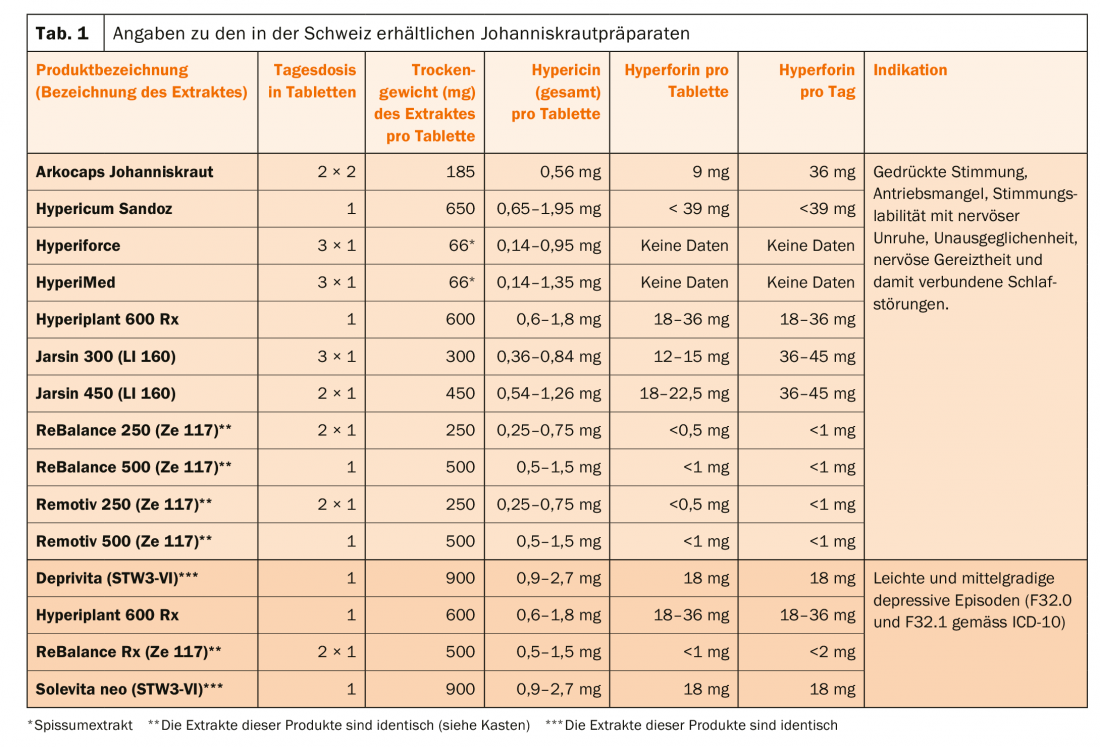
Os extractos de hipericão discutidos neste artigo são recomendados para dois grupos de diagnóstico diferentes, dependendo da preparação (Tab. 1):
- Para pacientes que sofrem de estados de humor deprimidos, instabilidade do humor, inquietação interior, estados de tensão e problemas associados ao adormecimento e permanência no sono. Estes são medicamentos da categoria de distribuição D.
- Para pacientes diagnosticados com um episódio depressivo leve ou moderado (F32.0 e F32.1 de acordo com o CID-10). Estes são medicamentos de categoria B.
As doses diárias para o tratamento de doentes com a erva de São João diferem significativamente (Tab. 1). Agora, porém, uma análise de 28 estudos clínicos sobre a eficácia de diferentes extractos de hipericumeno em depressão grave mostra que a partir de uma dose ≥180 mg/dia de extracto, consegue-se um patamar de eficácia, na medida em que, mesmo com doses de 1800 mg/dia, não foram alcançados melhores resultados de tratamento [9].
O Hypericum tem relativamente poucos efeitos secundários e é bem tolerado [10]. Para todos os fitoterapêuticos Hypericum aplica-se uma certa fotossensibilização e deve ser evitada uma forte exposição solar. Contudo, o risco parece tornar-se clinicamente significativo apenas em doses diárias de >2-4 g Hypericum (correspondente a 5-10 mg/dia de hipericina) [9].
As interacções farmacodinâmicas também devem ser consideradas. O hipericão é também um inibidor da absorção de serotonina e, por conseguinte, a sua combinação com os IRSS comporta um risco de síndrome de serotonina, embora no caso do citalopram, por exemplo, a indução esperada do seu metabolismo a uma diminuição da sua biodisponibilidade tornaria menos provável tal risco [10].
Mecanismo de acção
Os extractos de hipericão contêm um grande número de substâncias activas, cujas concentrações variam não só entre as preparações mas também na preparação individual, por exemplo, para hipericão total, varia entre 0,14-1,35 mg num comprimido revestido por película Hyperimed® (Tab.1). Costumava-se supor que a hipericina, a pseudo-hipericina (onde hipericina + pseudo-hipericina são referidos como hipericina total) e a hiperforina eram os principais responsáveis pelos efeitos terapêuticos, mas foi agora demonstrado que os extractos com baixo teor de hiperforina também são eficazes. Hypericum contém outros compostos como os do tipo flavinoide (quercetina, quercetrina, rutina), que também podem contribuir para o efeito terapêutico [11]. Em geral, os extractos inibem a recaptação de serotonina, noradrenalina e dopamina, mas também actuam sobre GABA e glutamato. O seu perfil de efeito é semelhante ao de muitos antidepressivos sintéticos, incluindo a capacidade de causar uma desregulamentação dos receptores β e uma upregulação dos receptores 5-HT2 (ou seja, o número de receptores diminui, respectivamente aumenta). Hyperforin favorece a entrada de iões Na e Ca em canais TRPC6 (canais receptores potenciais transitórios). Em experiências com animais, dependendo do modelo, a hiperforina e/ou hipericina provam estar activas [12,13]. No entanto, é difícil tirar conclusões relativamente a um mecanismo vegetal, uma vez que a normalização dos extractos se baseia apenas em um ou dois compostos. Os extractos que contêm <1 mg/dia de hiperforina são chamados produtos com baixo teor de hiperforina, em contraste com os produtos com alto teor de hiperforina (>1 mg/dia de dose) (Tab. 1) (Caixa).
Farmacocinética clínica e metabolismo
Num estudo farmacocinético, foi medido um Tmax de 5-10h, e uma semi-vida de eliminação de 12-28h para a hipericina. Foram também recolhidas medições correspondentes para pseudo-hipericina (1,5-4h; 5-38h), hiperforina (3-8h; 10-28h) e quercitina (0,5-6h (com 2 máximos neste intervalo de tempo!); 0,8-7h) [14]. Os estudos sobre o papel das enzimas envolvidas no metabolismo da hiperforina e da hipericina são raros. Pelo menos 57 metabolitos são formados a partir de hiperforina, em cuja formação as formas de CYP2C e CYP3A desempenham um papel. Inibe o CYP2D6 e o CYP3A in vitro, mas não é claro até que ponto esta descoberta é clinicamente relevante, uma vez que o efeito indutivo predomina após administração prolongada [15]. Assim, outros medicamentos como ritonavir também inibem o CYP3A4 num primeiro passo antes que o efeito indutivo sobre a mesma enzima venha à tona.
O CYP3A4 é responsável pelo metabolismo de quase metade de todas as drogas. Partilha numerosos substratos com a glicoproteína P (PgP; ABCB1), que actua como um transportador de efluxo para transportar medicamentos para fora da célula. A hiperforina contida nos extractos de hipericão liga-se ao receptor X pregnante (PXR), após o que o CYP3A4 e o PgP são induzidos no fígado, intestino e outros órgãos através de várias etapas [9]. Menos pronunciado e acima de tudo ainda não aceite são conclusões que a hiperforina também induz substancialmente CYP1A2, CYP2C9 e CYP2C19.
A indução de CYP3A4 e PgP pode ocorrer após apenas 3 dias de tratamento. Atinge um máximo após aproximadamente 1-2 semanas, embora ainda possa ser observado por um período igualmente longo após a interrupção do tratamento, ou seja, afinal é reversível [16]! Esta circunstância deve, portanto, ser igualmente tida em conta na passagem de uma preparação rica em hiperforina para uma preparação pobre em hiperforina.
Interacções farmacocinéticas de extractos hipercinéticos ricos em hiperforina Hypericum
Os extractos hipericais ricos em hiperforina promovem assim o metabolismo de muitas drogas, como já foi descrito utilizando o exemplo da ciclosporina. Mas também impedem o transporte de substratos de PgP, por exemplo a captação de digoxina do intestino para o sangue. Uma vez que muitos esteróides são metabolizados através do CYP3A4, existe um risco de hemorragia ou mesmo de gravidez com contracepção hormonal com, por exemplo, etinilestradiol ou desogestrel em tratamento concomitante com Hypericum rico em hiperforina.
Por exemplo, no CPE do Hypericum Sandoz® várias comedicações são listadas como contra-indicações, tais como certos imunossupressores (por exemplo. ciclosporina, tacrolimus ou sirolimus), medicamentos anti-HIV do grupo dos inibidores da transcriptase reversa não-nucleosídeos (por exemplo, nevirapina) e inibidores da proteinase (por exemplo, indinavir), certos medicamentos citostáticos (por exemplo, imatinibe, irinotecano) e anticoagulantes orais do tipo coumarina (Tab. 2).
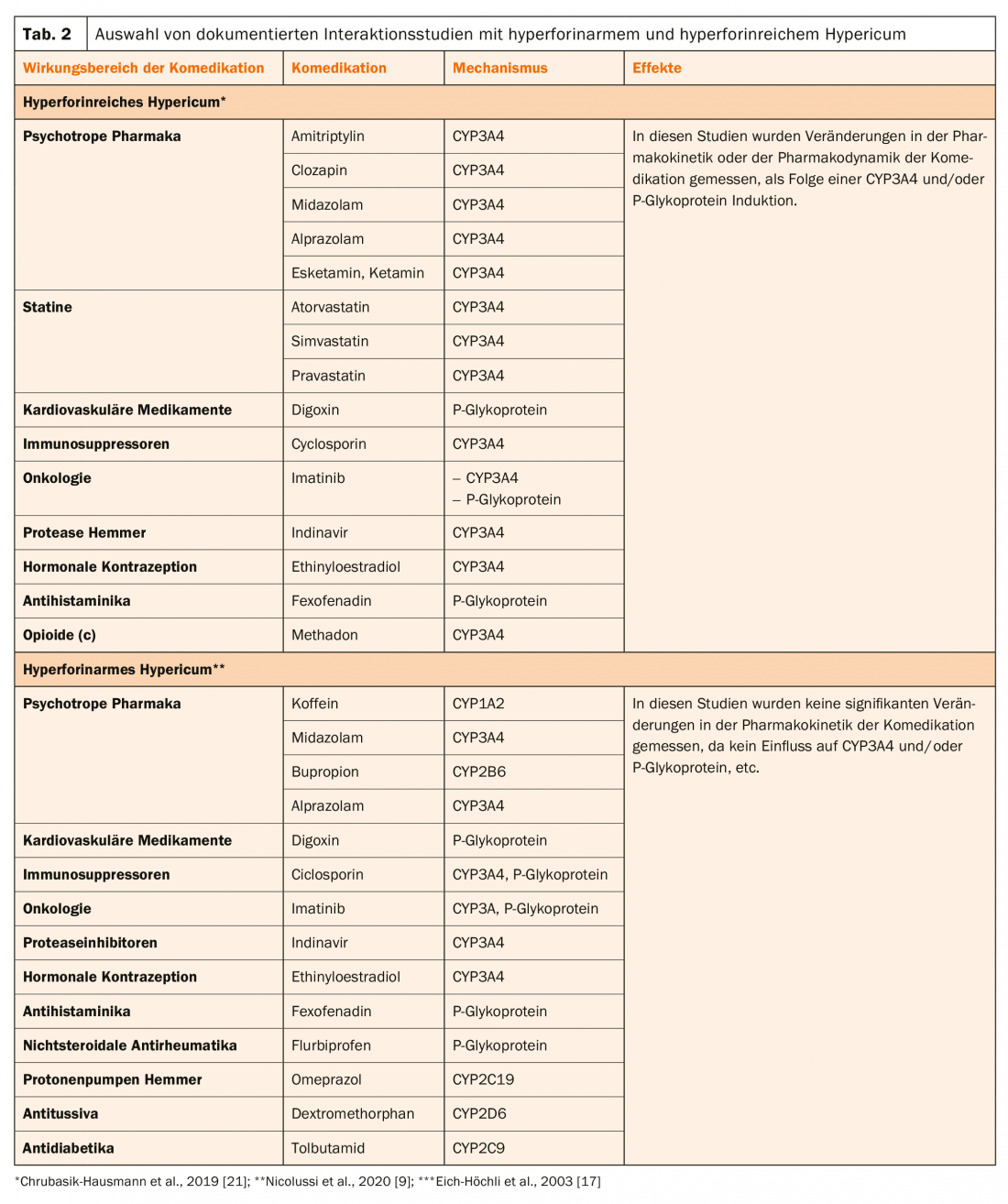
Nos doentes tratados com metadona, um tratamento antidepressivo adicional com hipericão causou não só uma redução dos seus níveis plasmáticos mas também sintomas de abstinência, que só desapareceram após a interrupção do tratamento com hipericão [17].
A esketamina acaba de ser introduzida na Suíça como um antidepressivo adjuvante para pacientes resistentes ao tratamento. Uma vez que é degradado pelo CYP3A4, não é surpreendente que o Hypericum rico em hiperforina diminua os seus níveis de plasma em cerca de metade [18]. Pode assumir-se que este não será o caso da erva hiperforinariana de São João.
Comparação de hiperforina-pobre com Hypericum hiperforina-rico
As interacções farmacocinéticas dos extractos de Hypericum têm sido documentadas em numerosos estudos e revisões [9,19–21].
Actualmente, só está disponível o extracto Ze 117, que é baixo em hiperforina de acordo com as directrizes da EMA (caixa, tab. 1) . Assim, após a administração deste produto, não se observa qualquer diminuição dos níveis de digoxina no plasma em indivíduos tratados com este medicamento [22]. O quadro 2 mostra estudos de interacção com Hyperforin-poor e Hyperforin-richer Hypericum. Isto mostra que estes extractos diferem claramente no seu efeito sobre CYP3A4 e/ou P-glycoprotein. Assim, o tratamento com estes extractos é susceptível de envolver riscos mais elevados como resultado de interacções farmacocinéticas, que se manifestam principalmente como uma perda do efeito clínico da comedicação.
| A EMA (Agência Europeia de Medicamentos) aprovou em 2018 que o chamado SPC (Resumo das Características do Produto) já não tem de conter um aviso sobre as interacções farmacocinéticas se na dose diária de um extracto de hipericão o conteúdo de hiperforina for <1 mg/dia, como é o caso do extracto Ze 117. A Suíça (Swissmedic) foi o primeiro país a adoptá-la. Tais advertências já foram retiradas das informações sobre os extractos de hipericão Ze 117 Remotiv 250/500 e ReBalance 250/500, mas o procedimento de reescrita ainda está pendente para a ReBalance Rx, razão pela qual este produto não é actualmente fornecido pela empresa (a partir de Março de 2020). |
Consequências práticas e conclusões
A gama de fitoterapêuticos Hypericum é confusa. Por exemplo, no caso do extracto hiperforínico Ze 117, são oferecidos três produtos idênticos, nomeadamente Remotiv®, Rebalance®, Rebalance®Rx. Os dois últimos produtos são reembolsados pela caixa registadora, enquanto que a Remotiv está na linha OTC e não é reembolsada. Como mencionado acima, Rebalance® RX (Tabela B) deve ser prescrito por um médico para uma depressão ligeira a moderada. O Rebalance e Remotiv, por outro lado, estão no Programa D, e podem, portanto, ser dispensados por farmácias e drogarias para o tratamento da depressão, instabilidade do humor, etc. Agora, no entanto, a informação sobre drogas para Rebalance® RX ainda não especifica que este é um produto com um máximo de 0,1 mg de hiperforina (por dose diária), mas para Remotiv® e Rebalance® (caixa) . Por conseguinte, é importante que a cooperação entre médico – farmacêutico – paciente seja óptima, especialmente porque deve ficar claro para o paciente que a automedicação pode ser associada a riscos quando, por exemplo, se muda de um extracto de Ze 117 para outro produto, especialmente porque a maioria dos outros produtos são ricos em hiperforina. Quando se passa de um extracto rico em hiperforina para um extracto pobre em hiperformina, a dose da comedicação pode ter de ser cuidadosamente ajustada, caso em que seria recomendado o controlo terapêutico da droga [23,24]. Com certas precauções, os extractos de hiperforina de St. John são agora considerados medicamentos eficazes e seguros para o tratamento da depressão ligeira a moderada. Não há apenas muitos pacientes que preferem a fitoterapia, mas também médicos que gostariam de a utilizar especificamente, ou seja, relacionados com o paciente.
Literatura:
- www.who.int/news-room/fact-sheets/detail/depression (último acesso em 15.4.2020)
- Holsboer-Trachsler E, Hättenschwiler J, Beck J, et al: O tratamento agudo de episódios depressivos. Fórum médico suíço. 2016;16(35): 716-725.
- Apaydin EA, Maher AR, Shanman R, et al: Uma revisão sistemática da erva de St. John’s para grandes desordens depressivas. Syst Rev. 2016;5(1): 148.
- Rahimi R, Nikfar S, Abdollahi M: Eficácia e tolerabilidade do Hypericum perforatum na desordem depressiva principal em comparação com os inibidores selectivos de recaptação de serotonina: uma meta-análise. Prog Neuropsicofarmacol Biol Psiquiatria. 2009;33(1): 118-127.
- Linde K, Berner MM, Kriston L: Erva de São João para grandes depressões. Cochrane Database Syst Rev. 2008(4): CD000448.
- Anheyer D, Haller H, Klose P, et al: Medicamentos fitoterápicos para doenças psiquiátricas. Nervenarzt. 2018;89(9): 1009-1013.
- Ruschitzka F, Meier PJ, Turina M, et al: Rejeição de transplante agudo de coração devido à erva de São João. Lanceta. 2000;355: 548-549.
- Dumbreck S, Flynn A, Nairn M, et al: Drug-disease and drug-drug interactions: systematic examination of recommendations in 12 UK national clinical guidelines. BMJ. 2015;350: h949.
- Nicolussi S, Drewe J, Butterweck V, et al: Relevância clínica das interacções medicamentosas da palavra São João revisitadas. Br J Pharmacol. 2020;177(6): 1212-1226.
- Henderson L, Yue QY, Bergquist C, et al: St John’s wort (Hypericum perforatum): interacções medicamentosas e resultados clínicos. British Journal of Clinical Pharmacology. 2002;54(4): 349-356.
- Gurley BJ, Swain A, Hubbard MA, et al.: Avaliação clínica das interacções medicamentosas mediadas por CYP2D6 em humanos: efeitos do cardo de leite, cohosh negro, goldenseal, kava kava, erva de São João, e equinácea. Mol Nutr Food Res. 2008;52(7): 755-763.
- Muller WE: A investigação actual da erva de São João desde o modo de acção até à eficácia clínica. Pharmacol Res. 2003;47(2): 101-109.
- Leuner K, Kazanski V, Muller M, et al.: Hyperforin – um constituinte chave da tripa de St. John’s activa especificamente os canais TRPC6. FASEB J. 2007;21(14): 4101-4111.
- Schulz HU, Schurer M, Bassler D, Weiser D: Investigação da biodisponibilidade da hipericina, pseudo-hipericina, hiperforina e dos flavonóides quercetina e isorhamnetina após a dosagem oral única e múltipla de um extracto de hipericão contendo comprimidos. Investigação de medicamentos. 2005;55(1): 15-22.
- Hokkanen J, Tolonen A, Mattila S, Turpeinen M: Metabolismo da hiperforina, o constituinte activo da erva de São João, nos micróomos humanos do fígado. Eur J Pharm Sci. 2011;42(3): 273-284.
- Johne A, Schmider J, Brockmöller J, et al.: Diminuição dos níveis de Plasma da Amitriptilina e dos seus Metabolitos na Comedicação com um Extracto da Erva de São João ( Hypericum perforatum ). Journal of Clinical Psychopharmacology. 2002;22(1): 46-54.
- Eich-Höchli D, Oppliger R, Powell Golay K, et al.: Tratamento de manutenção com metadona e erva de São João – Um relato de caso. Farmacopsiquiatria. 2003;36: 35-37.
- Peltoniemi MA, Saari TI, Hagelberg NM, et al: St John’s wort diminui muito as concentrações plasmáticas de S-ketamina oral. Fundam Clin Pharmacol. 2012;26(6): 743-750.
- Soleymani S, Bahramsoltani R, Rahimi R, Abdollahi M: Riscos clínicos da co-administração de St John’s Wort (Hypericum perforatum). Opinião de peritos Toxicol do Drug Metab. 2017;13(10): 1047-1062.
- Zahner C, Kruttschnitt E, Drewe J, et al.: Nenhuma interacção clinicamente relevante do extracto de mosto de st. john ze 117 baixo em hiperforina com enzimas citocromo p450 e p-glycoprotein. Farmacologia Clínica e Terapêutica. 2019;106(2): 432-440.
- Chrubasik-Hausmann S, Vlachojannis J, McLachlan AJ: Compreender as interacções medicamentosas com a erva de São João (Hypericum perforatum L.): impacto do conteúdo de hiperforina. J Pharm Pharmacol. 2019;71(1): 129-138.
- Mueller SC, Uehleke B, Woehling H, et al: Efeito da erva de São João e preparações sobre a farmacocinética da digoxina. Clin Pharmacol Ther. 2004;75(6): 546-557.
- Hiemke C, Bergemann N, Clement HW, et al: Consensus Guidelines for Therapeutic Drug Monitoring in Neuropsychopharmacology: Update 2017. Pharmacopsychiatry. 2018; 51(1/2): 9-62.
- Klein HG, Haen E: Farmacogenética e monitorização de medicamentos terapêuticos. Berlim, Boston: De Gruyter; 2018. 465 p.
InFo NEUROLOGIA & PSYCHIATRY 2020; 18(3): 20-23
PRÁTICA DO GP 2020; 15(6): 38-41