A toxina botulínica (BTX) evoluiu de uma antiga droga oftálmica com um espectro terapêutico limitado para uma droga com distribuição mundial. Tem um efeito inibitório pré-sináptico na libertação de ACh na placa terminal neuromuscular por um lado e na placa terminal neurovegetativa por outro. Na aplicação terapêutica médica em humanos, o BTX A é utilizado praticamente em exclusivo, havendo três preparações que foram testadas num grande número de estudos científicos: Onabotulinum, Abobotulinum, Incobotulinum. Como são utilizados e que material é necessário para o tratamento de botulinum?
O primeiro caso registado de envenenamento por toxinas botulínicas com a bactéria produtora de neurotoxinas Clostridium botulinum data de 1735, onde a banda que tocava numa festa de casamento era alimentada com presunto estragado e salsichas fumadas. Quatro dos dez músicos morreram de botulismo [1]. Dr. Justinus Christian Kerner (1786-1862), poeta e médico-assistente de Baden-Württemberg (Fig. 1), publicado no “Tübinger Blättern für Naturwissenschaften und Arzneykunde” meticulosamente os sintomas dos doentes que sofrem de botulismo e já nessa altura se referia que “esta toxina poderia provavelmente ser um medicamento formidável para o tratamento de cãibras numa data posterior, bem como para a redução da salivação excessiva, lacrimejamento ou transpiração” [2]. Uma vez que a bactéria ainda não tinha sido descoberta na altura, Kerner acreditava na chamada teoria dos ácidos gordos depois de numerosos outros mecanismos terem sido longamente discutidos (alimentação pouco saudável de porcos, energia eléctrica de descargas atmosféricas, castigos de Deus devido a estilos de vida desonestos, etc.). Durante este tempo, o botulismo também foi chamado de doença de Kerner.

Foi Friedrich Gustav Jakob Henle (1809-1885), um professor de anatomia de Göttingen (“Henle’s loop”), que primeiro descreveu organismos parasitas em 1840 (Contagium vivum) e os descreveu como possivelmente causadores de doenças. 20 anos mais tarde, o químico Louis Pasteur (1822-1895) provou a fermentação microbiana do vinho. Em 1882, Robert Koch (1843-1910), estudante de Henle, descobriu o bacilo do tubérculo e foi-lhe atribuído o Prémio Nobel em 1905. As consequências que resultaram da descoberta de bactérias foram enormes. Pela primeira vez na história da medicina, as causas de numerosas doenças tornaram-se conhecidas, tornando a terapia causal possível pela primeira vez – pelo menos em certa medida no início. Em 1897, Pierre Marie van Ermengem (1851-1932), estudante de Robert Koch, conseguiu isolar o agente patogénico responsável pelo botulismo e assim refutou a teoria do ácido gordo de Kerner. Ele nomeou esta bactéria Bacillus botulinus, que é agora conhecida como Clostridium botulinum [3]. 1905 Tchitchikane identifica a neurotoxina. Em nome do Exército dos EUA, Eduard J. Schantz tinha estado a trabalhar na estrutura da proteína desde a Segunda Guerra Mundial, uma vez que ficou conhecido que vários países tinham capacidades e planos para a utilização de armas químicas e biológicas. A sua investigação sobre a estrutura e o mecanismo de acção das proteínas lançou as bases para a actual utilização da toxina como droga. Em 1949, os estudos de Burgen deveriam mostrar que o efeito da toxina se devia a uma inibição pré-sináptica da acetilcolina (quimodenervação) e não – como se supunha até então – a um bloqueio pós-sináptico do nervo [4]. Esta descoberta foi pioneira para bases teóricas posteriores para a aplicação clínica da toxina (ver abaixo).
Em 1973, o Dr. Alan Scott foi pioneiro no uso clínico da toxina botulínica (BTX), utilizando pela primeira vez BTX em primatas para tratar o estrabismo. Trabalhou em estreita colaboração com E. J. Schantz, que era responsável pela produção da toxina. No entanto, para que a toxina fosse utilizada terapeuticamente como medicamento em humanos, primeiro tinha de ser purificada a partir de outras proteínas para prevenir a formação de anticorpos da forma mais eficiente possível e para assegurar a estabilidade em alta diluição. Os problemas foram resolvidos e oito anos após a primeira experiência animal em macacos, Scott conseguiu publicar a primeira aplicação de BTX em humanos sob o título “Injecção de toxina botulínica dos músculos dos olhos para corrigir o estrabismo” [5].
20 anos após o desenvolvimento clínico do medicamento, a preparação BTX foi aprovada pela FDA americana para o tratamento do estrabismo, do blefaroespasmo e do espasmo hemifacial. Um pouco acidentalmente, Jean Carruthers, residente com o Dr Scott, descobriu que as rugas do lado tratado dos doentes com blefaroespasmo hemifacial suavizaram significativamente [6]. Mais ou menos ao mesmo tempo, Bushara descobriu uma redução significativa da transpiração na metade tratada do rosto e publicou pela primeira vez um possível tratamento para a hiper-hidrose axilar com BTX [7]. Estas duas descobertas foram o início de uma história de sucesso de uma antiga droga oftálmica com uso terapêutico limitado, que se transformou numa droga com distribuição mundial. Na Suíça, o BTX foi utilizado pela primeira vez para o tratamento da hiperidrose focal em 1997. A primeira consulta de hiper-hidrose na Suíça foi estabelecida no Hospital Universitário em Zurique [8]. Ao longo dos anos, as indicações de tratamento estético têm-se tornado cada vez mais importantes. De acordo com as estatísticas da Sociedade Americana de Cirurgia Plástica Estética, só nos EUA foram realizados 3.766.148 tratamentos estéticos de botulinum em 2013 – não incluindo o tratamento da hiper-hidrose. Isto representa um aumento de 5680% em relação a 1997!
Todos Botox® ou o quê?
Até à data, são conhecidos sete tipos de BTX imunologicamente diferentes (A-G), com as toxinas A, B, E e F a demonstrarem eficácia nos humanos, enquanto as toxinas C e D apenas causam doenças em animais e a toxina G ainda não foi descrita para causar doenças em humanos ou animais [9]. Em aplicações terapêuticas médicas, o BTX A é utilizado quase exclusivamente. O complexo Botulinum toxin B, comercializado como a marca Myobloc® na Europa e Neurobloc® nos EUA (Elan Pharmaceuticals, EUA), desempenha apenas um papel marginal em dermatologia devido à duração limitada da acção e à dor ardente por injecção.
Há três produtos principais BTX A que foram testados numa variedade de estudos científicos pré-clínicos e clínicos:
- Toxina Onabotulinum A: Botox®/Vistabel® (Actavis/Allergan, EUA)
- Abobotulinum toxina A: Dysport®/Azzalure® (Ipsen, UK resp. Galderma, CH)
- Toxina Incobotulinum A: Xeomin®/Bocouture® (Estética de Merz, D)
Botox®, Dysport® e Xeomin® são utilizados para indicações médicas (quadros clínicos neurológicos/hiperidrose), Vistabel® (ou também Botox aesthetics® nos EUA), Azzalure® e Bocouture® estão disponíveis para indicações estéticas, em que as respectivas preparações de irmãos são farmacologicamente absolutamente idênticas e diferem apenas no nome da marca para melhor identificação (exigência da FDA). Nem todas as preparações mencionadas têm autorização de comercialização para cada indicação. No entanto, esta circunstância é específica de cada país e, por conseguinte, não é aqui discutida em pormenor.
As toxinas individuais (onabotulinum, abobotulinum, incobotulinum) diferem em termos da sua forma de dosagem (unidades/embalagem), das suas condições de transporte e da sua actividade biológica, que é apresentada no quadro 1.
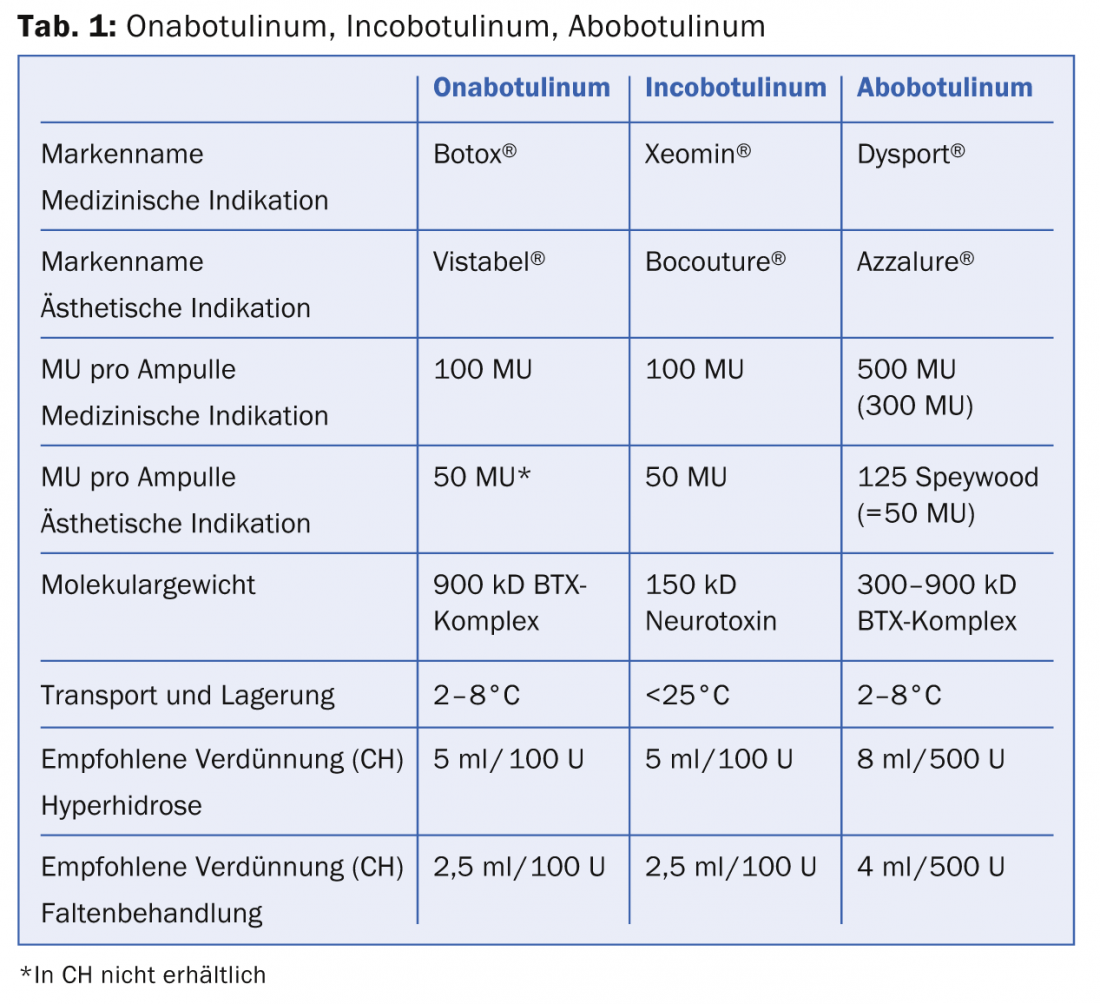
Todos os três produtos vêm numa substância seca cristalina e têm de ser reconstituídos com NaCl 0,9%. Enquanto ona- e abobotulinum devem ser transportados e armazenados refrigerados, esta cadeia de frio não se aplica ao incobotulinum. Após reconstituição, porém, todos os produtos devem ser armazenados num local fresco. A actividade biológica dos três produtos é expressa nas chamadas unidades de rato (MU). 1 MU corresponde a 0,2X10-12 mol (picomol) de toxina e é definido como a quantidade de toxina que é letal para metade da população feminina de ratos Webster suíços (18-22 g) após injecção intraperitoneal (Dose Letal LD50). Desde Junho de 2011, Allergan tem sido o único concorrente a realizar um ensaio de potência baseado em células in vitro (CBPA) para determinar a estabilidade e eficácia do medicamento. Onabotulinum e incobotulinum são comparáveis em termos de eficácia, duração da acção e início da acção. O Incobotulinum é o único preparado complexo sem proteínas, que se diz ser excelente numa reacção anticorpos neutralizante reduzida (prevenção de falha da terapia secundária). É importante notar que a dose equivalente para abobotulinum (Dysport® resp. Azzalure®) não é o mesmo que a dose dos outros dois BTX (tab. 1). Isto deve-se ao facto de serem utilizadas diferentes estirpes bacterianas para produzir o medicamento e de os processos de fabrico serem diferentes. O factor de conversão de dose entre onabotulinum/incobotulinum e abobotulinum é 1:3 (ou 1:2.5, dependendo da publicação). Isto é da maior importância quando se reconstitui a toxina em uso clínico para evitar a sobredosagem ou a subdosagem. Mais por uma questão de completude, deve ser mencionado que um grande número de produtos BTX com diferentes marcas de origem incerta são oferecidos na World Wide Web. Escusado será dizer que estes produtos devem ser evitados.
Como funciona o botulinum?
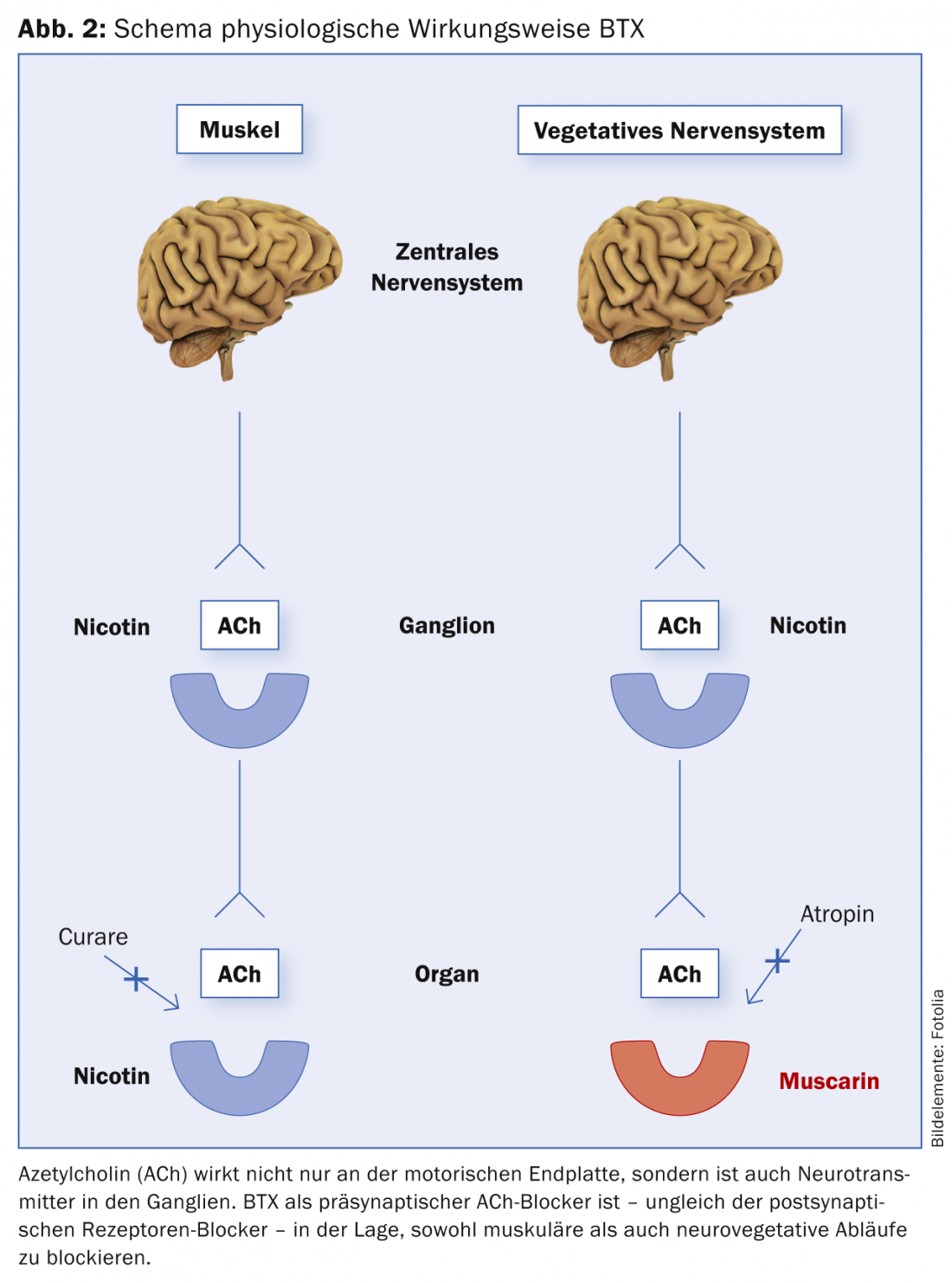
O BTX, como já mencionado, tem um efeito inibitório pré-sináptico na libertação de ACh tanto nas placas terminais neuromusculares como neurovegetativas. Por outras palavras, tanto o músculo como o sistema nervoso autónomo (VNS) são servidos pela mesma substância transmissora (ACh). É por isso que o BTX é eficaz tanto em músculo como noutros processos controlados vegetativamente (hiperidrose, hipersalivação, indicações urológicas, etc.) (Fig. 2). E este mecanismo de acção extremamente específico do BTX é também a razão pela qual o BTX não tem efeitos secundários na utilização clínica. O ACh é utilizado como transmissor exclusivamente nos sistemas mencionados.
A molécula toxínica consiste numa cadeia ligeira (cadeia L) com um peso molecular de 50 kD (quilo Dalton) e uma cadeia pesada (cadeia H) com um peso molecular de 100 kD. As correntes estão ligadas umas às outras por uma ponte de bissulfureto. A cadeia H é responsável pela chamada internalização: a absorção da toxina no terminal nervoso na área da placa terminal pré-sináptica. Após a endocitose, a cadeia L separa-se da cadeia H. A cadeia L cliva a proteína SNAP-25, um componente do chamado complexo de fusão SNARE (Soluble N-ethylmaleimide-sensitive-factor Attachment Receptor, SNARE) em vários locais. Como resultado, a fusão da vesícula contendo ACh com a membrana já não é possível e, portanto, não é possível a libertação de ACh do terminal do nervo colinérgico [10,11]. Assim, a descarga da substância transmissora ACh é evitada e não há nenhum efeito pós-sináptico. No entanto, o efeito terapêutico é apenas de duração limitada, uma vez que novos nervos germinam mais tarde e novas ligações sinápticas são estabelecidas.
A preparação da solução de botulinum para o tratamento
Existem diferentes formas de dissolver a substância seca BTX. Muitos autores escolhem uma diluição de 1 ml a 100 U Ona- e Incobotulinum resp. 500 U Abobotulinum para o tratamento de rugas mímicas com o objectivo de alcançar um resultado de injecção da toxina o mais preciso possível com o mínimo de difusão nos músculos indesejados. No entanto, este esquema de dissolução de baixo volume altamente concentrado tem a grande desvantagem de que gradações finas na dosagem e, portanto, uma certa “modelização” com a dose de BTX são difíceis de conseguir. Se 100 U BTX são dissolvidos em 1 ml, então 0,1 ml correspondem a 10 U BTX. A dose de um ponto de injecção para o tratamento de rugas mímicas é normalmente entre 2 U e 6 U. Assim, é necessário um alto nível de experiência e uma mão segura quando se injecta pequenas doses. Por conseguinte, foi estabelecida uma diluição de BTX para as diferentes indicações, como se pode ver nos quadros 2 e 3.
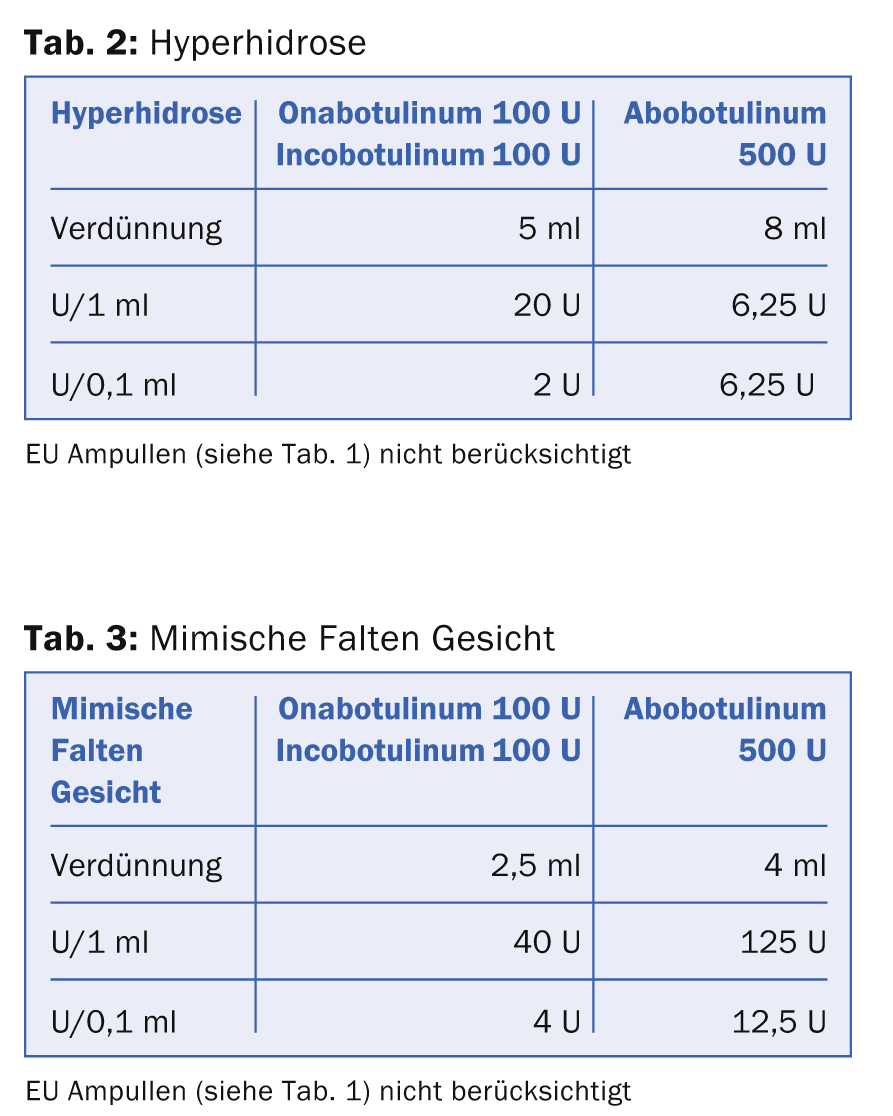
Os quadros mostram que a dose equivalente de Ona- resp. Incobotulinum e Abobotulinum é calculado com 1:3. O aspecto especial da reconstituição do Incobotulinum é que a empresa recomenda fortemente que se incline o frasco várias vezes depois de desencadeado para obter o efeito máximo da solução medicamentosa.
De que material preciso para um tratamento BTX?
O material necessário para o tratamento com BTX é relativamente manejável. Uma preparação correcta e bem planeada leva à segurança e ao aumento da qualidade. Ou dito de outra forma: se o médico tiver de recolher isto e aquilo antes da intervenção planeada ou mesmo interromper o tratamento por falta de preparação, existem per se perigos de tratamentos incorrectos. Não se deve esquecer que estamos a lidar com uma droga altamente potente. A instrução dos assistentes é da maior importância.
Para um tratamento BTX correcto, necessita:
- 1 embalagem original de BTX (Ona-, Inco ou Abobotulinum) 100 U
- NaCl 0,9% 5 ml (hiper-hidrose) resp. 2,5 ml (indicação estética) Ona- e Incobotulinum, 8 ml resp. 4 ml de Abobotulinum (Caverna: na UE, 50 U resp. 125 U Flacon disponível, reduzindo assim para metade a quantidade de volume)
- Seringa de 5 ml com 18 agulha G (rosa) para reconstituição
- Seringas de insulina (1 ml) sem agulha com escala em ml
- Agulha 32G acoplável para injecção
- Desinfecção tanto de spray, por exemplo Kodan® para o tratamento da hiperidrose como de líquido, por exemplo Octenisept® para o tratamento do rosto.
- Fita da cabeça na zona facial
- Utensílios para o teste de suor de Menor para o tratamento da hiper-hidrose axilar:
- A solução de Lugol (farmácia)
- Fécula de batata (farmácia)
- Peneira dupla para a melhor aplicação possível de fécula de batata (grandes armazéns’)
- Lápis Kajal (macio!) para marcar os pontos de injecção
- Emulsão de remoção de maquilhagem e opção de lavagem após tratamento (especialmente após hiper-hidrose axilar).
Esta lista pode, evidentemente, ser adaptada às preferências pessoais. As seringas, agulhas e frascos vazios usados devem ser eliminados separadamente! Este é um ponto que não deve ser omitido! O BTX e os seus resíduos não devem ser eliminados com resíduos gerais.
Para ser continuado…

Literatura:
- Dickson EC: Botulismo: Um estudo clínico e experimental. Rockefeller Institute for Medical Research 1918; 1-117.
- Kerner JC: Envenenamento por salsichas contaminadas. Tübinger Blätter für Naturwissenschaften und Arzneykunde 1817; 3: 1-45.
- Kreyden OP, Geiges ML, Burg G: toxina botulínica: do veneno à droga. Uma revisão histórica. Dermatologista 2000; 51: 733-737.
- Burgen A, Dickens F, Zatman LJ: A acção da toxina botulínica na junção neuromuscular. J Physiol 1949; 109: 10-24.
- Scott AB: injecção de toxina botulínica dos músculos dos olhos para corrigir o estrabismo. Trans Am Ophthalmol Soc 1981; 79: 734-770.
- Carruthers JD, Carruthers JA: Tratamento de linhas glabelares com C. botulinum-A exotoxina. J Dermatol Surg Oncol 1992 Jan; 18(1): 17-21.
- Bushara KO, et al: Toxina botulínica – um possível novo tratamento para a hiper-hidrose axilar. Clin Exp Dermatol 1996 Jul; 21(4): 276-278.
- Kreyden OP, Böni R, Burg G: Hyperhidrosis and Botulinum Toxin in Dermatology. Problemas Actuais em Dermatologia Karger 2002. ISBN 0070-2064.
- Barker WH: Botulismo. A História Mundial das Doenças Humanas de Cambridge. Kiple, KF e Graham 1993; 623-625.
- Kao I, Drachman DB, Preço DL: Toxina botulínica: Mecanismo de bloqueio pré-sináptico. Ciência 1976; 193: 1256-1258.
- Philipp-Dormston WG: Toxina botulínica em dermatologia. Der Hautarzt 2014; 65: 133-145.
PRÁTICA DA DERMATOLOGIA 2015; 25(1): 29-34