Os nódulos da tiróide são um fenómeno bem conhecido, os carcinomas medulares da tiróide felizmente não. É uma degeneração maligna das células C da glândula tiróide, que estão localizadas parafolicularmente e não podem armazenar iodo. Uma vez que segrega calcitonina, esta pode ser usada como um marcador de tumores.
Os nódulos da tiróide são frequentemente diagnosticados na prática, mas felizmente, o carcinoma medular da tiróide raramente é diagnosticado. Apenas cerca de 3% de todos os carcinomas da tiróide envolvem o carcinoma medular da tiróide (MTC), que tem algumas características especiais: É uma degeneração maligna das células C da glândula tiróide, que se encontram parafolicularmente e não podem armazenar iodo; segrega calcitonina (Ctn) e CEA, que são utilizadas como marcadores tumorais; um quarto dos casos ocorre familiarmente no contexto de neoplasia endócrina múltipla tipo 2 (MEN2). A única opção para uma possível cura do MTC é um diagnóstico precoce e uma cirurgia adequada. Isto é possível graças à utilização consistente da determinação Ctn na clarificação de struma nodosa e na variante familiar de testes genéticos moleculares do protooncogene RET como parte do rastreio familiar. Mesmo naqueles que não estão curados, o MTC tem um prognóstico relativamente favorável com uma qualidade de vida relativamente boa devido ao seu lento crescimento. Em muitos casos, é possível uma estratégia de acompanhamento de “vigilância activa” adaptada ao risco. O MTC na fase de metástase progressiva sintomática à distância pode actualmente ser tratado com inibidores de tirosina quinase (TKIs) [1,2].
Clínica e diagnóstico do carcinoma medular da tiróide (MTC)
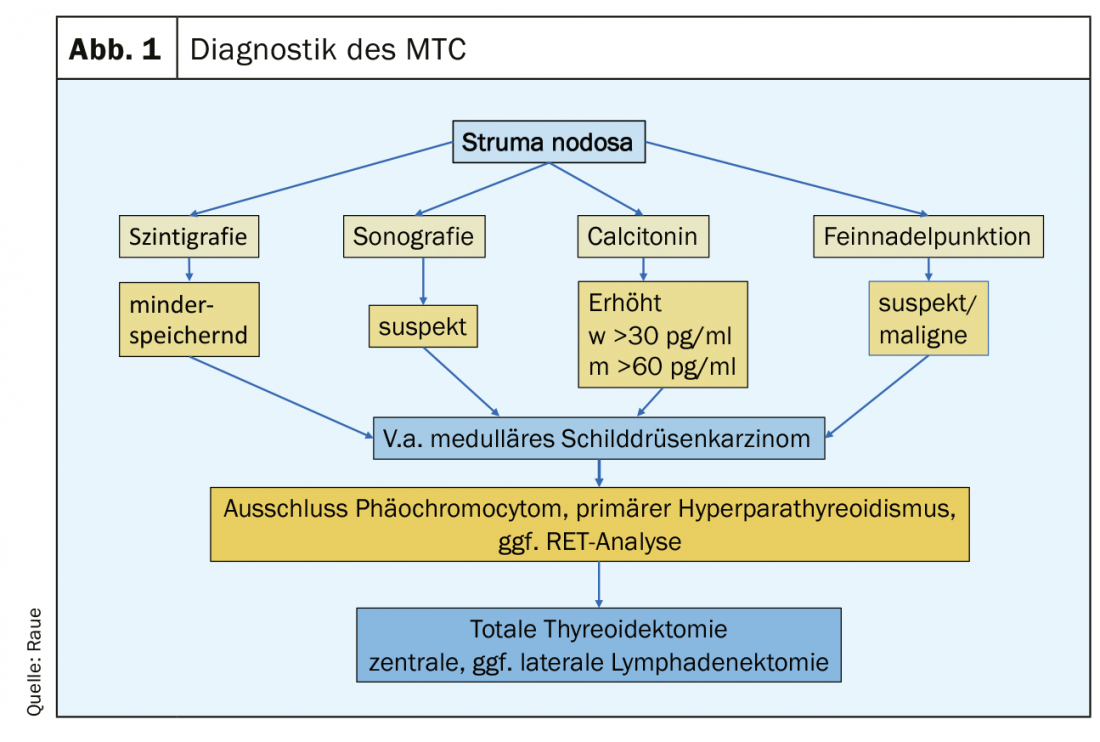
Clinicamente, o MTC medular não difere significativamente dos outros carcinomas da tiróide: nódulo crescente na tiróide, queixas não específicas no pescoço, desenvolvimento de inchaço dos gânglios linfáticos cervicais, e na fase avançada da metástase, pode ocorrer diarreia induzida por tumores pronunciados. Actualmente, o MTC é diagnosticado quer como um achado incidental na histologia de uma amostra de cirurgia à tiróide, quer durante o exame pré-operatório como parte do trabalho de um nódulo tireoidiano (Fig.1). Os indicadores são um nódulo suspeito na ecografia da tiróide (eco-pobre, microcalcificações, margens difusas, extensão mais profunda do que larga), gânglios linfáticos cervicais suspeitos, uma aspiração suspeita de agulha fina e um nível de Ctn elevado. Um nível Ctn acima de 100 pg/ml é a descoberta mais sensível e específica. Afectados são os pacientes no 4. e 5ª década de vida. Em pacientes mais jovens, a variante familiar (MEN2) deve ser considerada, que pode ocasionalmente manifestar-se através de condições concomitantes, tais como feocromocitoma e hiperparatiroidismo primário. O raro MTC deve também ser considerado no contexto da clarificação de uma elevação CEA.
Rastreio de calcitonina na clarificação de struma nodosa
Ctn correlaciona-se com a massa tumoral e é um marcador tumoral sensível e específico para a detecção precoce e acompanhamento do MTC. A determinação de rotina da Ctn no trabalho de struma nodosa torna possível o diagnóstico precoce [3]. Níveis ligeiramente elevados de Ctn são encontrados na hiperplasia de células C, que pode ser um precursor do MTC hereditário, mas também é observado como um fenómeno “benigno” concomitante em outras doenças da tiróide [4]. Com o desenvolvimento de novos ensaios de medição Ctn mais sensíveis e específicos totalmente automatizados (imunoensaios quimioluminescentes com uma sensibilidade de 0,5 pg/ml e valores de referência superiores específicos do sexo) [5,6], os níveis de Ctn basal tornaram-se mais importantes para o rastreio em struma nodosa.
A níveis de Ctn pré-operatórios acima de 100 pg/ml, o MTC está presente em quase 100% dos casos, enquanto que a níveis de Ctn entre 10-20 pg/ml, a taxa de resultados para o MTC é inferior a 5% [7]. Tendo em conta a sensibilidade e especificidade, os valores de corte específicos de género da Ctn basal para a recomendação de cirurgia de um MTC suspeito resultam em aproximadamente 30 pg/ml para as mulheres e aproximadamente 60 pg/ml para os homens. A gama cinzenta de Ctn para mulheres é de 20-30 pg/ml, para homens 30-60 pg/ml, em que 6-13% pequenos MTC não foram detectados [8]. O aumento dos níveis de Ctn é mais indicativo de um MTC, caso em que a cirurgia deve ser recomendada. As medidas cirúrgicas podem curar MTC em quase 100% até um nível de Ctn de 100 pg/ml [9].
Mutações RET protooncogénicas na linha germinal em MEN2
Em cerca de 25% dos doentes com MTC, pode ser detectada uma mutação da linha germinal no protooncogene RET como uma indicação da síndrome MEN2. Clinicamente, o MEN2A com o possível desenvolvimento de um feocromocitoma e hiperparatiroidismo distingue-se do MEN2B com um hábito típico, a ganggloneuromatose das mucosas e o possível desenvolvimento de um feocromocitoma. Nem todas as famílias podem ser capturadas por uma história familiar, uma vez que as famílias são frequentemente pequenas ou é um hMTC que se manifesta tardiamente apenas com baixa penetração. Numa pequena percentagem, observa-se uma mutação “de novo” no paciente, outros membros da família não são afectados. Numa grande série, foi encontrada uma mutação da linha germinal no protooncogene RET em 12% do MTC aparentemente esporádico. Portanto, os testes genéticos moleculares para mutações da linha germinal no gene RET devem ser organizados para todos os pacientes com um MTC.
Na forma hereditária do MTC, as mutações causais são caracterizadas em quase todas as famílias, na sua maioria mutações pontuais em 8 exões diferentes do protooncogene RET. A detecção genética molecular destas mutações, juntamente com a determinação Ctn nas famílias das crianças e adolescentes afectados, permite uma tiroidectomia precoce com cura do MTC. O momento ideal da tiroidectomia em portadores de genes de uma mutação RET é actualmente recomendado com base na classificação do risco da mutação RET específica em risco moderado, elevado e mais elevado para o desenvolvimento precoce do MTC (penetração precoce ou tardia) (Tab. 1) [1]. O nível Ctn define individualmente a tiroidectomia profiláctica a ser planeada numa fase inicial, de modo a que no caso ideal não seja necessária uma linfadenectomia adicional.

Até 50% dos pacientes do MEN2 desenvolvem feocromocitomas no decurso das suas vidas, dependendo do genótipo, principalmente após a manifestação do MTC. Os feocromocitomas podem ser multifocais e bilaterais [10]. Os pacientes com mutações RET-634 e -918 são particularmente afectados, menos frequentemente com mutações em exons 13-15. Até 10% dos pacientes com MEN2 podem desenvolver hiperparatiroidismo primário dependendo do seu genótipo; os pacientes com uma mutação RET-918 não são afectados. Outras manifestações extrathyroidal, tais como ganglioneuromatose em MEN2B ou líquen amiloidose interescapular, são também dependentes do genótipo.
No tecido tumoral do MTC esporádico, uma mutação somática no gene RET, principalmente RET-M918T, é frequentemente detectável, curiosamente menos frequentemente em tumores menores, mais frequentemente em tumores maiores e mais frequentemente em filas de gânglios linfáticos e metástases distantes, sugerindo que esta mutação não é o evento primário na tumourigénese. No tecido tumoral em que não é encontrada uma mutação RET, a detecção de uma mutação RAS é frequentemente bem sucedida. A detecção da mutação somática RET tem significado prognóstico e é um pré-requisito para a terapia com os inibidores selectivos da tirosina cinase RET (LOXO-292, BLU-667) que provavelmente estará disponível em breve [11].
Funcionamento do MTC
A terapia primária para o MTC é cirúrgica. A tiroidectomia total é o procedimento mínimo, complementado pela dissecção central e, se necessário, lateral unilateral/bilateral dos gânglios linfáticos (LK), dependendo da fase pré-operatória medida Ctn e tumoral. No caso de um MTC descoberto por acaso na histologia, o nível de Ctn pós-operatório deve decidir sobre o procedimento seguinte; se o Ctn não for mensuravelmente baixo, não é necessária mais nenhuma cirurgia; se o Ctn for elevado, dependendo da fase do tumor, deve ser realizada uma operação completa (TX total e dissecção central e lateral de LK). A terapia curativa cirúrgica só é possível se nenhuma metástase distante, nenhuma infiltração nos tecidos moles tiverem sido descritas na histologia primária e se menos de 5-10 LK cervicais afectados forem detectáveis na histologia anterior ou menos de 3 compartimentos afectados após linfadenectomia sistemática [12]. Se esta situação favorável estiver presente, deve ser tentada uma terapia cirúrgica curativa. No caso de um MTC hereditário, uma tiroidectomia total é apropriada em todos os casos, uma vez que, em princípio, um MTC pode desenvolver-se a partir de cada célula C. Do MTC diagnosticado através de um nódulo palpável da tiróide, 70% já têm metástases linfonodais cervicais e 13% têm metástases distantes para o fígado, pulmão ou osso [13]. A sobrevivência de 10 anos é de aproximadamente 61-81% [14], dependendo da fase de diagnóstico do tumor, idade, sexo, níveis Ctn pré e pós-operatórios. Na última década, devido ao diagnóstico cada vez mais precoce, às fases mais favoráveis do tumor e às melhores estratégias cirúrgicas, a sobrevivência aumentou globalmente, mas também nas fases mais elevadas do tumor [14,15].
Em doentes com MEN2 detectados por rastreio familiar, o momento da “tiroidectomia profiláctica” depende da mutação RET e do nível Ctn (cf. Separador. 1). O diagnóstico precoce e a cirurgia completa aumentaram a sobrevivência de 5 anos específicos da doença de todos os MTC para 89% [14].
Cuidados à posteriori do MTC
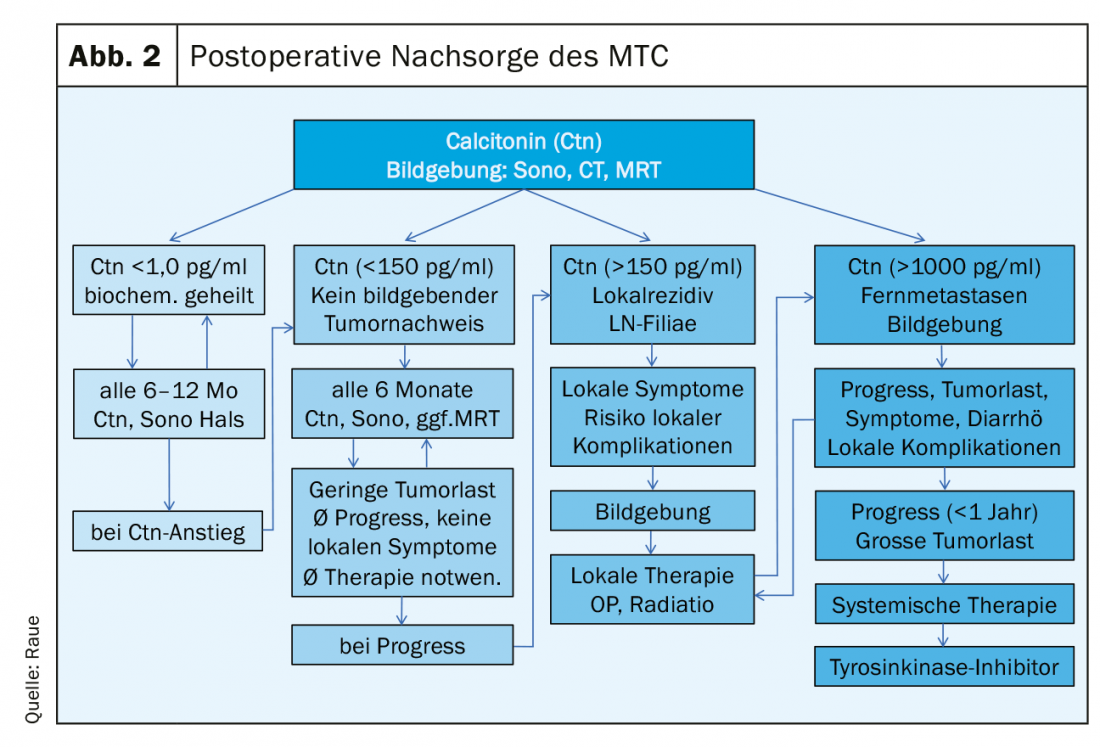
No pós-operatório, devem estar disponíveis os seguintes resultados para planear um seguimento estruturado: a histologia, se necessário a imunohistologia Ctn do tumor, a classificação de acordo com o esquema pTNM, o resultado da análise RET para classificação na variante hereditária ou esporádica e o nível Ctn pós-operatório. Três grupos de risco de pacientes podem ser definidos em termos de resposta à terapia primária e prognóstico: excelente (Ctn não mensurável baixo), bioquimicamente incompleto (Ctn mensurável, mas sem tecido tumoral detectável por imagem) e estruturalmente incompleto (Ctn significativamente elevado, evidência de gânglios linfáticos metastáticos ou metástases distantes). (Fig. 2). No curso seguinte, calcula-se o tempo de duplicação do marcador tumoral (Ctn/CEA) e realizam-se imagens para detectar o possível crescimento do tumor, seguido de ajuste do grupo de risco [16,17]. Os intervalos de acompanhamento são adaptados ao risco e são realizados a cada 3 meses até uma vez por ano, dependendo do tamanho e localização do tumor/metástase residual e da extensão da progressão do tumor [18]. Dependendo da localização das metástases suspeitas, os procedimentos de imagem incluem sonografia do pescoço e abdómen, tomografia computorizada com meio de contraste, MRI, cintilografia óssea, e possivelmente FDG-PET ou F-DOPA-PET (Fig. 1).
Grupos de risco nos cuidados de acompanhamento
No caso de uma excelente resposta, o nível Ctn não é mensurável baixo: então pode assumir-se que o paciente está bioquimicamente curado, desde que a histologia esteja correcta (imunohistologia Ctn obrigatória). Nos primeiros 2 anos, são suficientes exames de acompanhamento semestrais com sonografia do pescoço, determinação Ctn e CEA, verificação do tratamento de substituição com tiroxina (objectivo: TSH na gama normal) e, se necessário, no caso de hipoparatiroidismo pós-operatório, a administração de cálcio e calcitriol (objectivo: cálcio sérico na gama limite inferior 2,0-2,3 mmol/l) [19]. Posteriormente, se não tiver ocorrido qualquer aumento da Ctn, é possível passar a inspecções anuais. O prognóstico é excelente e não difere do da população normal.
No caso de resposta bioquimicamente incompleta, o nível Ctn é geralmente persistentemente ligeiramente a moderadamente elevado (geralmente abaixo de 1000 pg/ml). O tecido tumoral remanescente deve ser assumido. Se a operação anterior não foi adequada, uma “encenação” é seguida por uma operação complementar adequada. No entanto, se estes limites (ver secção Cirurgia do MTC) forem ultrapassados, já não é possível uma abordagem curativa, pelo que todas as outras medidas terapêuticas devem ser pesadas criticamente, tendo em conta o risco de morbilidade e a geralmente boa qualidade de vida. Muitas vezes, apesar de uma busca intensiva, não é encontrado nenhum tumor correlacionado com apenas Ctn moderadamente elevado até 150 pg/ml. A progressão da doença tumoral no curso seguinte pode ser muito diferente e pode ser estimada relativamente bem com base no tempo de duplicação do Ctn e CEA [20]. Os pré-requisitos para uma boa declaração são pelo menos 4 valores Ctn durante 2 anos. Os pacientes com marcadores tumorais que duplicaram menos de 24 meses também tiveram uma progressão morfológica da imagem em 94%. Quando o marcador de tumores duplicou durante 24 meses, 86% dos pacientes não tiveram crescimento detectável de tumores [21]. No curso seguinte, os controlos de progresso semestrais são normalmente suficientes. A frequência de diagnóstico por imagem pode ser planeada com base nos resultados primários, crescimento durante a progressão (critérios RECIST) e tempo de duplicação do marcador tumoral. Um diagnóstico de malha fechada sem consequências terapêuticas não é útil, por exemplo, a sonografia de 6 em 6 meses, a tomografia computorizada/MRI de 12 em 12 meses são frequentemente suficientes.
No caso de resposta estruturalmente incompleta, o nível Ctn é significativamente elevado (geralmente mais de 1000 pg/ml): Neste caso, deve assumir-se tecido tumoral infiltrante local, metástases linfonodais cervicais ou metástases distantes, principalmente para o pulmão, fígado e/ou osso. Já não é possível uma abordagem curativa, as medidas paliativas estão em primeiro plano [22].
As reoperações de uma recorrência locorregional sob uma abordagem paliativa são particularmente úteis em casos de recorrência local progressiva ou de filas linfonodais dolorosas na região central do pescoço (proximidade/infiltração da traqueia ou do esófago) a fim de reduzir as complicações locais. Não faz sentido submeter todas as metástases cervicais recentemente detectáveis a uma cirurgia imediata, uma vez que isto leva a numerosas operações que não atingem o seu objectivo. Não há provas de que estas operações tenham um efeito positivo no curso geral, estão frequentemente associadas a efeitos secundários tais como paresia recorrente, hipoparatiroidismo e paralisia muscular do braço. A radioterapia é útil para recidivas locais ou mediastinais inoperáveis progressivas. Uma vez que a cirurgia é mais difícil após a radioterapia, a operabilidade deve ser sempre examinada primeiro de um ponto de vista paliativo.
As metástases hepáticas são comuns, geralmente causam poucos sintomas e raramente são uma indicação para cirurgia. Devem ser tratadas metástases hepáticas significativamente progressivas e dolorosas. Na maioria dos casos, a metástase é múltipla e difusa. A terapia local por meio de (quimio)embolização ou radioterapia interna selectiva (SIRT) é de eficácia limitada. A terapia sistémica com inibidores de tirosina cinase é útil em casos de progressão rápida.
As metástases ósseas são raramente osteolíticas, propensas à fractura ou dolorosas. A radioterapia externa é apropriada para metástases ósseas dolorosas, e a radioterapia externa ou intervenção cirúrgica para risco de fractura. A terapia com bisfosfonato/denosumatismo pode ser utilizada adicionalmente numa base individual, especialmente em casos de dor ou risco de fractura, particularmente em metástases osteolíticas [23].
A quimioterapia é apenas ligeiramente eficaz no MTC metastásico. Os inibidores da tirosina cinase têm sido testados em ensaios de MTC metastásico avançado há cerca de 10 anos. Desde Maio de 2012, o inibidor de tirosina quinase vandetanibe está disponível na Suíça para o tratamento de MTC agressivo e sintomático; em alguns países, incluindo a Alemanha, o cabozantinib foi também aprovado para MTC progressivo e tem sido indicado neste país para o tratamento do carcinoma avançado de células renais desde 2017. Uma vez que a evidência de benefício na fase inicial da doença é claramente inexistente, a indicação para terapia com TKIs é actualmente observada em elevada carga tumoral e progressiva (critérios RECIST, curto tempo de duplicação do marcador tumoral), bem como doença marcadamente sintomática, quando as medidas terapêuticas locais foram esgotadas. O prolongamento da sobrevivência ainda não foi demonstrado com qualquer TKI no MTC metastásico [11].
Apesar das metástases distantes, muitos pacientes têm uma boa qualidade de vida durante anos porque o crescimento do tumor é muitas vezes muito lento. É possível uma estratégia de “vigilância activa”. O tratamento do MTC metastático é marcadamente orientado para os sintomas, incluindo um tratamento antidiarreico consistente na fase avançada do tumor com loperamida e/ou opii tinctura, que é frequentemente negligenciado ou doseado com demasiado cuidado à custa da qualidade de vida.
Cuidados de acompanhamento para MEN2
Para além do acompanhamento do MTC, é realizado um diagnóstico anual relativamente ao feocromocitoma a partir do 11º ano de vida para mutações RET de alto e alto risco e a partir do 16º ano de vida para mutações RET de risco moderado através da determinação de metanefrina e catecolamina e, se necessário, de imagens de ressonância magnética. No que diz respeito ao hiperparatiroidismo primário, é efectuado um controlo anual com determinação do soro de cálcio e paratormona de forma análoga em relação à idade nos grupos de risco de mutação correspondentes (tab. 1).
Mensagens Take-Home
- O marcador tumoral para carcinoma medular da tiróide (MTC) é a calcitonina.
- O rastreio de calcitonina em struma nodosa permite o diagnóstico precoce do MTC.
- Todos os doentes com MTC devem ter uma análise genética molecular do protooncogene RET no momento do diagnóstico.
- Como regra, o tratamento de escolha é a tiroidectomia total com linfadenectomia central.
- No seguimento, é feita uma diferenciação entre a cura bioquímica (Ctn não mensuravelmente baixa), bioquimicamente incompleta (Ctn aumentada sem evidência de tumor na imagem) e evidência de tumor estrutural (metástases na imagem).
- Em muitos casos com metástases, é possível “vigilância activa”; em caso de progressão e sintomas, aplica-se o seguinte: local (cirurgia paliativa, radiação) antes dos sistémicos (inibidores da tirosina cinase).
Literatura:
- Wells SA Jr, et al: Revised American Thyroid Association guidelines for the management of medullary thyroid canceroma. Tiróide 2015; 25(6): 567-610.
- Ceolin L, et al: Carcinoma medular da tiróide para além da cirurgia: avanços, desafios, e perspectivas. Endocr Relat Cancer 2019; 26(9): R499-R518.
- Raue F, Frank-Raue K: Rastreio de Calcitonin nos Limites Superiores do Bócio Nodular. Dtsch Arztebl Int 2018; 115(13): 221.
- Costante G, et al.: Determinação dos níveis de calcitonina na doença das células C: interesse clínico e potenciais armadilhas. Nat Clin Pract Endocrinol Metab 2009; 5(1): 35-44.
- Kratzsch J, Petzold A, Raue F, et al.: calcitonina basal e estimulada e procalcitonina por vários ensaios em doentes com e sem cancro medular da tiróide. Clin Chem 2011; 57(3): 467-474.
- Kahaly GJ, Algeciras-Schimnich A, Davis TE, et al: United States and European Multicenter Prospective Study for the Analytical Performance and Clinical Validation of a Novel Sensitive Fully Automated Immunoassay for Calcitonin. Clin Chem 2017; 63(9): 1489-1496.
- Mian C, Perrino M, Colombo C, et al: Teste de cálcio refinado para o diagnóstico de cancro medular da tiróide: cortes, procedimentos, e segurança. J Clin Endocrinol Metab 2014; 99(5): 1656-1664.
- Frank-Raue K, Schott M, Raue F. Em nome da Secção da Tiroideia da DGE. [Recommendation for Calcitonin Screening in Nodular Goiter]. Dtsch Med Wochenschr 2018; 143(15): 1065-1069.
- Machens A, Dralle H. Estratificação de risco baseada em biomarcadores para o cancro medular da tiróide previamente não tratado. J Clin Endocrinol Metab 2010; 95(6): 2655-2663.
- Mucha L, Leidig-Bruckner G, Frank-Raue K, et al: Faeocromocitoma em múltiplas neoplasias endócrinas tipo 2: penetração específica do códão RET e alterações na gestão durante as últimas quatro décadas. Clin Endocrinol (Oxf) 2017; 87(4): 320-326.
- Cabanillas ME, Ryder M, Jimenez C: Targeted Therapy for Advanced Thyroid Cancer: Kinase Inhibitors and Beyond. Endocr Rev 2019; 40(6): 1573-1604.
- Machens A, Gimm O, Ukkat J, et al: Melhoria da previsão da normalização da calcitonina em doentes com carcinoma medular da tiróide através da análise quantitativa dos gânglios linfáticos. Cancro 2000; 88(8): 1909-1915.
- Roman S, Lin R, Sosa JA: Prognóstico do carcinoma medular da tiróide: preditores demográficos, clínicos, e patológicos de sobrevivência em 1252 casos. Cancro 2006; 107(9): 2134-2142.
- Randle RW, Balentine CJ, Leverson GE et al: Tendências na apresentação, tratamento e sobrevivência de pacientes com cancro medular da tiróide nos últimos 30 anos. Cirurgia de 2017; 161(1): 137-146.
- Opsahl EM, Akslen LA, Schlichting E, et al: Trends in Diagnostics, Surgical Treatment, and Prognostic Factors for Outcomes in Medullary Thyroid Carcinoma in Norway: A Nationwide Population-Based Study. Eur Thyroid J 2019; 8(1): 31-40.
- Lindsey SC, Ganly I, Palmer F, et al: A resposta à terapia inicial prevê resultados clínicos no cancro medular da tiróide. Tiróide 2015; 25(2): 242-249.
- Yang JH, Lindsey SC, Camacho CP, et al: A integração de uma medição de calcitonina pós-operatória num sistema de estadiamento anatómico melhora a estratificação inicial do risco no cancro medular da tiróide. Clin Endocrinol (Oxf) 2015; 83(6): 938-942.
- Raue F, Frank-Raue K: Acompanhamento a longo prazo no Carcinoma Medular da Tiróide. Resultados recentes Cancer Res 2015; 204: 207-225.
- Leidig-Bruckner G, Bruckner T, Raue F, et al: Long-Term Follow-Up and Treatment of Postoperative Permanent Hypoparathyroidism in Patients with Medullary Thyroid Carcinoma: Differences in Complete and Partial Disease. Horm Metab Res 2016.
- www.thyroid.org/professionals/calculators/thyroid-cancer-carcinoma
- Laure Giraudet A, Al Ghulzan A, Auperin A, et al.: Progressão do carcinoma medular da tiróide: avaliação com calcitonina e antígeno carcinoembrionário que duplicam os tempos. Eur J Endocrinol 2008; 158(2): 239-246.
- Hadoux J, Pacini F, Tuttle RM, et al: Gestão do cancro medular avançado da tiróide. Lancet Diabetes Endocrinol 2016; 4(1): 64-71.
- Vogel T, Wendler J, Frank-Raue K, et al: Metástases ósseas no Carcinoma Medular da Tiróide: Morbilidade elevada e mau prognóstico associado à morfologia osteolítica. J Clin Endocrinol Metab 2020; 105(6).
InFo ONCOLOGy & HEMATOLOGy 2020; 8(3): 6-10