O diagnóstico, terapia e acompanhamento do cancro testicular são claramente definidos por recomendações de consenso internacional. As hipóteses de cura do cancro testicular são elevadas com tratamento adequado. Os doentes com cancro testicular devem ser apresentados num centro especializado em oncologia.
Embora o cancro testicular seja raro, com uma incidência de cerca de 10/100.000 habitantes, é o cancro mais comum na faixa etária dos homens de 15 a 40 anos. Em cerca de 3%, existe também uma fase pré-cancerosa no testículo contralateral, não portador de tumor (CIS ou TIN ou IGCNU), e em cerca de 5% do cancro testicular ocorre principalmente extragonadalmente (os chamados tumores de células germinais extragonais). Portanto, o diagnóstico diferencial de tumor testicular ou tumor de células germinativas deve ser incluído em todos os homens com um tumor primário pouco claro [1]. Devido à resposta excepcionalmente boa à terapia e graças aos estudos consistentemente conduzidos, o cancro testicular tornou-se uma espécie de “doença modelo” para descrever a acção oncológica bem sucedida muito cedo.
Diagnóstico, encenação e estratificação de risco
O diagnóstico primário do cancro testicular envolve primeiro os passos indicados no quadro 1. Uma TC ou RM da cabeça só é necessária se forem detectadas metástases pulmonares ou se estiverem presentes sintomas clínicos. O PET-CT não tem qualquer papel no diagnóstico primário do cancro testicular [1].

No que respeita à histologia, a distinção entre seminomas, não-seminomas e teratomas maduros é importante. Todos os tumores mistos e todos os tumores de pacientes com elevação de AFP são considerados não-seminomas, independentemente da histologia. Na encenação, é feita uma distinção na rotina clínica entre a fase I, com a doença confinada ao testículo, e as fases do tumor metástaseado. Em doentes com uma clara elevação dos marcadores tumorais AFP e HCG, não é necessária confirmação histológica, mesmo no caso de tumores de células germinativas extragonais.
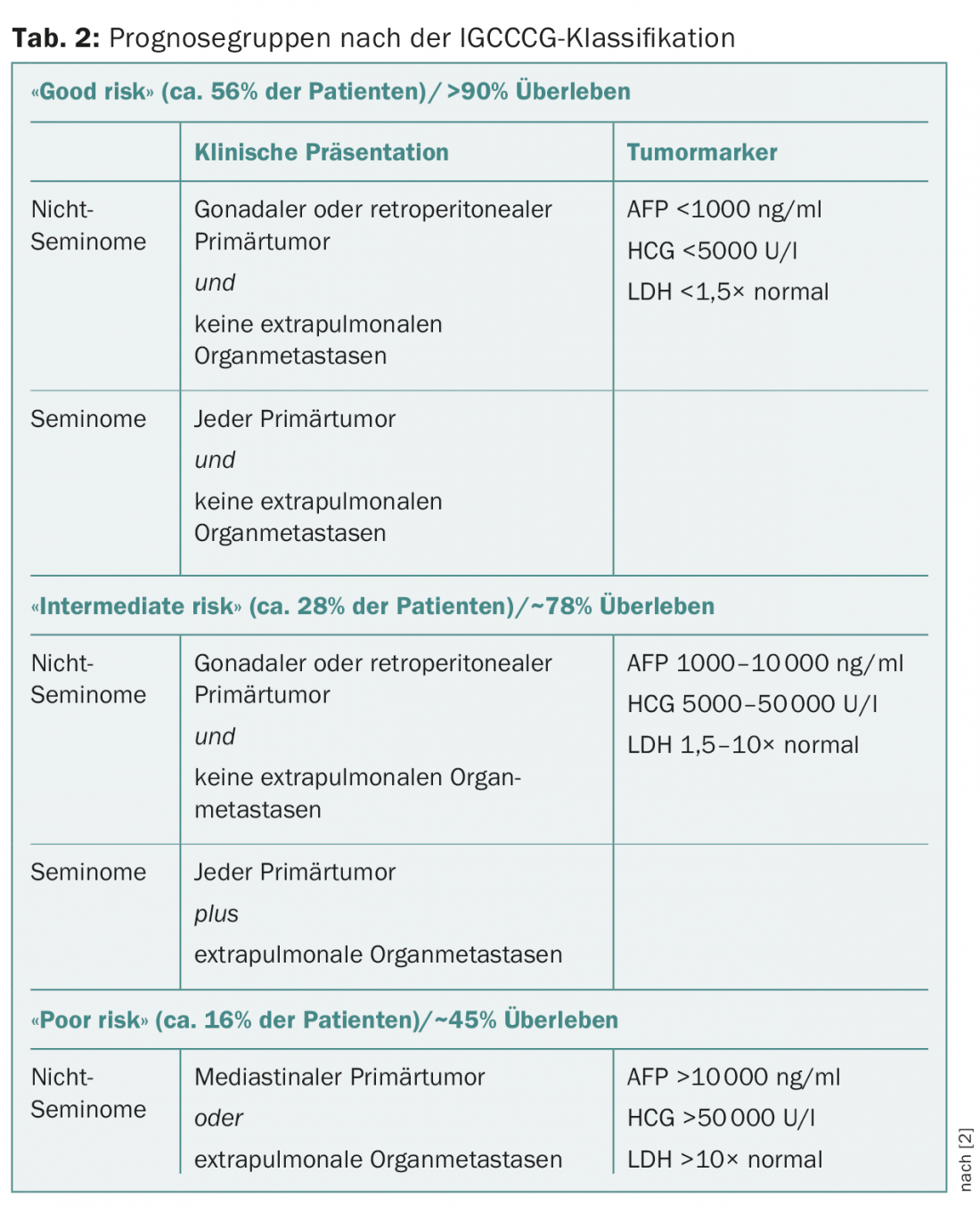
Na fase clínica I com doença confinada ao testículo, o tamanho do tumor, a infiltração do testículo rete e, mais recentemente, a invasão vascular linfovascular no tumor primário são discutidos como factores de risco para metástases ocultas nos seminomas, mas são controversos. Na fase I não-seminoma, a invasão vascular linfovascular no tumor primário é confirmada como factor de risco de metástase oculta, mas o significado da infiltração do testículo rete ou a percentagem de carcinoma embrionário é controversa. As fases do tumor metastasisado estão divididas em três grupos de prognóstico de acordo com a classificação IGCCCG (International Germ Cell Cancer Collaborative Group) (Tab. 2) [2].
Terapia primária
Os doentes com doença gonadal recebem principalmente uma orquiectomia. A biopsia do testículo contralateral não afectado é útil para identificar pacientes com CIS ou TIN ou IGCNU, mas continua a ser opcional. Os doentes com doença amplamente metástase e um tumor primário gonadal, por outro lado, recebem principalmente quimioterapia e só depois de terminada a quimioterapia uma orquiectomia.
Terapia da Fase I
Os doentes com seminoma de fase I recebem vigilância activa como padrão com um risco de recorrência entre 10-25%. A terapia adjuvante com um ciclo de carboplatina numa dose AUC 7 pode reduzir o risco de recidiva para 5%, mas é sobreterapia para a maioria dos pacientes. A radioterapia paraaórtica adjuvante com 20 Gy é reservada para casos individuais.
Os pacientes com não-seminomas de fase I sem invasão linfovascular no tumor primário recebem vigilância activa como padrão, com um risco de recorrência de aproximadamente 15%. Um ciclo de quimioterapia adjuvante com cisplatina, etoposida e bleomicina (PEB) pode reduzir o risco de recidiva para menos de 3%, mas é um tratamento excessivo para a maioria dos pacientes.
Os pacientes com não-seminomas de fase I e invasão linfovascular no tumor primário recebem também vigilância activa, com um risco de recorrência de cerca de 50%, ou um ciclo de quimioterapia adjuvante com PEB, o que reduz o risco de recorrência para menos de 3%. A linfadenectomia retroperitoneal como terapia primária para não-seminomas de fase I é reservada para casos individuais.
Antes de qualquer terapia adjuvante de seminomas e não-seminomas na fase I, é necessária uma determinação dos marcadores tumorais AFP, HCG e LDH. Os doentes com marcadores tumorais persistentemente elevados ou mesmo em aumento após a orquiectomia não são considerados como tendo o estádio I, mas sim o estádio de tumor metastático, mesmo na ausência de provas radiológicas de metástases.
Terapia para fases metastasisadas
Os doentes com seminoma metastásico recebem três ciclos (“bom risco”), raramente quatro ciclos (“risco intermédio”) PEB, dependendo da categoria IGCCCG. Os doentes com metástases ganglionares abdominais muito limitadas até cerca de 2 cm podem alternativamente ser irradiados ou, no caso de metástases até um máximo de 5 cm, incluídos no ensaio SAKK 01/10 em curso para esta fase [3].
Os pacientes com não-seminomas metastáticos recebem três (“bom risco”) ou quatro (“risco intermédio” e “mau risco”) ciclos de PEB, dependendo da categoria IGCCCG. Uma queda inadequada do marcador após o primeiro ciclo terapêutico é um factor de prognóstico negativo adicional em doentes de “baixo risco”. Estes pacientes podem beneficiar de uma complexa terapia combinada “dose-densa” do grupo de trabalho francês GETUG [4].
A PEB é aplicada a seminomas e não-seminomas exclusivamente de acordo com o regime padrão (tab. 3) . Os intervalos terapêuticos de três semanas devem ser observados. A bleomicina deve ser omitida em doentes idosos e em doentes com funções pulmonares ou renais deficientes. Em pacientes com prognóstico favorável, a terapia pode ser igualmente eficaz com quatro ciclos de cisplatina e etoposida sem bleomicina em vez de três ciclos de PEB. Em doentes com prognóstico intermédio ou desfavorável, a bleomicina deve ser substituída por ifosfamida. A decisão de utilizar quimioterapia primária de alta dose é tomada individualmente para pacientes de alto risco com mediastino não-seminomas primários e para pacientes com metástases hepáticas, ósseas ou do SNC.
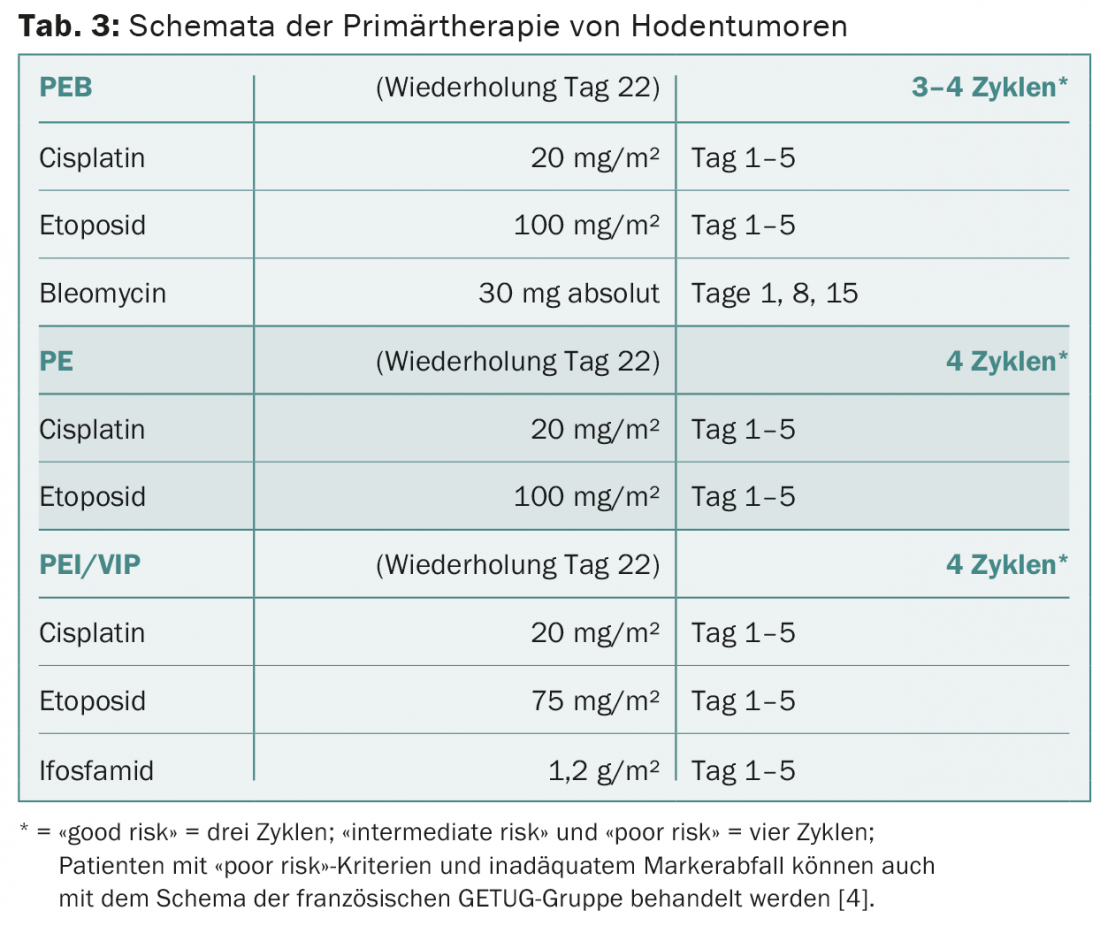
Avaliação terapêutica e ressecção de tumores residuais
Em todos os pacientes com seminomas e não-seminomas, os exames de diagnóstico primário são repetidos aproximadamente três semanas após o início do último ciclo terapêutico. O estadiamento intermédio não é geralmente necessário, e o PET-CT não tem valor na avaliação terapêutica excepto em doentes com seminoma puro e tumor residual após quimioterapia primária.
Os doentes com seminoma puro sem remissão completa após a quimioterapia não recebem uma ressecção tumoral residual, mas um PET-CT no mínimo doze semanas após o início da última quimioterapia. A decisão terapêutica adicional é tomada individualmente, dependendo dos resultados da PET.
Os pacientes com nãoeminomas sem remissão completa recebem a ressecção de todos os resíduos radiologicamente detectáveis no prazo máximo de quatro a oito semanas após o início do último ciclo de quimioterapia. A decisão terapêutica posterior é tomada individualmente, dependendo das descobertas histológicas.
Terapia recorrente
O tratamento de pacientes com seminoma e não-seminoma e recidiva após a terapia da fase I é análogo aos algoritmos de tratamento para pacientes com doença metastática primária, independentemente da escolha da gestão primária. Em regra, três a quatro ciclos de PEB são utilizados nestes pacientes, dependendo do estádio do tumor. A maioria destes pacientes torna-se permanentemente livre de doenças como resultado.
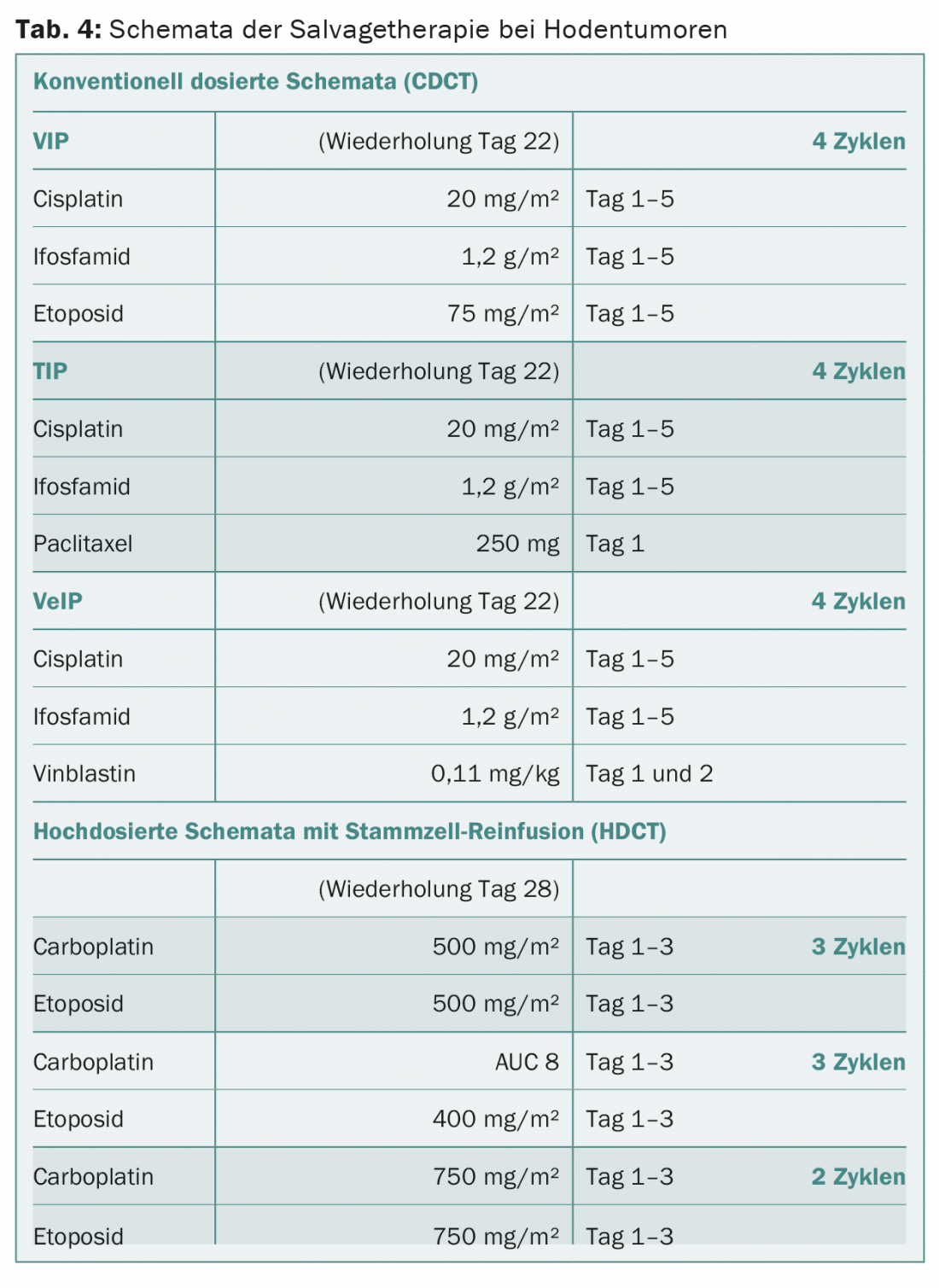
A quimioterapia muito mais intensiva de recaída (sinónimo de “quimioterapia de recuperação”) continua limitada aos pacientes metástaseados que respondem mal à quimioterapia primária e não conseguem a remissão completa da sua doença ou que recaem da remissão completa após a quimioterapia primária. Existem duas estratégias principais de tratamento: doses convencionais de quimioterapia ou doses elevadas de quimioterapia (Tab. 4) . A melhor estratégia de salvamento é determinada numa base individual.
Recidivas tardias
As recidivas tardias mais de dois anos após a quimioterapia primária são raras. Sempre que possível, a ressecção completa da recidiva tardia deve ser realizada principalmente. O procedimento posterior depende do resultado cirúrgico e dos achados histológicos.
Terapia paliativa
A terapia paliativa só é necessária num pequeno número de pacientes. Os medicamentos citostáticos bem documentados e eficazes na situação paliativa são gemcitabina, oxaliplatina e paclitaxel, tanto como substâncias isoladas como como parte de terapias combinadas. A radioterapia paliativa ou “cirurgia do desespero” pode ser indicada para pacientes individuais.
Plano de Cuidados de Sobrevivência
Os doentes com remissão completa recebem uma consulta final após o fim da terapia, durante a qual é elaborado um plano de cuidados de sobrevivência que inclui os pontos enumerados no quadro 5.

Os cuidados de acompanhamento são prestados de acordo com as directrizes desenvolvidas por Cathomas et al. esquemas de acompanhamento publicados [5]. Com o consentimento das pessoas interessadas, os resultados dos exames são incluídos no registo de acompanhamento. Isto implica que os diagnósticos de TAC já não são realizados no seguimento de rotina dos pacientes dois anos após a conclusão do tratamento.
Para mais informações: www.hodenkrebs.de
Literatura:
- Beyer J, et al: Manter o sucesso, reduzir a carga de tratamento, concentrar-se na sobrevivência: destaques da terceira conferência de consenso europeu sobre diagnóstico e tratamento do cancro de células germinativas. Anais de Oncologia 2013; 24: 878-888.
- Classificação Internacional do Consenso de Células Alemãs: Um sistema de estadiamento baseado em factores prognósticos para cancros de células germinativas metastásicas. Grupo Colaborativo Internacional sobre o Câncer de Células Alemãs. J Clin Oncol 1997; 15: 594-603.
- www.sakk.ch
- Fizazi K, et al: Quimioterapia personalizada baseada no declínio de marcadores tumorais em tumores de células germinais de mau prognóstico (GETUG 13): um ensaio fase 3, multicêntrico, aleatório. Lancet Oncol 2014; 15: 1442-1450.
- Cathomas R, et al.: Recomendações interdisciplinares baseadas em provas para o acompanhamento de doentes com cancro testicular: um esforço conjunto. Semanário Médico Suíço 2010; 140: 356-369.
InFo ONCOLOGy & HEMATOLOGy 2016; 4(1): 34-37