Durante muito tempo, o tratamento do lúpus foi caracterizado pela estagnação. No entanto, após 20 anos de frustração, há finalmente um movimento de novo no desenvolvimento de novas opções terapêuticas. Os estudos produziram resultados promissores para três substâncias activas especificamente para o tratamento da lupus nephritis. O velho princípio da indução e conservação teve finalmente o seu dia.
Como em todas as doenças genéticas, existem formas monogenéticas de lúpus eritematoso sistémico (LES). Mas para cada paciente que tem uma mutação tão má, há outros 1000 que têm variantes menores. Por exemplo, não lhes falta toda a proteína, mas apenas um único domínio, o que significa que eles têm um curso muito mais suave da doença. Os doentes com lúpus têm frequentemente variantes genéticas não só num gene, mas em muitos, e depois é a soma das pequenas coisas que definem esta doença.
Esta constelação é diferente para cada paciente individualmente. Em relação à lupus nephritis (LN), as variantes genéticas também afectam o rim, o que pode resultar, por exemplo, em fraqueza da membrana basal (os doentes desenvolvem rapidamente hematúria), fraqueza endotelial (levando a complicações vasculares) ou fraqueza podocitária (proteinúria, síndrome nefrótica). Onset, classe e prognóstico do LN são determinados geneticamente. O diagnóstico genético vale particularmente a pena em casos com história familiar, LES infantil e casos atípicos/síndromos.
A hipótese generalizada de que o lúpus é uma doença que ocorre em recidivas pode ser rejeitada, pelo menos para a nefrite lupus, explicou o Prof. Dr. Hans-Joachim Anders, Nephrology Centre, LMU Munique [1]: “Não há recidivas de LN, há sempre apenas pessoas que não aderem à sua terapia ou que o fazem de forma inadequada. Ou onde o médico e o paciente decidiram reduzir a dose – e então a doença começa de novo em algum momento porque a terapia não foi suficiente. Mas é uma doença crónica que persiste permanentemente”. Portanto, é preciso encontrar a dose de medicamento que é suficiente e depois aderir a ela.
Não há LN sem CKD
A proteinúria é sempre também uma indicação de doença renal, lembrou o nefrologista. “Se tiver proteína positiva na tira de teste, isso significa quase sempre que há danos de podócitos”. Os podócitos são as células da barreira de filtração nos glomérulos que são particularmente sensíveis, e quando são danificados (imunologicamente, toxicamente ou geneticamente) ocorre proteinúria. Por esta razão, a detecção de proteinúria na tira-teste de urina é sempre um sinal de doença renal. “Não é necessário enviar o doente a um urologista, não há doença na urologia que explique a proteinúria”. Em vez disso, o nefrologista é a pessoa de contacto certa num caso destes. A hematúria, por outro lado, pode por vezes ocorrer em doenças urológicas, mas é claro que também ocorre em doenças renais. Em particular, a combinação de hematúria e proteinúria só pode, na realidade, ser explicada por doença renal. “Isto é então normalmente chamado de síndrome nefrítica, e é particularmente comum no lúpus”.
Contudo, a hematúria permite tirar conclusões de que uma membrana do porão deve ter sido quebrada, pois caso contrário os eritrócitos não passariam. A este respeito, o sangue na urina é sempre um sinal de uma membrana cave partida, e se ocorrer juntamente com proteinúria, provavelmente do glomérulo, o que torna provável um fundo imunológico em lúpus. As directrizes afirmam que os doentes com proteinúria que é superior a 500 miligramas por dia devem fazer uma biopsia aos rins. A biópsia é então avaliada utilizando uma pontuação que tem agora quase 20 anos, o que o Prof. Anders criticou. Existem iniciativas para uma actualização, mas ainda nada de concreto está disponível.

Importante: Qualquer paciente que tenha nefrite lúpica tem, por definição, doença renal crónica (CKD). “É quando o nefrologista deve ser envolvido em algum momento e não apenas quando vai à diálise”. O LN está sempre presente durante mais de três meses, o que o torna crónico. Há 5 fases diferentes: se a função renal ainda estiver bem, o LN pode muito bem estar na fase 1, mas ainda é uma doença renal crónica em qualquer caso. A doença renal também significa que os nefrónios se perdem mais rapidamente do que através do processo normal de envelhecimento. Isto encurta o tempo de vida dos rins. “E como todos os meus pacientes querem viver pelo menos até aos 90 anos, já está a ficar apertado nas costas”, advertiu o perito. Recordou também à audiência que embora as taxas a 10 ou 15 anos pareçam boas para a profissão médica, não interessam às mulheres de 25 anos, que não querem fazer diálise mesmo aos 40 anos. A este respeito, há que lutar pelos nefrónios dos pacientes muito antes da creatinina se erguer. Quando isto acontece, metade dos nefrónios já estão perdidos.
Manter a cortisona em lume brando
O Prof. Anders referiu-se ao termo “nefrite por lúpus refractário” como um conto de velhas esposas. É verdade que há pacientes que têm lúpus que é difícil de controlar imunologicamente. No entanto, a sua recomendação foi a de utilizar a terapia padrão (pulsos esteróides mais terapia IS de primeira linha) nesses casos, aos quais a maioria dos pacientes responde. As directrizes diriam para usar primeiro a ciclofosfamida ou MMF para o LN e se isso não funcionar, para mudar, mas “isso não faz qualquer sentido”. O perito comparou isto com a administração de um antibiótico no caso de uma infecção, que não é substituído por nenhum outro antibiótico se não houver resposta. Aqui, como ali, há que considerar um rediagnóstico, talvez um teste de esfregaço. “Portanto, se o doente não responder à terapia de primeira linha, fale com um centro ou biopsia, faça diagnósticos genéticos, perfil imunológico”. E acima de tudo: verificar a não aderência, agora que os MMF estão a ser cada vez mais utilizados oralmente.
Como aumentar a aderência – em geral, como médico deve falar muito com o doente (pelo menos 1 Std. aconselhamento): Patogénese (infecção, hereditariedade), tomar a pílula, vacinações, factores de risco cardiovascular, reduzir os medos e evitar “hocus pocus” tais como praticantes alternativos ou o uso de pedras quentes devem ser discutidos em pormenor e explicados. A aderência também pode ser assegurada através da auto-responsabilidade e auto-protecção: a protecção solar (pelo menos 50 de força) já em Abril faz definitivamente parte disto. A hidroxicloroquina pode ser utilizada em todos os pacientes, mas não a cortisona oral >5 mg (ou belimumab). A chamada “recaída” – que, como explicado acima, não existe – já não é tratada oralmente com 20 mg de cortisona, como se fazia no passado. Em vez disso, hoje em dia há apenas 3 vezes 250 mg de metilprednisolona pulsoterapia durante um período de 3 dias. Depois disso, continua-se com a dose de manutenção normal, caso contrário a exposição à cortisona é demasiado elevada. No entanto, os últimos mg de cortisona não devem ser descontinuados, aconselhou o perito. “Caso contrário, um terço dos doentes terá uma recaída. O lúpus é uma doença permanente, o que significa que uma terapia tem de ser aplicada permanentemente. 2-4 mg de cortisona a longo prazo não faz muita diferença.
A hidroxicloroquina deve ser reduzida em 50% se a função renal se deteriorar, mas felizmente apenas com um eGFR de 20 ml/min (as directrizes recomendam em 30 ml/min).
Creme solar para auto-protecção
Terapêuticamente, nada pode ser alterado no problema básico, a composição genética. Só a prevenção da morte celular é possível. Antes de mais nada, isso significa colocar protector solar. Isto porque as queimaduras solares conduzem regularmente à libertação de enormes quantidades de material nuclear, e isto pode de facto desencadear um surto. Por conseguinte, recomenda-se uma protecção solar cuidadosa para todos os pacientes com lúpus.
O Rituximab não se tem realmente apanhado como opção para a imunossupressão. Estudos mostram que pacientes gravemente doentes parecem beneficiar, mas em relação a todos os grupos de pacientes o valor p não é suficientemente bom, por isso todos os estudos até agora são negativos. Um deplorador de células B muito mais potente do que o rituximab, por outro lado, é o obinutuzumab (OBI), que elimina todas as células B em poucos dias, e é por isso que é mais potente. Obinutuzumab é aprovado para esclerose múltipla, e o ensaio de NOBILIDADE fase 2 também demonstrou agora a sua eficácia no LN. Foi demonstrado um tamanho de efeito de 22% em todos os pacientes com LN biopsia comprovada – isto correspondeu a uma duplicação do número de pacientes que obtiveram uma resposta completa. Sem rótulo, o obinutuzumab já pode ser utilizado.
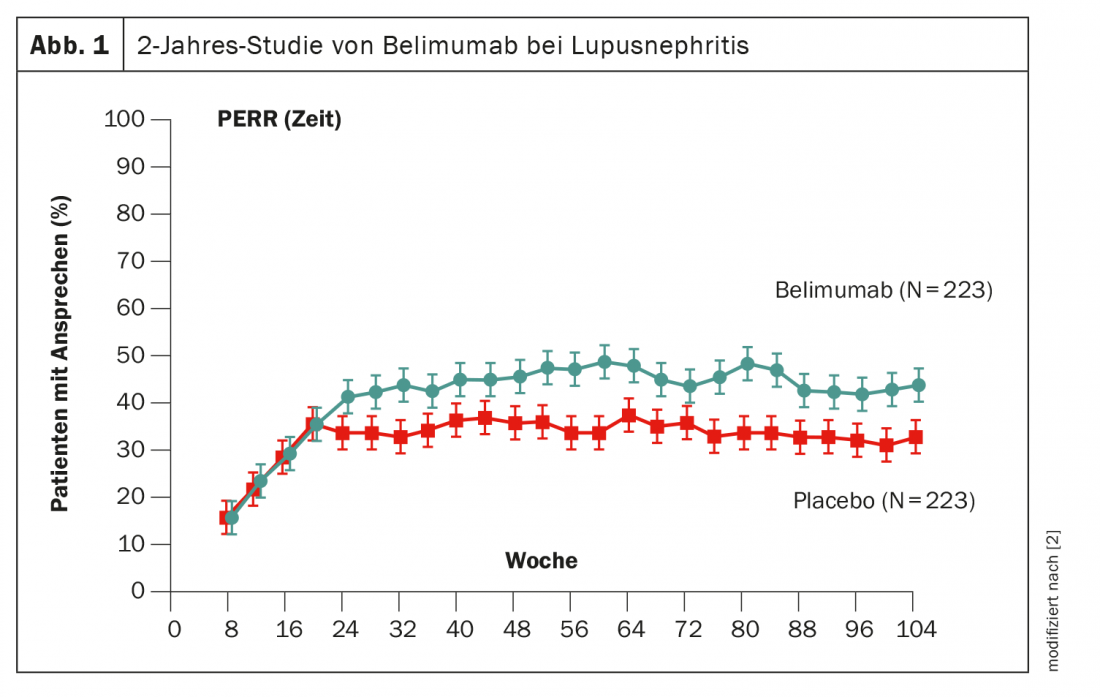
Outra forma de manipular as células B é o belimumab, que já foi provado na sua utilização. No ensaio BLISS fase 3, os pacientes receberam belimumab desde o início durante 2 anos [2]. Após cerca de 6 meses, uma vantagem sobre o placebo tornou-se estatisticamente significativa, embora o tamanho do efeito de 11% fosse inferior ao do obinutuzumab (Fig. 1). A substância activa já está aprovada na Suíça.
O Tacrolimus é um dos imunossupressores que afecta principalmente a proliferação de células T. O ingrediente activo já tem sido discutido nos últimos anos, uma vez que é utilizado em combinação com MMF na Ásia. No entanto, não existem dados disponíveis para os europeus. Para a voclosporina, semelhante ao tacrolimus, também um inibidor de calcineurina, o estudo de fase 3 AURORA demonstrou a sua eficácia. A dimensão do efeito após 52 semanas foi de 18%, o efeito estava principalmente relacionado com a proteinúria. Mais uma vez, houve quase uma duplicação do número dos casos que obtiveram uma resposta completa.
O que todas estas novas opções terapêuticas têm em comum é que já não têm como objectivo a indução e manutenção, mas sugerem desde o início uma terapia combinada a longo prazo. “O lúpus é assim reconhecido como uma doença auto-imune crónica que também requer terapia crónica”, disse o Prof. Anders. “Dá-se uma dose elevada de cortisona no início e depois continua-se com uma terapia permanente. Isso parece funcionar muito melhor do que as velhas ideias de indução e manutenção”.
Na monitorização, muito depende da protinuria: se desce para menos de 0,8 no prazo de um ano, isto tem um valor preditivo muito elevado para o resultado a longo prazo, pelo que estes pacientes têm um bom prognóstico a longo prazo. Aqueles que não conseguirem isto podem precisar de outro protocolo ou de uma nova biópsia após 12 meses. Conselhos do Prof. Anders aos colegas: “Connosco, explicamos a todos os pacientes na primeira biopsia que haverá uma segunda dentro de um ano, para que possamos ver se a terapia funcionou”.
Resumo
- O lúpus é uma doença poligénica que leva a uma perda de tolerância ao material nuclear.
- O prognóstico é individual.
- Segunda ronda de diagnósticos se não houver CR
- CYC/MMF e AZA/MMF terapêuticos, novas opções terapêuticas virão/estão já disponíveis (obinutuzumab, belimumab, voclosporin).
- Para monitorizar a nefrologia baseada em SCr/proteinuria, se o paciente não responder à biopsia de controlo. Se não houver resposta, considerar contactar um centro de lúpus.
– FomF Rheumatismo Nephro Refresher (online)
Fontes:
- Palestra “Antisynthetase Syndromes” na FomF Rheuma Nephro Refresher (online), 30.10.2020.
- Furie R, et al: Ensaio de dois anos, aleatório e controlado de Belimumab em Lupus Nephritis. N Engl J Med 2020; 383: 1117-1128; doi: 10.1056/NEJMoa2001180.
InFo PAIN & GERIATURA 2020; 2(2): 28-30 (publicado 7.12.20, antes da impressão).