As opções de medicamentos no tratamento do cancro do pulmão têm-se desenvolvido rapidamente nos últimos anos. Para além da quimioterapia clássica, a imunoterapia e a terapia direccionada das mutações do condutor estão cada vez mais a vir à tona. A importância da biopsia e também da re-biopsia sob terapia tem aumentado enormemente.
As opções de medicamentos no tratamento do cancro do pulmão têm-se desenvolvido rapidamente nos últimos anos. Para além da quimioterapia clássica, a imunoterapia e a terapia direccionada das mutações do condutor estão cada vez mais a vir à tona. O pré-requisito básico para a terapia medicamentosa personalizada é o exame imuno-histoquímico e patológico molecular do tecido tumoral. Devido a estes desenvolvimentos, a importância da biopsia e também da re-biopsia sob terapia tem aumentado enormemente.
Devido à relação risco-benefício favorável, a broncoscopia é o método de escolha. O exame deve fornecer uma clarificação abrangente da situação torácica. Isto inclui manifestações tumorais centrais e periféricas e estado dos gânglios linfáticos mediastinais.
Um pré-requisito obrigatório para tal é a presença de imagens da secção torácica, pelo menos sob a forma de um TC contrastado, de forma óptima, um PET-CT combinado.
Tumor central
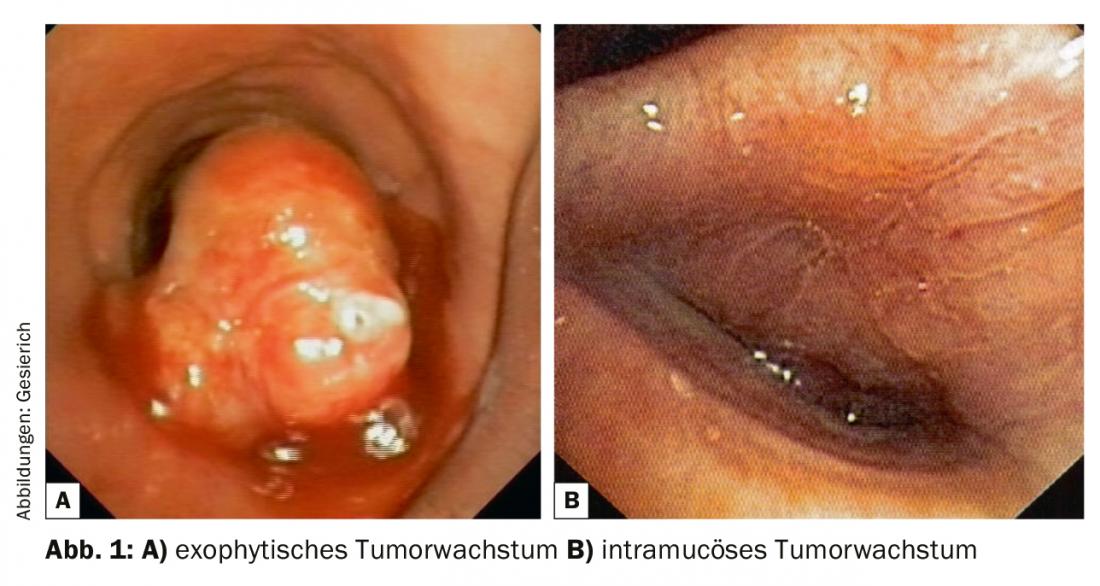
Um tumor central na área broncoscopicamente visível deve ser primeiro descrito em termos da sua localização e extensão. Deve ser indicada a distância aos pontos de referência proximais e distais mais próximos (carina principal, flap, segmento e óstios subsegmentares), bem como o comprimento do segmento brônquico afectado pelo tumor. Neste contexto, o broncologista deve estar familiarizado com as opções cirúrgicas torácicas, incluindo procedimentos broncoplásticos complexos (“ressecções do manguito”). O tipo de infestação tumoral (exófita, intramucosa, submucosa) deve ser descrito. Qualquer estenose das vias aéreas resultante (endoluminal-exofítica; compressão extrínseca; estenoses combinadas) deve ser caracterizada e quantificada.
O passo seguinte é a biópsia, em que os requisitos de tecido muito maiores da patologia para a realização de análises imuno-histoquímicas e moleculares também devem ser tidos em conta. No caso de tumores exóticos (Fig. 1), a remoção de biopsias de fórceps é geralmente suficiente para este fim. Se a ablação de exófitos tumorais para recanálise for planeada ao mesmo tempo, a extracção com a crioproteína é também uma opção, o que proporciona excelentes amostras para o processamento histopatológico. Este tipo de colecção de material também oferece vantagens no caso de crescimento de tumores intramucosos devido à maior profundidade da biópsia. No caso de crescimento submucoso, a aspiração transbrônquica da agulha (TBNA) é geralmente necessária para confirmação histológica. Isto pode ser feito com agulhas TBNA convencionais e flexíveis, mas o ultra-som endobrônquico (EBUS) também pode ser utilizado para a focalização.
Tumor periférico
Há duas vias possíveis de acesso a manifestações tumorais periféricas, que diferem em termos de rendimento e risco de diagnóstico (tab. 1) : A punção transtorácica tem uma alta sensibilidade. Para focos com contacto com a parede torácica, pode ser guiado por ultra-sons na mão do pneumologista. Se houver tecido pulmonar contendo ar entre o foco e a parede torácica, é necessária uma abordagem guiada por TC pelo radiologista. No entanto, devido à lesão necessária da pleura, existe um risco relevante de pneumotórax. A biopsia transbrônquica guiada broncoscopicamente tem menor sensibilidade, especialmente para focos mais pequenos. No entanto, como é feito via naturalis, está também associado a uma taxa significativamente mais baixa de pneumotórax. Portanto, a abordagem broncoscópica deve ser preferida sempre que possível, especialmente porque permite o esclarecimento de outras manifestações de tumores torácicos no mesmo procedimento. Para a escolha individual do método óptimo, é necessário um estudo detalhado da TAC ao tórax na janela pulmonar, prestando especial atenção à relação posicional do foco com a árvore brônquica e à presença de um brônquio de alimentação. Uma alta resolução sob a forma de uma baixa espessura de camada (≤1 mm) é aqui de grande vantagem.

Antes da biópsia transbrônquica, o examinador deve planear mentalmente a via de acesso com a maior precisão possível na TC do tórax. Para poder dirigir os instrumentos de biopsia o mais perifericamente possível, deve ser escolhido um broncoscópio fino (<5 mm). Os fabricantes desenvolveram agora também broncoscópios ultra-finos (≤3 mm) com canal de trabalho suficiente para esta indicação. Além disso, deve prestar-se atenção às indicações indirectas de localização de tumores na área broncoscopicamente visível, tais como vestígios de sangue, fenómenos de compressão e formação de secreções nos óstios.
A sondagem para além da área broncoscópica visível requer a utilização de outro procedimento para a navegação e o direccionamento do instrumento de biópsia. A fluoroscopia de raios X é classicamente utilizada para este fim. Um co-movimento do foco na imagem fluoroscópica no momento da biopsia (“sinal de oscilação”) pode ser uma indicação de realização do alvo. Uma combinação de instrumentos de biopsia (pinça, pincel de citologia, agulha TBNA) pode aumentar o rendimento do diagnóstico. No entanto, a sensibilidade cai rapidamente em proporção ao tamanho do foco periférico (tab. 1).
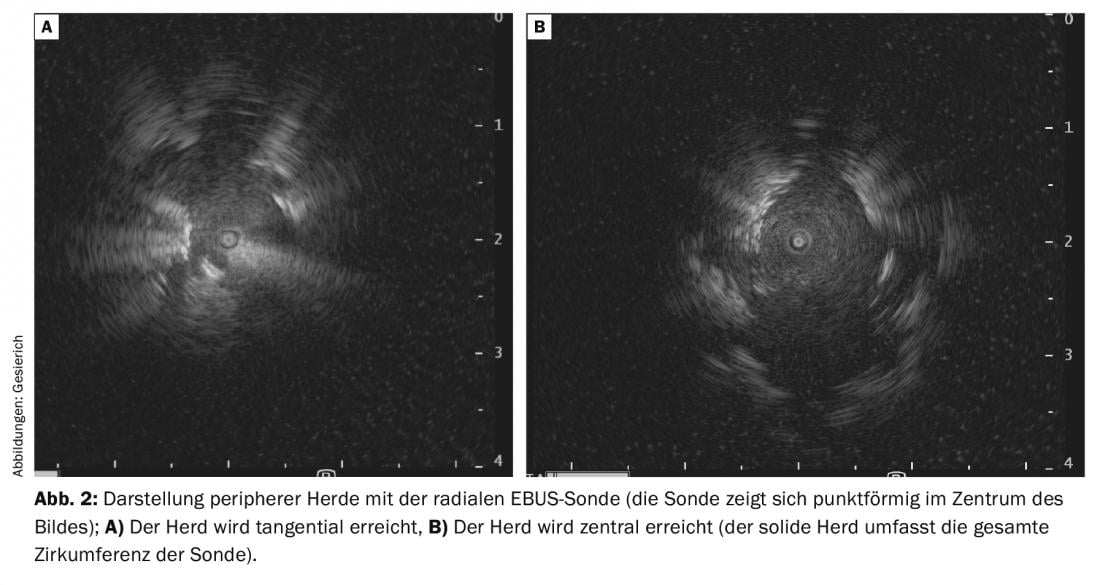
Isto é um incentivo para o desenvolvimento de uma variedade de outras ajudas de navegação [2]. Devido ao seu baixo custo e à poupança de tempo, a sonda de ultra-sons radial (rEBUS) tornou-se a mais amplamente utilizada. Um transdutor rotativo na ponta de uma sonda flexível fornece uma imagem de 360° do ambiente brônquico. No caminho para o foco, é mostrado o típico quadro sonográfico de parênquima pulmonar contendo ar. Quando o foco é alcançado, é demarcado na imagem de ultra-som. Uma posição tangencial no foco deve ser distinguida de uma posição central dentro do foco (exibição de tecido sólido em toda a circunferência da sonda) (Fig. 2A e B) . Esta última situação está associada a um maior rendimento de diagnóstico. O caminho assim encontrado é então traçado com o instrumento de biopsia, utilizando como referência a posição da sonda rEBUS na imagem fluoroscópica. Para facilitar a mira, a sonda também pode ser utilizada para avançar um cateter-guia para o foco, através do qual os instrumentos de biopsia são então inseridos após a sonda ser retirada. Este procedimento permite também a utilização de crioprotectores ultra-finos para biópsia transbrônquica. Isto permite a obtenção de grandes biópsias hemisféricas que, ao contrário de uma biópsia com pinças mais ortogonais, também contêm porções tangenciais do ambiente brônquico. Portanto, este método deve ser considerado especialmente no caso de visualização apenas tangencial do ponto focal periférico no rEBUS.
Um método muito mais dispendioso e demorado é a navegação electromagnética (REM). O paciente encontra-se num campo electromagnético gerado por uma tábua integrada no sofá de exame. A navegação é realizada com uma sonda na ponta da qual são induzidas correntes de indução em bobinas. Estas correntes variam dependendo da posição no campo electromagnético e a sua magnitude permite a localização. A tomografia computorizada do tórax do paciente deve primeiro ser lida no sistema de navegação como um “mapa de estradas”, e a posição da ponta da sonda é então exibida tridimensionalmente na imagem da tomografia computorizada. Também com este método, um cateter-guia é transportado para o foco periférico, através do qual as biópsias podem então ser realizadas. Finalmente, existe a opção da broncoscopia virtual (VB): o software reconstrói uma árvore brônquica virtual a partir do conjunto de dados de uma TC de alta resolução do tórax, através da qual um caminho para o foco periférico pode ser planeado com antecedência, de forma semi-automática. Durante a broncoscopia real com um broncoscópio ultra-fino, há uma comparação contínua, apoiada por software, entre a imagem virtual e endoscópica. Nos pontos da divisão brônquica, o software mostra o subsegmento a ser seleccionado.
Com as ajudas à navegação descritas, é possível alcançar uma sensibilidade de até 70% mesmo com focos periféricos mais pequenos [3]. A acessibilidade técnica de um brônquio continua a ser uma limitação. Portanto, há tentativas experimentais de deixar a árvore brônquica e proceder de forma transparente para o foco periférico (“acesso nódulo transparenquimico broncoscópico”, BTPNA). Numa broncoscopia virtual, um “ponto de entrada” (POE) na parede da via aérea e um caminho através do parênquima para o foco que está o mais livre possível de vasos são planeados com antecedência. Na broncoscopia, a punção é então feita no POE e um trocarte é utilizado para criar um túnel para o foco periférico.
Actualmente, a utilização de sistemas de broncoscopia assistida por robôs pode ser considerada como altamente experimental e provavelmente muito dispendiosa. A “Plataforma Ion” (Intuitive Surgical, Sunnyvale, CA, EUA) consiste num cateter flexível com um canal de trabalho de 2 mm, cuja ponta pode ser angulada em todos os planos em movimentos finamente controlados. Todo o comprimento do cateter é atravessado por uma fibra sensor que fornece feedback sobre a forma e posição. O examinador pode controlar remotamente o sistema através de uma consola usando uma bola de pista e uma roda de rolagem, que é traduzida pelo robô em movimentos precisos e limpos da ponta da sonda. A orientação adicional é semelhante à broncoscopia virtual, com a fibra sensora a fornecer informação adicional para navegação e estabilidade posicional durante a biópsia [4].
Em ligação com a introdução esperada do rastreio do cancro do pulmão, é de esperar um grande número de focos periféricos que requerem esclarecimento, sendo que a maioria destas descobertas será benigna. Também neste contexto, um maior desenvolvimento da instrumentação broncoscópica para sondagem periférica é de saudar, a fim de permitir o esclarecimento mais minimamente invasivo possível destas descobertas.
Em algumas localizações tumorais de difícil acesso para uma biopsia transbrônquica, o acesso pode ser encontrado utilizando a aspiração de agulha transbrônquica através de um broncoscópio de punção por ultra-sons (EBUS-TBNA). Isto aplica-se a tumores paramediastinais de ambos os lobos superiores adjacentes à traqueia e ao esófago, bem como a tumores peribrônquicos e hilares.
Estado do gânglio linfático mediastinal
O estado dos gânglios linfáticos mediastinais é o factor prognóstico mais importante em doentes não metastásicos e um parâmetro decisivo para determinar a operabilidade no cancro do pulmão. A detecção pré-terapêutica mais precisa possível do envolvimento de gânglios linfáticos mediastinais é, portanto, de grande importância para o planeamento terapêutico.
Os métodos de imagem incluindo o PET-CT têm sensibilidade e especificidade insuficientes (Tab. 2). A encenação invasiva é portanto necessária.

Devido ao grande alcance e à elevada sensibilidade e especificidade associadas, bem como ao menor risco, a endosonografia e a aspiração de agulha transbrônquica guiada por ultra-sons (EBUS-TBNA) são agora recomendadas nas directrizes como o método minimamente invasivo de primeira escolha para o estadiamento mediastinal, enquanto as vias de acesso cirúrgico invasivas (mediastinoscopia, video-assistência toracoscópica) receberam o estatuto de reserva para situações pouco claras.
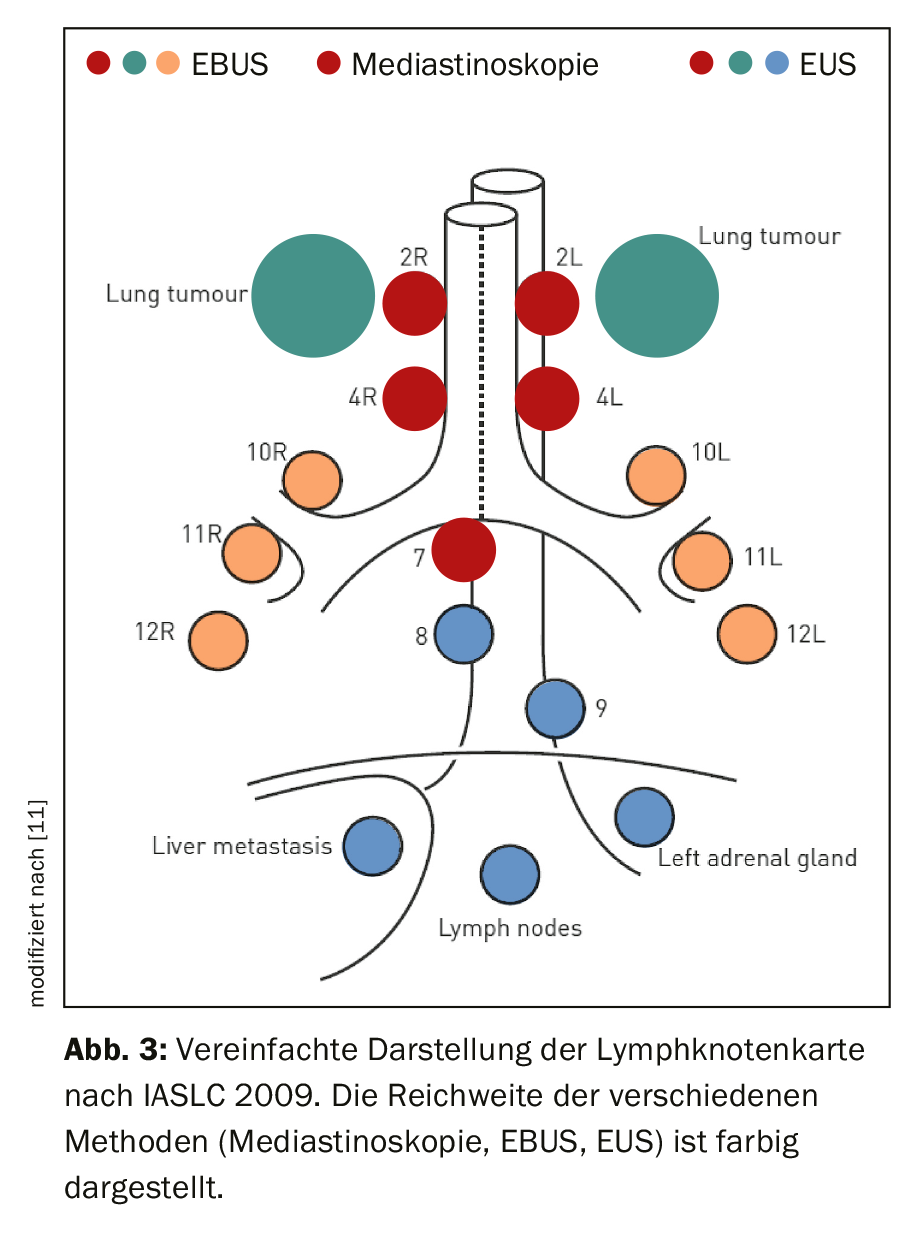
O examinador precisa de um conhecimento detalhado da anatomia dos gânglios linfáticos torácicos. Para este fim, o mapa dos gânglios linfáticos da Associação Internacional para o Estudo do Cancro do Pulmão (IASLC) é utilizado na sua versão proposta em 2009, cujos pormenores podem ser encontrados na publicação correspondente [6,7]. As estações linfonodais individuais são definidas na sua relação topográfica com a árvore traqueobrônquica e os vasos torácicos. A ala 1 corresponde aos gânglios linfáticos supracalviculares e é, portanto, atribuída ao nível N3. As estações 2-9 estão localizadas do cranial ao caudal no mediastino. São atribuídos ao nível N2 no caso de localização de tumores ipsilateral, e ao nível N3 no caso de localização de tumores contralaterais. A estação 10 está localizada no hilo, as estações 11-14 são lobar, segmentar e subsegmentar nos pulmões. Estes pertencem ao nível N1 no caso de um tumor ipsilateral e ao nível N3 no caso de um tumor contralateral. A figura 3 mostra a selecção de estações de gânglios linfáticos endosonograficamente acessíveis. Enquanto a mediastinoscopia cobre apenas os gânglios linfáticos paratraqueal superior e inferior (enfermarias 2 e 4) e os gânglios linfáticos infracarinais (enfermaria 7), a ecografia endobrônquica (EBUS) atinge adicionalmente os gânglios linfáticos hilares (enfermaria 10), interlobares (enfermaria 11) e segmentares (enfermaria 12). Os gânglios linfáticos mediastinais inferiores (alas 8 e 9) também podem ser perfurados através de uma abordagem transoesofágica (ultra-som endoscópico; EUS).
A encenação endosonográfica deve ser completa e sistemática. As directrizes da Sociedade Respiratória Europeia (ERS) recomendam a combinação de EBUS e EUS, se disponível, uma vez que esta é a única forma de alcançar a gama completa de endosonografia [8]. O exame EUS é normalmente realizado com um gastroscópio de ultra-som na mão do gastroenterologista. Mas o broncoscópio de ultra-som (EUS-B) também pode ser inserido através do esófago. Isto requer uma formação adequada do examinador, mas permite o estadiamento endosonográfico completo pelo pneumologista num único procedimento com uma carga e custo do paciente correspondentemente mais baixos. As directrizes recomendam pelo menos uma aspiração de agulha dos gânglios linfáticos paratraqueal inferiores (alas 4R e 4L) e infracarinais (ala 7). Além disso, todas as alas que são radiologicamente e/ou endosonograficamente conspícuas devem ser amostradas. Para a endosonografia, tem sido frequentemente aplicado um limiar de tamanho de 5mm em estudos para este fim. Como EBUS-TBNA é um método citológico, a amostragem deve começar no nível N3 e progredir através do nível N2 até ao nível N1. Um procedimento desviante poderia levar a um aumento de temperatura, transportando células malignas de estações de gânglios linfáticos infestadas de tumores de nível inferior, através da agulha de punção, para recipientes de amostra que são atribuídos a estações de nível superior.
O estadiamento endosonográfico [8] é indicado em todos os casos com mediastino radiologicamente anormal, definido por gânglios linfáticos mediastinais >1 cm em TC e/ou com actividade metabólica em PET. No caso de mediastino radiologicamente inconspícuo, há uma indicação nas seguintes situações: localização central do tumor primário, suspeita radiológica de metástases linfonodais no hilo (situação N1) e um tumor periférico >3 cm. Se a técnica da agulha endoscópica fornecer um resultado positivo, o envolvimento dos gânglios linfáticos pode ser considerado confirmado. Se não forem encontradas células tumorais, não pode ser excluído um resultado falso-negativo. A frequência desta é dada na literatura como até 24% [1]. Se relevante para a decisão de tratamento, esta situação deve ser seguida de estadiamento cirúrgico invasivo (Fig. 4).
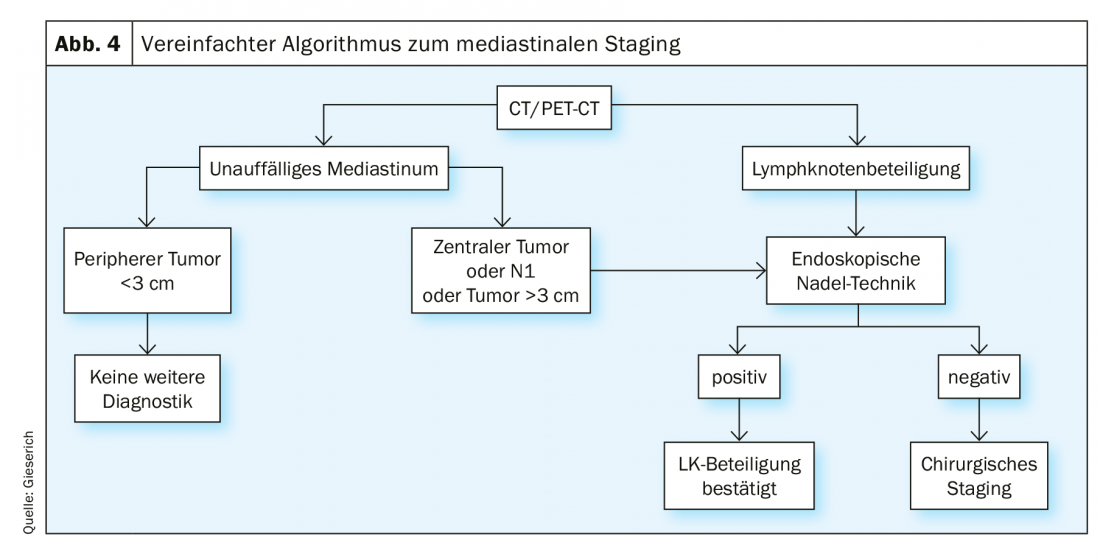
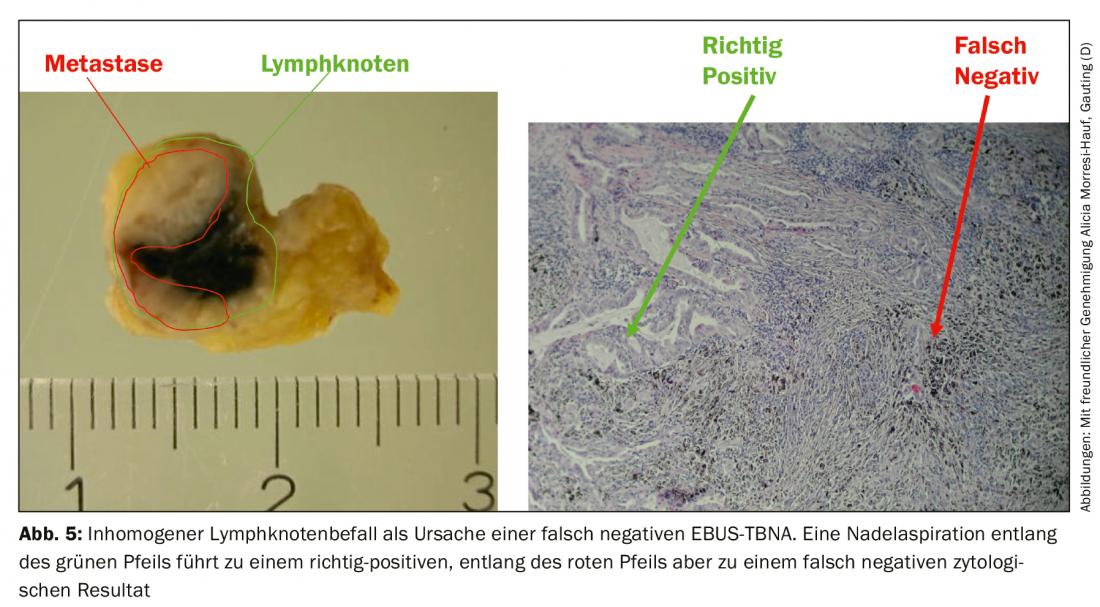
A taxa de falsos negativos resulta do envolvimento de tumores não homogéneos dos gânglios linfáticos, sendo que em casos desfavoráveis a agulha apenas captura parênquima de gânglios linfáticos saudáveis (Fig. 5) . Para além da comparação com os resultados radiológicos, a endosonografia também fornece critérios para uma classificação posterior dos aspirados de agulha negativos. Por um lado, são descritas as características da imagem convencional EBUS que estão associadas à malignidade: Enquanto os gânglios linfáticos benignos tendem a ter uma forma oval com uma borda borrada e hilo vascular típico, os gânglios malignos tendem a assumir uma forma arredondada, a borda torna-se mais acentuadamente delineada, o vaso hilar central pode estar ausente e a textura do eco pode tornar-se não homogénea devido à necrose da coagulação. Por outro lado, a elastografia pode ser utilizada como um método sonográfico ainda experimental. O método representa a deformabilidade (elasticidade) do tecido examinado. Na aplicação torácica, a deformação dos gânglios linfáticos é explorada pela pulsação regular do coração e dos grandes vasos. À semelhança da velocidade do fluxo na sonografia duplex, a deformabilidade é transferida para uma escala de cor e sobreposta à varredura B de ultra-sons. A representação da cor muda de alta para baixa elasticidade de vermelho para amarelo e verde para azul. A previsão de malignidade baseia-se no pressuposto de que o tecido linfonodal perde a sua elasticidade devido à infiltração do carcinoma. Os gânglios linfáticos malignos aparecem, portanto, predominantemente azuis (Fig. 6A), os benignos predominantemente não azuis. O examinador deve declarar estes resultados – se disponíveis – no relatório do exame e trazê-los para a discussão da conferência sobre o tumor.

Em situações em que o tumor primário periférico não é acessível por broncoscopia, as metástases dos gânglios linfáticos mediastinais e hilares podem ser as únicas manifestações tumorais acessíveis. É portanto importante salientar que todos os exames histopatológicos necessários, incluindo análises moleculares, podem ser efectuados sobre os aspirados de agulha obtidos por endosonografia. Isto requer um processamento de amostras de alta qualidade no laboratório de patologia, o que inclui não só preparações de esfregaço mas também a preparação de um bloco celular por centrifugação, enriquecimento do material citológico e incorporação de parafina.
Metástases
As metástases à distância impedem geralmente a terapia curativa. Portanto, em situações radiologicamente pouco claras, há também uma necessidade de clarificação histológica. Enquanto as metástases cerebrais e ósseas têm normalmente de se basear em resultados de imagem, outros sítios metastáticos são mais receptivos à recolha de amostras.
Se um derrame pleural ocorrer no contexto de um carcinoma pulmonar, o primeiro passo é um exame citológico do punção pleural. Dado que a sensibilidade é de apenas cerca de 50%, no caso de citologia negativa e relevância terapêutica, o passo seguinte deve ser uma toracoscopia vídeo-assistida para a exclusão definitiva da carcinomatose pleural.
No caso de lesões que ocupam espaço na glândula adrenal, a sensibilidade e especificidade do diagnóstico por imagem não são suficientes para um diagnóstico definitivo, pelo que a confirmação histológica pode ser desejável, especialmente no caso de metástases isoladas. A via de acesso clássica é a punção transcutânea guiada por CT. O acesso endosonográfico através do tracto gastrointestinal superior permite a punção transgástrica da glândula adrenal esquerda na maioria dos casos; em alguns casos, a glândula adrenal direita também pode ser alcançada transduodenalmente. Isto é normalmente feito nas mãos do gastroenterologista com um gastroscópio de ultra-som. Viabilidade mas ainda experimental é o acesso com o broncoscópio ultra-sónico à glândula adrenal esquerda (Fig. 6B e C), o que por sua vez torna o procedimento acessível ao pneumologista e pode ser realizado na mesma sessão com broncoscopia [9]. Há também relatos de casos individuais na literatura de fixação de metástases hepáticas e metástases nos gânglios linfáticos epigástricos pela mesma via.
Aspectos processuais
Os requisitos descritos para uma broncoscopia moderna para o cancro do pulmão dão uma ideia da complexidade do procedimento. Em princípio, todos os métodos listados são aplicáveis em técnica puramente flexível. As sondagens periféricas difíceis, bem como a encenação endosonográfica abrangente, estão contudo associadas a uma necessidade correspondente de tempo e exigem condições de exame calmas. Uma unidade de broncoscopia moderna deve, portanto, ter a possibilidade de realizar o exame sob anestesia geral. A técnica ideal para isto é a broncoscopia rígida. Se esta não estiver disponível, a máscara laríngea pode ser escolhida como acesso de ventilação. Isto permite a livre circulação dos instrumentos broncoscópicos flexíveis – especialmente o broncoscópio de punção por ultra-sons – na traqueia, de modo a que as estações de gânglios linfáticos paratraqueais também permaneçam acessíveis.
Além disso, são colocadas elevadas exigências às qualificações do examinador. Com o aumento da experiência, o rendimento do diagnóstico aumenta e a taxa de complicação diminui. Para endosonografia, existem simuladores e modelos de órgãos de borracha ou de animais com os quais o estagiário pode dominar a primeira parte da curva de aprendizagem. O passo seguinte consiste em assumir gradualmente o exame do paciente sob supervisão. Uma vez que a curva de aprendizagem pode variar em inclinação de indivíduo para indivíduo e a especificação dos números mínimos de exame é arbitrária, são propostos na literatura [10] testes normalizados e validados para testar a competência do broncologista antes do exame independente.
Mensagens Take-Home
- A broncoscopia é o método de escolha para a confirmação histológica do carcinoma pulmonar. Permite uma avaliação abrangente da situação torácica, incluindo as manifestações tumorais centrais e periféricas, bem como o estado dos gânglios linfáticos mediastinais.
- A criopatia está a ganhar importância crescente tanto como instrumento para biopsia central e transbrônquica como para a recanálise da estenose exofítica das vias aéreas.
- As ajudas à navegação para sondagem de focos periféricos estão em rápido desenvolvimento, desde a simples e barata utilização da sonda ultra-sónica radial, até técnicas mais complexas como a navegação electromagnética e a broncoscopia virtual, passando por abordagens experimentais como o acesso quimérico transparente e a broncoscopia assistida por robótica.
- As estações de gânglios linfáticos torácicos estão divididas em 14 estações de acordo com o mapa IASLC 2009, cuja anatomia o examinador deve dominar.
- Nas directrizes para a encenação mediastinal, as técnicas de agulha guiadas endossonograficamente são agora consideradas os métodos de primeira escolha devido à sua alta sensibilidade e baixa taxa de complicações.
- A gama completa é alcançada através de um acesso combinado através do tracto respiratório (EBUS) e do esófago (EUS). Ambos podem ser feitos num único procedimento com o broncoscópio de ultra-som.
Literatura:
- Rivera MP, Mehta AC: American College of Chest P: Diagnóstico inicial do cancro do pulmão: Directrizes de prática clínica baseadas em evidências ACCP (2ª edição). Peito 2007; 132: 131S-148S.
- Ishiwata T, Gregor A, Inage T, Yasufuku K: Avanços na broncoscopia de diagnóstico intervencionista para lesões pulmonares periféricas. Perito Rev Respir Med 2019; 13: 885-897.
- Wang Memoli JS, Nietert PJ, Silvestri GA: Meta-análise de broncoscopia guiada para a avaliação do nódulo pulmonar. Peito 2012; 142: 385-393.
- Fielding DIK, Bashirzadeh F, Son JH, et al: Primeiro Uso Humano de um Novo Sistema de Navegação por Sensoriamento de Fibra Óptica Robotizada para Pequenos Nódulos Pulmonares Periféricos. Respiração 2019; 98: 142-150.
- Silvestri GA, Gonzalez AV, Jantz MA, et al: Methods for staging non-small cell lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Peito 2013; 143: e211S-250S.
- Rusch VW, Asamura H, Watanabe H, et al: The IASLC lung cancer staging project: a proposal for a new international lymph node map in the forthcoming seventh edition of the TNM classification for lung cancer. J Thorac Oncol 2009; 4: 568-577.
- Tournoy KG, Annema JT, Krasnik M, et al:. Ultra-sonografia endoscópica e endobrônquica de acordo com a definição proposta para o mapa dos gânglios linfáticos na sétima edição da classificação do tumor, nó, metástase para o cancro do pulmão. J Thorac Oncol 2009; 4: 1576-1584.
- Vilmann P, Clementsen PF, Colella S, et al: Combinação de endosonografia endobrônquica e esofágica para o diagnóstico e estadiamento do cancro do pulmão: European Society of Gastrointestinal Endoscopy (ESGE) Guideline, em cooperação com a European Respiratory Society (ERS) e a European Society of Thoracic Surgeons (ESTS). Endoscopia 2015; 47: c1.
- Crombag LM, Annema JT: Análise da glândula adrenal esquerda em doentes com cancro do pulmão utilizando o endobroncópio de ultra-sons: um ensaio de viabilidade. Respiração 2016; 91: 235-240.
- Konge L, Vilmann P, Clementsen P, et al: Avaliação fiável e válida da competência em ecografia endoscópica e aspiração de agulha fina para o estadiamento mediastinal do cancro de pulmão de células não pequenas. Endoscopia 2012; 44: 928-933.
- DOI http://dx.doi.org/10.1055/s-0034-1392040 Publicado online: 0.0. Endoscopia 2015; 47: 545-559 © Georg Thieme Verlag KG Stuttgart – Nova Iorque ISSN 0013-726X
InFo PNEUMOLOGIA & ALERGOLOGIA 2019; 1(3): 6-11.