O Simpósio de Esclerose Múltipla no Inselspital em Berna deu uma visão geral da epidemiologia, etiologia, curso, avaliação e farmacoterapia actual da doença. Existem resultados interessantes da investigação básica, que identificou a citocina GM-CSF como um possível novo alvo terapêutico. O MS Disability Survey está actualmente a analisar ferramentas electrónicas que poderão contribuir para a normalização no futuro. A farmacoterapia continua a ser um campo amplo – o perfil de efeitos secundários é o principal factor na tomada de decisões.
Christian Kamm, MD, Departamento Universitário de Neurologia, Inselspital Bern, fez uma breve introdução à epidemiologia da esclerose múltipla (MS). A EM é uma doença inflamatória crónica do sistema nervoso central (doença auto-imune). Consiste geralmente numa fase inicial com reacções inflamatórias que levam a recaídas. Depois, geralmente após 15-20 anos, segue-se a segunda fase secundária progressiva e degenerativa (em parte ainda sobreposta por recaídas).
Em média, as pessoas afectadas têm cerca de 30 anos (pico de incidência entre os 20 e 40 anos). A prevalência na Europa é de 83:100.000 – tem aumentado nos últimos anos devido à maior esperança de vida das pessoas com EM e aos avanços no diagnóstico. As mulheres são geralmente afectadas um pouco mais cedo (dois a cinco anos) e também mais frequentemente. “A etiologia exacta permanece pouco clara, mas os factores ambientais e genéticos desempenham um papel fundamental”, disse ele. As influências ambientais reflectem-se por vezes na diferente distribuição da doença dependendo da latitude: o risco de EM diminui com a crescente proximidade do equador, o que por vezes é explicado pelo metabolismo da vitamina D [1]. O efeito da substituição da vitamina D permanece pouco claro, mas está actualmente a ser investigado em vários estudos (o estudo SOLAR será concluído em breve).
As comorbilidades vasculares (fumar, etc.) também pioram significativamente o curso. Cada vez mais, o seu número está associado a um maior risco de progressão da deficiência, de passar à fase progressiva secundária, e de progressão e gravidade da doença em geral. As infecções também desempenham um papel importante. Um gatilho bem conhecido para a EM é o vírus Epstein-Barr. As crianças e adolescentes estão particularmente em risco devido a factores de risco ambiental. Aqueles que contraem febre glandular no final da adolescência têm um risco mais elevado de EM.
A componente genética reflecte-se por vezes no facto de os familiares de um doente terem mais probabilidades de desenvolver a doença do que a população em geral (o risco relativo em familiares de primeiro grau é de cerca de 9,2). Há correlações com o chamado antigénio leucocitário humano (HLA). Estudos populacionais também demonstraram que a incidência de doenças também difere entre as etnias expostas a influências ambientais comparáveis.
GM-CSF como um novo alvo terapêutico?
Prof. Dr. rer. nat. Burkhard Becher, Institute for Experimental Immunology, Universidade de Zurique, abordou, entre outras coisas, o papel da citocina GM-CSF pró-inflamatória. Isto é essencial para o desenvolvimento da EM em ratos. Para clarificar o papel do FMCG na patogénese da EM humana, foi analisado o sangue de doentes com EM ou de dadores saudáveis, isolados os glóbulos brancos e analisadas as citocinas produzidas. Os estudos ilustram que o número de células T produtoras de GM-CSF está muito aumentado em doentes com EM. E: quanto mais grave for a actividade da doença, mais células produzem GM-CSF. Isto é induzido pela interleucina 2 (IL-2), o que por sua vez torna o receptor de IL-2 um gene de risco de EM. Foi demonstrado que doadores saudáveis com este gene de risco (polimorfismo no gene receptor IL-2-α) têm mais células T produtoras de GM-CSF do que doadores com o gene sem risco [2]. Mas como pode esta descoberta ser transferida para a clínica? “Por exemplo, com um anticorpo contra o GM-CSF como o MOR103 [3]”, explicou o Prof. Becher. “O futuro mostrará se estamos a lidar aqui com um novo candidato à terapia da EM”.
Deficiências em EM – como medir?
As deficiências no mestrado foram o tema da palestra do Dr. Christian Kamm, Clínica Universitária de Neurologia, Inselspital Bern. A chamada “nenhuma evidência de actividade da doença” (NEDA) é actualmente definida por três parâmetros: ausência de recidivas, ausência de progressão do EDSS, ausência de actividade de ressonância magnética. A integração dos factores “atrofia cerebral” e “cognição” neste conceito é por vezes discutida. A Escala Alargada de Estado de Deficiência (EDSS) continua a ser o padrão de ouro para a medição da deficiência em EM (normalizada electronicamente em neurostatus.net). A gravidade da deficiência é avaliada em sete sistemas funcionais (visual, tronco cerebral, piramidal, cerebelo, sensorium, intestino/bexiga, função mental). Além disso, há informações sobre a capacidade de andar a pé. A escala começa em 0 e vai até 10. As insuficiências do EDSS são: Variabilidade no exame neurológico, na percepção do examinador e limitações naturais da percepção humana. Ferramentas de avaliação digital (por exemplo, com a câmara Kinect®) estão actualmente a ser testadas, que poderiam ser utilizadas para avaliar as funções motoras nos EM de forma mais precisa e normalizada no futuro (projecto ASSESS-MS).
A partir de um valor de 4,5, o EDSS quase só tem em conta a distância percorrida a pé e, portanto, tem certas limitações que podem ser remediadas por testes adicionais. A capacidade funcional das extremidades superiores, por exemplo, deve ser testada separadamente, uma vez que é cada vez mais limitada no EDSS avançado. O chamado teste de nove pinos (9HPT) testa quanto tempo leva o paciente a colocar nove pinos em orifícios designados e depois retirá-los novamente. De acordo com o orador, este teste é fiável, válido e suficientemente sensível para avaliar a destreza manual em doentes com EM. Os dados normais existem de acordo com a idade, o sexo e a destra ou a canhota [4]. Enquanto a 9HPT ainda requer vários utensílios, a tarefa de Rotação de Moedas (CRT) desenvolvida em Berna requer apenas uma moeda de 50 cêntimos. Aqui, os pacientes têm de rodar a moeda o mais rápido possível entre polegar, índice e dedo médio (mais de 19 s para 20 meias reversões é patológico) [5]. “A CRT é comparável à 9HPT e ao Action Research Arm Test (ARAT), mas já não é igualmente viável para um EDSS de cerca de 7”, explicou o Dr. Kamm.
O reconhecimento está também subrepresentado no EDSS, embora deficiências como a memória, atenção ou défices de concentração estejam entre os principais sintomas da EM (prevalência 43-65%). O Symbol Digit Modalities Test (SDMT) pode ser considerado como um suplemento prático [6].
Estado da farmacoterapia
Uma visão geral da terapêutica da RM é dada nas tabelas 1 e 2. De acordo com o Prof. Dr. Heinrich Mattle, Clínica Universitária de Neurologia, Inselspital Bern, estudos controlados aleatorizados mostram que as lesões por RM são o principal motor dos défices neurológicos – pelo que devem ser prevenidas terapeuticamente. Na EM recorrente-remitente, as lesões são inicialmente encontradas principalmente na matéria branca, e na forma progressiva secundária cada vez mais também na matéria cinzenta [7]. Isto é então crucial para a deficiência a longo prazo, como o Prof. Nicola De Stefano, MD, Universidade de Siena, esclareceu na sua palestra anterior [8].
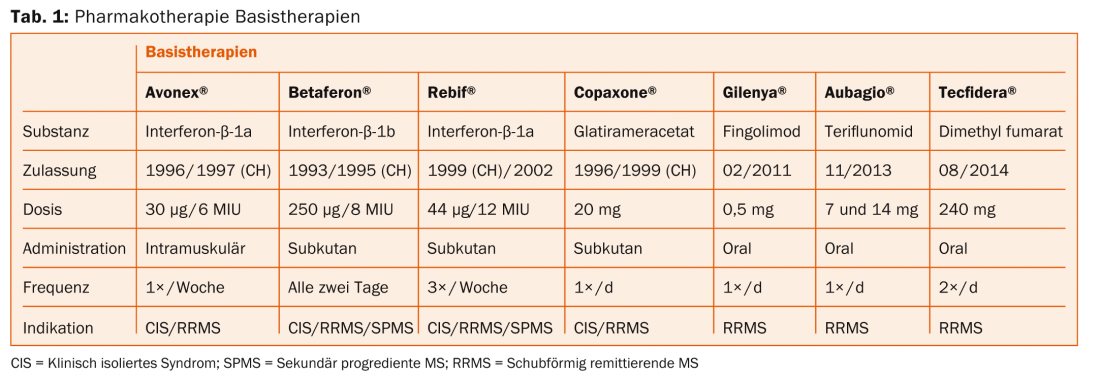
“A terapia deve assim ter lugar o mais cedo possível para melhorar o resultado a longo prazo. Mas o princípio de “Primum nihil nocere” (“Primeiro não fazer mal”) também se aplica, ou seja, encontrar o equilíbrio óptimo entre efeito e efeitos secundários”, explicou o Prof.
Drogas injectáveis (Betaferon®, Rebif®, Avonex®, Copaxone®): Necessita de injecções regulares. Possíveis efeitos secundários são reacções cutâneas ou sistémicas. No entanto, não há efeitos secundários graves a longo prazo. “Ainda não conhecemos os efeitos dos novos medicamentos após 20 anos. É aqui que os agentes injectáveis são mais bem pesquisados”, sublinhou o Prof. Mattle. Num futuro próximo, o pegylated β-interferon (peginterferon-β-1a) também chegará ao mercado suíço (estudo ADVANCE [9]), que precisa de ser injectado com menos frequência do que as outras substâncias activas.
Fingolimod (Gilenya®): A administração é oral, uma vez por dia. O ingrediente activo pode causar efeitos secundários cardíacos (monitorização necessária na primeira administração). Também é possível o edema macular e infecções pelo vírus do herpes, mas raras. A droga está contra-indicada na gravidez. Para os doentes em risco de tumores de pele malignos, aconselha-se precaução ou monitorização dermatológica regular (embora as preocupações a este respeito não estejam claramente estabelecidas).
Teriflunomida (Aubagio®): A administração é oral, uma vez por dia. Na primeira metade do ano, a monitorização das enzimas hepáticas é necessária a cada duas semanas, após o que oito semanas de monitorização é suficiente. Possíveis efeitos secundários são náuseas, diarreia e alopecia. Um método contraceptivo fiável é um pré-requisito para a terapia.
Fumarato de dimetilo (Tecfidera®): O ingrediente activo é administrado oralmente duas vezes por dia (o que pode limitar a aderência). As análises ao sangue devem ser feitas antes do início do tratamento, após três e seis meses e depois a cada seis a doze meses. Possíveis efeitos secundários incluem ruborização, dor abdominal e diarreia. Também aqui, a contracepção é um pré-requisito.
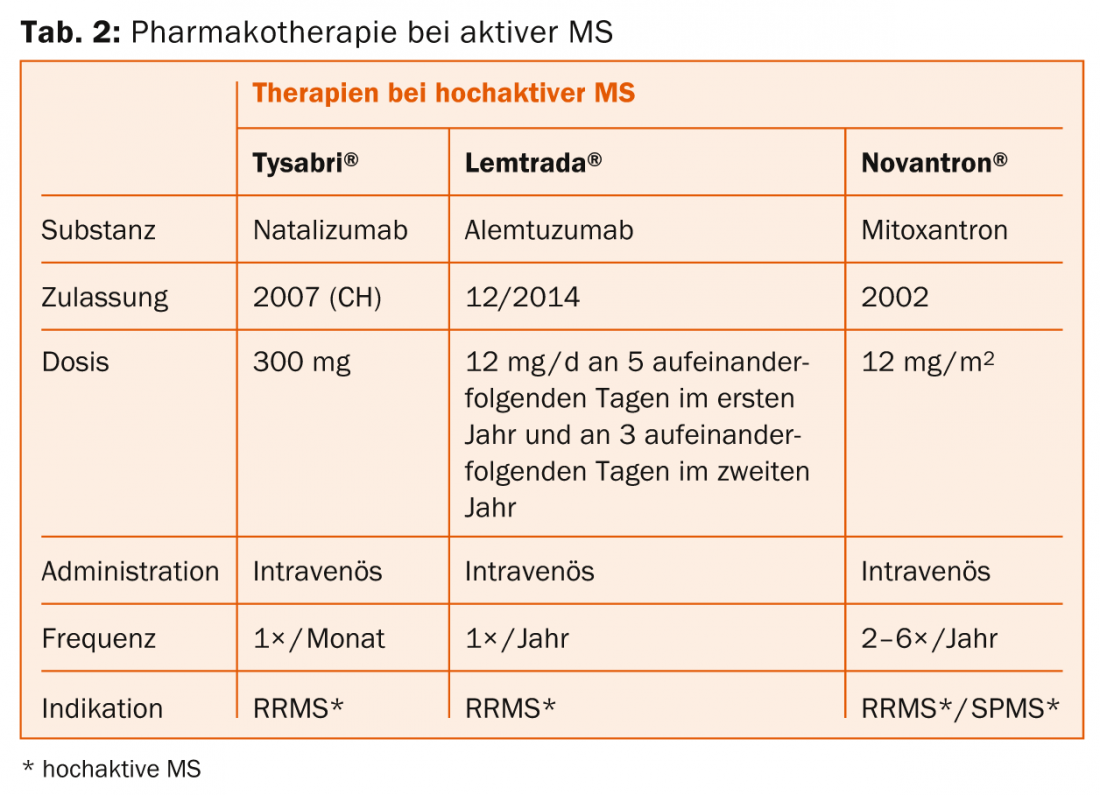
Natalizumab (Tysabri®): A substância activa é convenientemente administrada uma vez por mês por infusão. Um risco importante é a leucoencefalopatia multifocal progressiva (LPM) em doentes com vírus JC, razão pela qual é necessária a detecção de anticorpos.
Alemtuzumab (Lemtrada®): A substância activa é convenientemente administrada duas vezes em dois anos por série de infusão. Podem ocorrer reacções infusivas graves. Também vale a pena mencionar o risco de desenvolver outras doenças auto-imunes (incluindo a tiróide ou o rim) ou trombocitopenia imunitária.
Aplicação na prática
Na altura do evento (Janeiro de 2015), Berna tinha o seguinte regime de tratamento para a EM recorrente-remitente:
Primeira linha: Dependendo dos efeitos secundários e da actividade da doença, utiliza-se interferon-β, acetato de glatiramer, teriflunomida, fumarato de dimetilo ou dedilimod. Para EM altamente activa, o natalizumab e o alemtuzumab podem ser considerados.
Segunda linha: Se existir actividade, é feita uma escolha entre fumarato de dimetilo, fingolimod, natalizumab ou alemtuzumab (possivelmente também mitoxantrone).
Terceira linha: Natalizumab e alemtuzumab (possivelmente também mitoxantrone) estão inicialmente disponíveis aqui. Os medicamentos que não são aprovados na Suíça para esta indicação, tais como rituximab ou daclizumab, ou transplante de células estaminais autólogas, são procedimentos experimentais (também para formas altamente activas).
Há mais dados para a EM progressiva secundária do que para a forma degenerativa primária, mas em geral a situação da investigação é pior do que para a EM recorrente-remitente. Rebif® demonstrou ser mais eficaz contra a EM progressiva secundária nos doentes que ainda experimentam recaídas clínicas [10]. Betaferon® também beneficia os doentes com actividade recidivante e progressão significativa da incapacidade (alteração EDSS >1, dois anos antes da entrada no estudo) o mais [11].
Sativex® pode ser utilizado para terapia sintomática. É utilizado para a melhoria dos sintomas em doentes com espasticidade moderada a grave.
Fonte: Multiple Sclerosis Symposium, 8 de Janeiro de 2015, Berna
Literatura:
- Ascherio A, et al: Vitamina D como preditor precoce da actividade e progressão da esclerose múltipla. JAMA Neurol 2014 Mar; 71(3): 306-314.
- Hartmann FJ, et al: O polimorfismo IL2RA associado à esclerose múltipla controla a produção de GM-CSF em células TH humanas. Nat Commun 2014 Oct 3; 5: 5056. doi: 10.1038/ncomms6056.
- Korolkiewicz RP, et al: Estudo de Fase Ib para Avaliar MOR103 em Esclerose Múltipla. NCT01517282. Em linha em: https://clinicaltrials.gov/ct2/show/study/NCT01517282.
- Oxford Grice K, et al: Normas para adultos para um Teste de Pega de Nove Buracos comercialmente disponível para destreza dos dedos. Am J Occup Ther 2003 Set-Out; 57(5): 570-573.
- Heldner MR, et al: Tarefa de rotação de moedas: um teste válido para destreza manual em esclerose múltipla. Phys Ther 2014 Nov; 94(11): 1644-1651.
- Van Schependom J, et al: The Symbol Digit Modalities Test as sentinel test for cognitive impairment in multiple sclerosis. Eur J Neurol 2014 Set; 21(9): 1219-1225, e71-72.
- Kutzelnigg A, et al: Desmielinização cortical e lesões difusas de matéria branca na esclerose múltipla. Cérebro 2005 Nov; 128(Pt 11): 2705-2712.
- Filippi M, et al: Os danos causados pela matéria cinzenta prevêem a acumulação de incapacidade 13 anos mais tarde na EM. Neurologia 2013 12 de Novembro; 81(20): 1759-1767.
- Calabresi PA, et al: Pegylated interferon β-1a para a esclerose múltipla recorrente-remitente (ADVANCE): um estudo aleatório, fase 3, duplo-cego. Lancet Neurol 2014 Jul; 13(7): 657-665.
- Grupo de Estudo Eficácia Secundária Progressiva de Interferon-Beta-1a em EM (SPECTRIMS): Ensaio clínico randomizado controlado de interferon- beta-1a em EM secundária progressiva: Resultados clínicos. Neurologia 2001 Jun 12; 56(11): 1496-1504.
- Kappos L, et al: Interferon beta-1b em EM progressiva secundária: uma análise combinada das duas experiências. Neurologia 2004 Nov 23; 63(10): 1779-1787.
InFo NEUROLOGIA & PSYCHIATRY 2015; 13(2): 36-39