O espectro de agentes sistémicos aprovados para o tratamento de dermatite atópica moderada a grave expandiu-se no passado recente, de modo que existe agora uma escolha de vários biólogos e inibidores de Janus kinase. O alívio da coceira é um objectivo de tratamento chave para os afectados – o que se sabe sobre o efeito antiprurítico da nova terapêutica sistémica? Esta questão é discutida numa mini-revista recentemente publicada no Journal of the Dermatological Society.
A primeira autora da publicação é Hanna Bonnekoh, MD, do Departamento de Dermatologia, Venereologia e Alergologia, Charité Universitätsmedizin Berlin [1]. A importância do conhecimento sobre os efeitos dos novos medicamentos na melhoria do prurido é demonstrada, entre outras coisas, por um inquérito recentemente publicado a 1104 pacientes com dermatite atópica: o prurido foi considerado muito importante para avaliar a eficácia de um tratamento em 95,4% dos pacientes [2]. Nos ensaios clínicos de dermatite atópica, os parâmetros de coceira são geralmente relatados utilizando parâmetros normalizados, o que permite comparar substâncias activas em termos dos seus efeitos sobre a coceira.
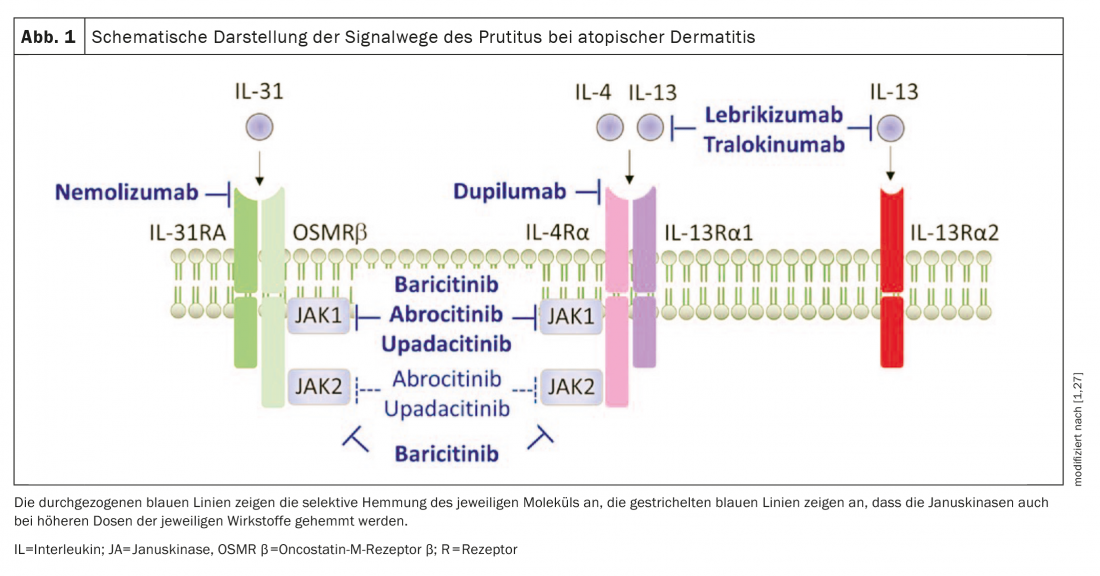
Globalmente, todos os estudos incluídos na revisão de Bonnekoh et al. 2022 novos medicamentos para a dermatite atópica (Fig. 1) mostraram dados promissores na melhoria da coceira.
Qual é o estado actual dos conhecimentos?
O sofrimento das pessoas afectadas é elevado; entre outras coisas, muitos queixam-se de perturbações do sono relacionadas com comichão [11–13]. Para além de um rápido início de acção, a redução global da comichão durante todo o período de tratamento é também de grande importância para os doentes com neurodermatite, tal como demonstrado por Bonnekoh et al. sublinhar [1]. Segue-se um resumo das modernas terapias sistémicas actualmente aprovadas pela EMA e pelo Swissmedic para o tratamento da dermatite atópica moderada a grave.

Dupilumab: A imunoglobulina (Ig)-G4κ monoclonal Dupilumab (Dupixent®), inibe a sinalização da IL-4 e IL-13 através da inibição da IL-4Rα. Uma análise recente de quatro ensaios clínicos fase III randomizados analisou os efeitos do dupilumabe no prurido em doentes com dermatite atópica moderada a grave. Isto mostrou que o tratamento com dupilumab levou a uma melhoria rápida e estatisticamente significativa da coceira mais grave (mudança percentual na escala de classificação numérica, NRS) em comparação com placebo, logo no dia 2 em adultos e no dia 5 em doentes adolescentes. Além disso, foi observada uma rápida melhoria (definida como a proporção de pacientes com pelo menos 3 pontos de melhoria em relação à linha de base) na coceira a partir do dia 4 em adultos e a partir do dia 13 em adolescentes. Além disso, ao longo dos respectivos estudos, a intensidade da comichão foi significativamente reduzida em todos os estudos em comparação com o placebo e mostrou uma diminuição progressiva ao longo do tempo [3].
Tralokinumab: O tralokinumab humano recombinante anti-IL-13 [34] monoclonal anti-corpo tralokinumab (Adtralza®) impede a ligação da IL-13 à IL-13Rα1 e à IL-13Rα2 e foi recentemente aprovado na Suíça para adultos com dermatite atópica moderada a grave IgG4λ . Os resultados dos ensaios da fase III do tralokinumabe como monoterapia (ECZETRA1 e 2) e em combinação com o tratamento tópico com corticosteróides (ECZETRA 3) em doentes com dermatite atópica moderada a grave foram muito convincentes. Na semana 16, uma proporção mais elevada de doentes tratados com tralokinumabe alcançou uma redução na média semanal do pior prurido diário (NRS ≥4) em comparação com a linha de base na comparação de placebo. Além disso, o tratamento com tralokinumab mostrou maiores alterações em relação à linha de base no pior prurido NRS diário em comparação com o grupo placebo, com uma diferença significativa em relação à semana de tratamento 1 [4,5].
Baricitinib: O inibidor oral JAK baricitinib (Olumiant®) tem uma especificidade igualmente elevada para o JAK-1 e -2 e uma especificidade inferior para o Tyk-2 [21,34]. Em combinação com o tópico
corticosteróides (TCS), uma redução significativa da comichão (NRS média em comparação com a linha de base) foi alcançada logo no segundo dia com tratamento diário com 2 mg ou 4 mg de baricitinibe. Na semana 16, uma proporção significativamente mais elevada de pacientes no ramo de tratamento (44% no grupo de 4 mg, 38% no grupo de 2 mg) mostrou uma melhoria clinicamente significativa na coceira (definida como mudança em relação à linha de base do NRS ≥4) em comparação com o grupo de placebo (20%) [6,7].
Upadacitinib: Upadacitinib (Rinvoq®), outra pequena molécula, é um inibidor oral de JAK-1 [8,9,34]. A monoterapia com 15 mg ou 30 mg (1×/d cada) resultou numa melhoria significativa do prurido na semana 16 em comparação com placebo, bem como numa redução significativa do prurido em comparação com a linha de base (NRS ≥4) [10]. Upadacitinib também foi convincente quando combinado com TCS num estudo de fase III.
|
A patogénese do prurido permanece um mistério Até à data, o mecanismo exacto subjacente ao prurido na dermatite atópica (AD) ainda não foi completamente elucidado. Provas recentes sugerem que os pruritogénicos independentes da histamina estão envolvidos no desenvolvimento da comichão crónica [28,29]. Além da interleucina-31 – uma citocina produzida predominantemente por células Th2 que causa prurido através de um complexo receptor expresso em fibras C – IL-13 e IL-4 são citocinas específicas Th2 que se pensa estarem envolvidas na patogénese da AD e na sintomatologia do prurido. Outros pruritogénios associados à comichão na AD incluem histamina, triptase, IL-33 e tímica linfotopoietina (TSLP) – mas a sua relevância clínica para desencadear a comichão na AD ainda não é clara [30]. |
Estão a ser preparadas outras substâncias activas
Bonnekoh et al. 2022 também abordam os agentes sistémicos que ainda estavam em desenvolvimento na altura da sua revisão. Para além do agora aprovado inibidor JAK abrocitinib, os anticorpos monoclonais lebrikizumab e nemolizumab são descritos em termos dos seus efeitos sobre as características do prurido [1,34]. Os autores salientam que a sua revisão não discute abordagens inovadoras de tratamento tópico como o inibidor de tirosina kinase 2 (TYK2) brepocitinib ou o agente modulador do receptor de hidrocarbonetos arilo tapinarof [25,26].
Ainda não é a última palavra em sabedoria
O circuito itch-scratch é o fim de uma cascata de interacções complexas entre factores ambientais e de exposição [14,32,33], o microbioma cutâneo [15–19], a barreira epidérmica [20,21], e as respostas imunitárias e inflamatórias [31]. Estes processos desenvolvem-se contra um fundo epigenético particular e ainda pouco estudado [22]. Se são factores directamente associados à inflamação que contribuem para o patomecanismo e severidade do prurido ou se estão envolvidos outros factores, ainda não foi esclarecido. Embora se tenha observado que a comichão na dermatite atópica moderada e grave está intimamente associada à gravidade da dermatite atópica, muitos doentes com dermatite atópica referem prurido que não está confinado à pele lesional e alguns doentes com dermatite atópica ligeira sofrem de comichão grave [11,23,24].
Literatura:
- Bonnekoh H, Butze M, Metz M: JDDG 2022; 20(2): 150-156.
- Kobyletzki LB, et al: Acta Derm Venereol 2017; 97(1): 86-90
- Silverberg JI, et al: J Am Acad Dermatol 2020; 82(6): 1328-1336.
- Wollenberg A, et al: Br J Dermatol 2021; 184(3): 437-449.
- Silverberg JI, et al: Br J Dermatol 2021; 184(3): 450-463.
- Simpson EL, et al: Br J Dermatol 2020; 183(2): 242-255.
- Reich K, et al: JAMA Dermatol 2020; 156(12): 1333-1343.
- Guttman-Yassky E, et al: Lancet 2021; 397(10290): 2151-2168.
- Reich K, et al: Lancet 2021; 397(10290): 2169-2181.
- Bieber T: Nature Reviews Drug Discovery 2022; 21(1): 21-40.
- Huet F, et al: Acta Derm Venereol 2019; 99(3): 279-283.
- Kage P, Simon JC, Treudler R: J Dtsch Dermatol Ges 2020; 18(2): 93-102.
- Stand S: N Engl J Med 2021; 384(12): 1136-1143.
- Mack MR, Kim BS:Trends Immunol 2018; 39: 980-991.
- Byrd AL, Belkaid Y, Segre JA: Nature Reviews Drug Discovery 2018; 16: 143-155.
- Meisel JS, et al: Microbioma 2018; 6: 20.
- Kong HH, et al: Genome Res 2012; 22: 850-859.
- Shi B, et al: J. Allergy Clin Immuno 2016; 138: 1233-1236.
- Williams MR, et al: Sci. Transl Med 2019;11:eaat8329.
- Kim BE, Leung DY: Allergy Asthma Immunol Res 2012; 4: 12-16.
- Rerknimitr P, et al: Inflamação e Regeneração 2017; 37: 14.
- Marenholz I, et al: Nature Communications 2015; 6: 8804.
- Hawro T, et al: J Am Acad Dermatol 2021; 84(3): 691-700.
- Chovatiya R, et al: Ann Allergy Asthma Immunol 2021; 127(1): 83-90e2.
- Jo CE, Gooderham M, Beecker J: Int J Dermatol 2022; 61(2): 139-147.
- Paller AS, et al: J Am Acad Dermatol 2021; 84(3): 632-638.
- Med ChemExpress, www.medchemexpress.com/lab-consumables-gift.html (último acesso 27.05.2022)
- Dillon SR, et al: Nature Immunology 2004; 5(7): 752-760.
- Zheng T, et al: J Invest Dermatol 2009; 129(3): 742-751
- Langan SM, Irvine AD, Weidinger S: Lancet 2020; 396(10247): 345-360.
- Weidinger S, et al: Dermatite atópica. Nature Reviews Nature Disease Primers 2018; 4: 1.
- Gilles S, et al: Experimental Dermatology 2018; 27: 1193-1200.
- Stefanovic N, Flohr C, Irvine AD: Alergia 2020; 75: 63-74.
- Informação sobre drogas, www.swissmedicinfo.ch, (último acesso 12.06.2022)
PRÁTICA DA DERMATOLOGIA 2022; 32(3): 22-23