A selecção da terapia apropriada e os pensos para feridas de ajuste óptimo são factores decisivos no processo de cicatrização. A consideração do microambiente individual da ferida desempenha um papel importante, como mostram os resultados actuais.
Em contraste com outras especialidades da medicina, existe uma base de provas relativamente pequena no campo da investigação de feridas, que deverá mudar no futuro. As sinergias entre a prática clínica e a investigação científica são particularmente importantes nesta área. A Prof. Dra. med. Ewa K. Stürmer, chefe do Instituto de Investigação Translacional de Feridas da Universidade de Witten/Herdecke (D) [1], falou sobre os resultados actuais neste campo no Congresso de Feridas de Nuremberga de 2019.
Biofilme: O que é possível no ambiente ambulatorial?
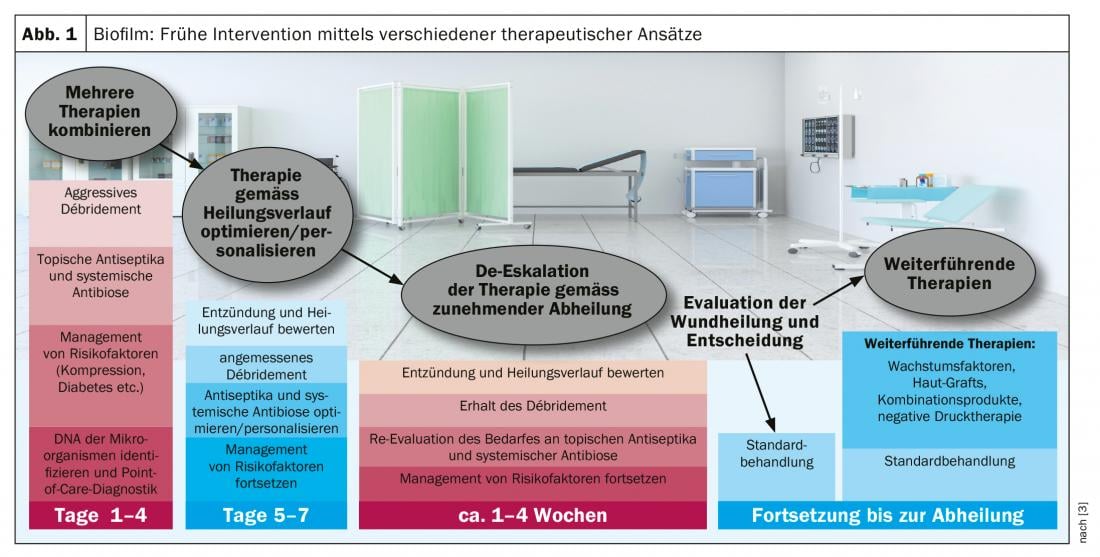
Em 78% de todas as feridas crónicas, forma-se um biofilme (caixa) com efeitos potencialmente negativos na cicatrização de feridas [2]. Que o ambiente da ferida é um factor central para o desempenho antimicrobiano no contexto da terapia de biofilme é uma das descobertas actuais neste campo [2]. Só o desbridamento mecânico pode limpar completamente um biofilme. No entanto, o tratamento ambulatório de feridas pode reduzir a carga microbiana, o que evita que o biofilme se transforme em infecção (Fig. 1) . Os métodos comprovados para isto são: limpeza intensiva e NaCl, soluções de irrigação de feridas, desinfecção por pulverização, cura anti-séptica de feridas. Em geral, os seguintes princípios aplicam-se ao cuidado da margem da ferida e área circundante: os antimicrobianos tendem a ter um efeito anti-proliferativo; o edema deve ser respeitado, a hidratação da pele deve ser assegurada e os cuidados básicos devem ser prestados. Um biofilme não causa per se uma infecção e pode também estar numa ferida que não parece infectada. A margem da ferida é frequentemente afectada pelo biofilme. Isto pode ser tornado visível por meio de medição de fluorescência, uma vez que as bactérias têm uma fluorescência intrínseca e quando irradiadas com luz UV, a colonização bacteriana é corada a uma concentração >104/m2. O orador ilustra isto com o estudo de caso de uma úlcera do pé diabético. “Neste momento, o melhor e único tratamento de escolha para a remoção do biofilme é a remoção mecânica utilizando uma cureta ou bisturi” [1]. Esta é também a conclusão das actuais recomendações de consenso [3].
Redes de feridas hidrofóbicas e pensos inteligentes para feridas
“As malhas de feridas hidrofóbicas não são apenas económicas, mas também suaves nas células” [1]. Para uma ferida infectada localmente, o orador recomenda mudar para uma rede de feridas hidrofóbicas após 7-10 dias de curativos antimicrobianos e soluções de irrigação de feridas. O mecanismo de acção baseia-se, entre outras coisas, na estrutura desta rede de feridas, que tem uma influência favorável na absorção de bactérias.
O tema das tecnologias de feridas inteligentes é discutido de forma controversa. Por um lado, a indústria já oferece produtos correspondentes através dos quais, por exemplo, o valor ph, a temperatura e a hipoxia podem ser medidos. Por outro lado, a questão do que fazer com base nesta informação é outra dimensão. O orador salienta que ainda existe uma grande lacuna a este respeito. Identificar que tratamento é indicado para que ferida e que materiais e métodos são benéficos ou não para o processo de cura é uma questão central que é tratada a um nível diferente. Talvez haja também outras sinergias entre estas áreas no futuro.
| Biofilme O biofilme é uma comunidade estruturada de micróbios com diversidade genética e expressão genética variável que cria comportamentos e mecanismos de defesa que levam à produção de infecções únicas (crónicas) com tolerância significativa a antibióticos e antimicrobianos, ao mesmo tempo que protege contra a imunidade do hospedeiro [1]. |
Importância da prata na terapia antisséptica
A prata está contida em numerosos produtos de tratamento de feridas e, segundo uma meta-análise recente [4], quando utilizada de forma direccionada e limitada no tempo, há provas de uma melhoria na qualidade de vida, bem como de uma boa relação custo-eficácia, para além dos efeitos antimicrobianos. Uma indicação correcta e uma duração terapêutica de um máximo de 14 dias são decisivos [4]. Uma resistência à prata clinicamente relevante não pôde ser provada [5]. A conclusão de um artigo publicado em 2019 é que não há actualmente provas de que a resistência à prata constitua uma séria ameaça para a saúde [5]. A fim de se poder fazer afirmações mais claras sobre isto e determinar a quantidade de prata necessária para um efeito terapêutico óptimo, são necessários mais estudos.
Fonte: Wound Congress Nuremberga (D)
Literatura:
- Stürmer EK: Colonização de feridas, infecção ou alergia? Como reconhecer e tratar? Prof. Dr. med. Ewa K. Stürmer, Institute for Translational Wound Research, Universidade de Witten/Herdecke (D), apresentação de slides, Congresso de Feridas de Nuremberga 06.12.2019.
- Hülsbömer LF, Rembe JD, Besser M, Stürmer EK: Avaliação quantitativa e qualitativa da eficácia anti-biofilme de substâncias antimicrobianas e anti-sépticas modernas num novo modelo de biofilme bacteriano in vitro (hpBIOM). Contribuição FV37, Congresso de Feridas de Nuremberga, 07.12.2019.
- Schultz G, et al: (para o Painel Global de Peritos em Biofilme de Feridas): Directrizes consensuais para a identificação e tratamento de biofilmes em feridas crónicas não cicatrizantes. Reparação e Regeneração de Feridas 2017; 25 (5): 744-757.
- Dissemond J, et al: Evidência de prata no tratamento de feridas – meta-análise de estudos clínicos de 2000-2015. J Dtsch Dermatol Ges 2017; 15(5): 524-535.
- Percival SL, Salisbury AM, Chen R: Prata, biofilmes e feridas: resistência revisitada. Critério Rev Microbiol 2019; 45(2): 223-237.
HAUSARZT PRAXIS 2020; 15(1): 28-30 (publicado 25.1.20, antes da impressão).