Entre outras coisas, foram apresentadas novas descobertas sobre a terapia do linfoma difuso de grandes células B. O ensaio FLYER fase III comparou a terapia padrão (6xR-CHOP) com o tratamento reduzido em dois ciclos de quimioterapia. Outro estudo conseguiu desenvolver um novo método genético molecular como base para uma estratégia terapêutica personalizada.
O linfoma difuso de grandes células B (DLBCL) é o linfoma não-Hodgkin mais comum em todo o mundo e pertence aos chamados linfomas agressivos não-Hodgkin. A terapia padrão até agora é a imunochemoterapia 6xR-CHOP. 6xR-CHOP combina anticorpos monoclonais (R) com drogas citostáticas (CHOP) em seis ciclos [1]. A base empírica para este regime de tratamento provém do ensaio MINT [3]. Em pacientes com um índice prognóstico ajustado à idade (aaIPI) de 0 e sem massa tumoral, seis ciclos de terapia resultaram numa EFS de 3 anos de 89% e uma PFS de 3 anos de 95%, e uma OS de 3 anos de 98% [3].
No ensaio FLYER, foi demonstrado que dois ciclos de quimioterapia podem ser omitidos sem ter um efeito negativo sobre o curso da doença. Uma duração mais curta da quimioterapia significa que os pacientes podem regressar a uma rotina diária normal e trabalhar mais rapidamente, como explica o primeiro autor do estudo, a Dra. Viola Poeschel, Faculdade de Medicina da Universidade de Saarland em Homburg/Saar (Alemanha) [1].
Estudo multicêntrico FLYER: redução da quimioterapia sem efeitos negativos
O estudo internacional multicêntrico prospectivo FLYER (n=588) investigou como uma redução dos ciclos de tratamento citostático da terapia padrão afecta parâmetros relevantes para a doença. Para este fim, 6xR-CHOP (n=295) foi comparado durante um período de onze anos (2005-2016) com terapia de acordo com o regime 4xR-CHOP+2xR (n=293) num desenho aleatório e equilibrado de não-inferioridade. Os pacientes de 18 a 60 anos de idade tinham DLBCL de fase I ou II sem massa tumoral e foram atribuídos aleatoriamente a um dos dois braços do estudo (seis contra quatro ciclos de CHOP e seis doses de rituximab cada um). Os ciclos R-CHOP foram realizados a intervalos de 21 dias. O ponto final primário foi a não-inferioridade na sobrevivência sem progressão (PFS). Os parâmetros secundários foram vários parâmetros relevantes para a doença. 4xR-CHOP+2xR demonstrou ser não-inferior ao padrão 6xR-CHOP; a depuração das células cancerosas e a prevenção de recaídas foram comparativamente eficazes com quatro ciclos de quimioterapia como com seis ciclos. No que respeita à tolerabilidade, a redução da quimioterapia em dois ciclos teve um efeito favorável [1].
A taxa de PFS a 3 anos (parâmetro primário) após um seguimento mediano de 66 meses foi de 94% (95% CI, 91-97) na condição 6xR-CHOP (n=295) e 96% (95% CI, 94-99) na condição 4xR-CHOP+2xR (n=293). Os resultados também diferiram apenas ligeiramente em termos de taxa de OS de 3 anos após um seguimento mediano de 67 meses 98% (95% CI, 96-99) com seis ciclos contra 99% (95% CI, 98-100) com quatro ciclos [1].
Quanto à tolerabilidade, os resultados foram os seguintes: Em comparação com a condição 6xR-CHOP (1295 AA), o número total de AA na condição 4xR-CHOP+2xR (835 AA) foi cerca de um terço inferior [1]. O número total de eventos adversos não hematológicos (EA) de grau 3 e grau 4 foi maior no braço de tratamento 6xR-CHOP (70 EA) em comparação com o braço de 4 ciclos (46 EA) [1,4]. Relativamente às EAs hematológicas, no estado 6 R-CHOP, o número de indivíduos afectados foi superior em comparação com 4xR-CHOP+2xR: leucopenia de grau 3 ou 4 (110 vs. 80), anemia (8 vs. 80), anemia (8 vs. 8). 2) e trombocitopenia (7 vs. 5). Além disso, na condição 6xR-CHOP, mais pacientes foram afectados pela parestesia de grau 3 e 4 (14 vs. 12), náuseas (12 vs. 6), infecção (23 vs. 20), vómitos (7 vs. 1) e mucosite (3 vs. 1). A fim de se poder afirmar se a redução do número de ciclos R-CHOP tem influência nos efeitos negativos a longo prazo da quimioterapia, é necessário um acompanhamento durante um período adicional de cinco anos [1].
Tratamento personalizante: nova análise genética molecular
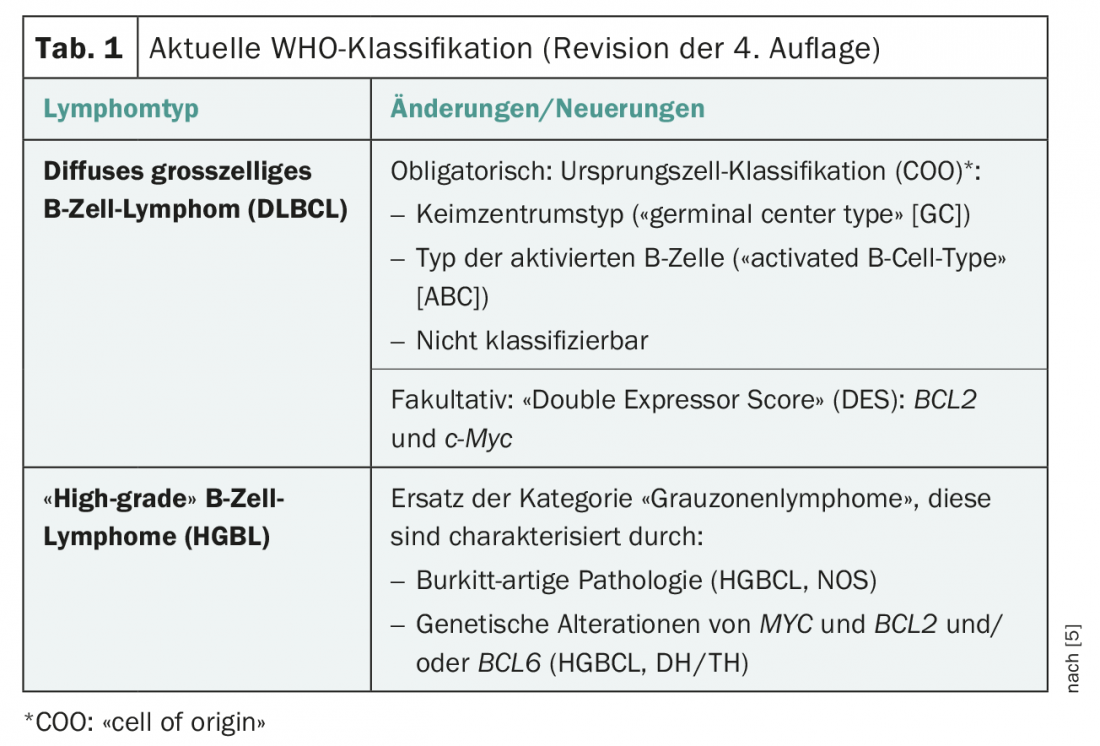
Os grandes linfomas difusos das células B podem ser subdivididos de acordo com critérios morfológicos (centroblástico, imunoblástico, anaplásico), de acordo com a expressão genética (“tipo célula B do centro germinal (GCB)”, “tipo célula B activada (ABC)”), de acordo com características imunohistoquímicas (em particular CD5, CD30, MYC, BCL2, BCL6, tipo GCB, não-GCB) e de acordo com anormalidades genéticas (em particular a translocação de MYC, BCL2 e/ou BCL6). Na edição mais recente da classificação da OMS, a definição de tipos de linfoma foi revista para incluir resultados de novos métodos de análise molecular, tais como “sequenciação da próxima geração” (Tab. 1) [5].
A identificação de subgrupos moleculares é uma base possível para a personalização do tratamento. Um estudo apresentado na ASH, que apareceu em paralelo no Journal of Oncology, retoma esta abordagem [2]. Dentro da variante centro germinal de célula B (GCB)-como a DLBCL (GCB-DLBCL), foi identificado um subgrupo que difere clínica e biologicamente numa assinatura de expressão genética HGBL-DH/TH-BCL2. Os antecedentes deste estudo foram a descoberta de que linfomas de células B de alto grau com MYC e BCL2 e/ou BCL6 (HGBL-DH/TH) respondem mal à terapia padrão (quimioimunoterapia). Para analisar as características moleculares do HGBL-DH/TH com BCL2 (HGBL-DH/TH-BCL2), bem como a morfologia do DLBCL, foi desenvolvida uma assinatura de duplo golpe de 104 genes (DHITsig) como característica distintiva entre HGBL-DH/TH-BCL2 de outros GCB-DLBCL.
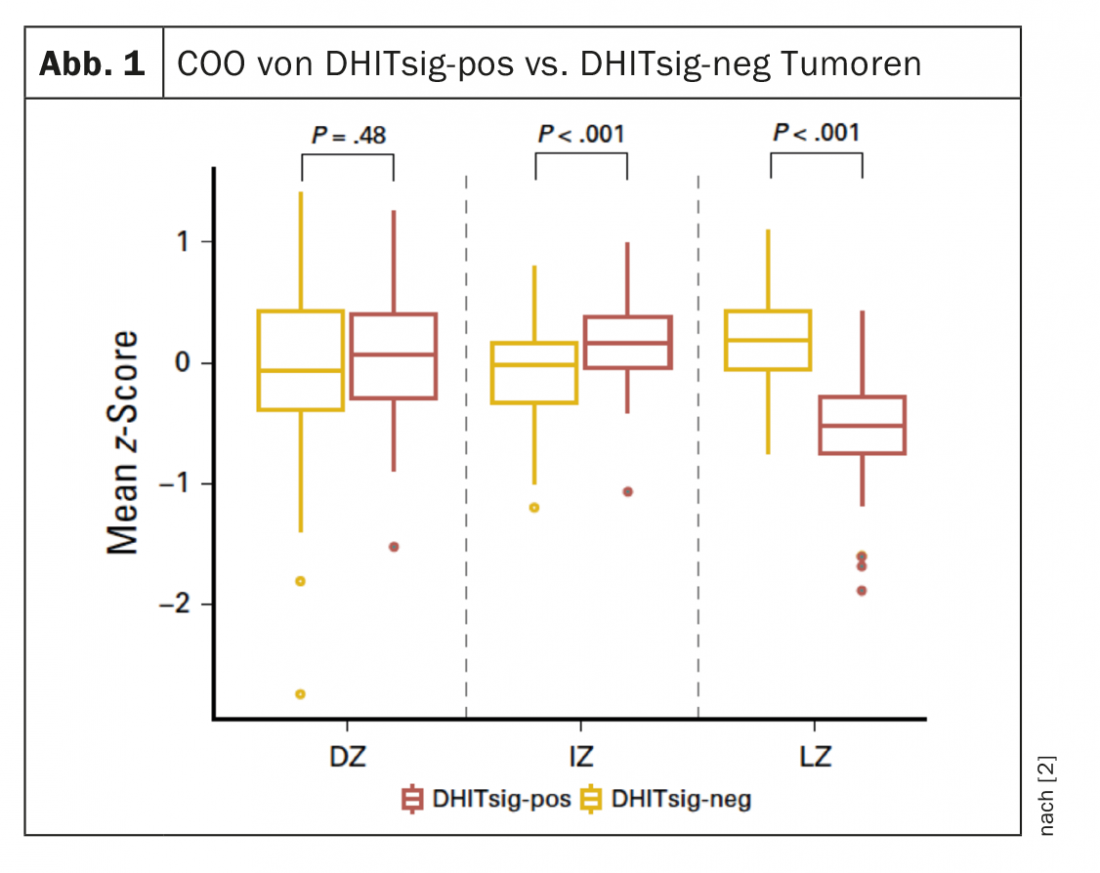
DHITsig identifica tumores que diferem em características biológicas que podem ser relevantes para a progressão e terapia. Os tumores DHITsig-pos são caracterizados por um COO da zona intermédia/escura do tipo centro germinal (GC) e têm uma expressão significativamente menor dos genes da zona de luz em comparação com os tumores DHITsig-negativos (p<0,001) (Fig. 1). Foi demonstrado que os pacientes com DHITsig-positivos tiveram um resultado pior após a imunochemoterapia R-CHOP do que os pacientes com DHITsig-negativos (taxa de sobrevivência sem progressão durante 5 anos, 57% e 81%, respectivamente; p<0,001), independente do estatuto HGBL-DH/TH-BCL2.
A expressão MYC em células centrais germinais normais é restrita às células localizadas dentro da LZ para reentrar na DZ. Os autores do estudo sugerem que estas células de reciclagem representam a contrapartida fisiológica das células tumorais DHITsig-pos. Para além de uma alta incidência de mutações dentro dos genes modificadores da cromatina, têm uma alta incidência de baixa expressão de MHC-I e MHC-II e um alto nível de expressão de genes associados à fosforilação oxidativa.
De acordo com os autores, estas características biológicas podem fornecer uma base para o desenvolvimento de substâncias activas específicas para além do actual foco nos indutores do BCL2. Possíveis abordagens terapêuticas que podem ser derivadas disto relacionam-se com a diferenciação celular (“potenciador dos inibidores do homólogo zeste 2”), redução da evasão imunológica (“inibidores deacetylase histone”), aumento da activação das células T (anticorpos anti-CD20 da geração mais recente), bem como fosforilação oxidativa e o proteasoma. Os altos níveis de expressão de certos genes também indicam que inibidores específicos podem ser benéficos (por exemplo, inibidores do araquidonato 5-lipoxigenase).
A análise do subgrupo pela assinatura da expressão genética DHITsig desenvolvida neste estudo pode ser utilizada para investigações de amostras de biópsia num contexto clínico.
Fonte: 60º Encontro ASH, 1-4 de Dezembro de 2018, San Diego (EUA)
Literatura:
- Poeschel V, et al: excelente resultado de pacientes jovens (18-60 anos) com linfoma difuso de grandes células B (DLBCL) tratado com 4 ciclos de CHOP mais 6 aplicações de rituximab: resultados dos 592 pacientes do ensaio FLYER do Dshnhl/GLA. Resumo Oral e Poster, Resumo No. 781: Sessão: 626. Apresentado em: Reunião Anual e Exposição ASH; 4-8 de Dezembro de 2018; San Diego, Califórnia. Resumo 781, https://ash.confex.com/ash/2018/webprogram/Paper112403.html
- Ennishi D, et al: Double-hit Gene Expression Signature Defines a Distinct Subgroup of Germinal Center B-Cell-Like Diffuse Large B-Cell Lymphoma. Journal of Clinical Oncology 2018; Dec 3:JCO1801583. doi: 10.1200/JCO.18.01583. [Epub ahead of print], Apresentado na 60ª Conferência Anual da Sociedade Americana de Hematologia, San Diego, CA, 1-4 de Dezembro de 2018.
- Pfreundschuh M, Truemper L, Osterborg A, et al: quimioterapia tipo CHOP mais rituximab em comparação com quimioterapia tipo CHOP apenas em pacientes jovens com linfoma de células B grandes difusas de bom prognóstico: um ensaio controlado aleatorizado pelo Grupo Mabthera International Trial (MInT). Lancet Oncology 2006; 7(5): 379-391.
- NIH: Instituto Nacional do Cancro. Divisão de Tratamento e Diagnóstico do Cancro. Common Terminology Criteria for Adverse Events, https://ctep.cancer.gov/protocolDevelopment/electronic_applications/ctc.htm#ctc_40, acedido pela última vez em 19.12.2018.
- Menter T, Dirnhofer S: OMS 2017: Progresso, regressão ou passo lateral? Swiss Med Forum 2018; 18(03): 52-54 DOI: https://doi.org/10.4414/smf.2018.03150.
InFo ONcOLOGIA & HaEMATOLOGIA 2019; 7(1): 30-31